脑苷肌肽联合天麻素治疗急性脑出血患者兴奋性氨基酸和氧化代谢产物水平的影响
梁新明,张保朝,付国惠
南阳市中心医院神经内科,河南 南阳 473000
急性脑出血(ACH)是神经内科常见的危急重症,其发病急骤,病情进展迅速,致残率及致死率均较高,临床需予以重视[1]。目前,利尿、降低颅内压等是临床治疗ACH 患者的常规方案,在短时间内能够发挥一定疗效,但远期疗效不理想。因此,需在常规治疗基础上实施更可靠的治疗方案,对改善患者的远期预后具有重要意义。脑苷肌肽作为促神经功能修复药物,可加速受损重视及四周神经组织修复,在脑血管疾病治疗中被广泛应用。马雪等[2]研究表明,脑苷肌肽治疗ACH的疗效确切,可减轻患者脑水肿,调节神经相关因子,促进神经功能恢复,改善患者预后。天麻素注射液是从中药天麻中提取的天麻素制成的中成药,可清除氧自由基,改善脑部微循环,提高神经细胞抗缺氧能力。谢尚鑫等[3]研究显示,天麻素注射液在治疗ACH方面具有特殊优势,可改善患者神经功能,减轻疾病严重程度。因此,本研究探讨脑苷肌肽联合天麻素治疗急性脑出血的疗效,以期为临床治疗该类患者提供参考依据,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2020 年1 月—2021 年2 月南阳市中心医院收治的84 例ACH 患者作为研究对象,随机分为试验组与对照组,每组各42例。试验组:男24例,女18例;年龄47~73岁,平均年龄(62.28±6.37)岁;出血部位:基底节区21 例,丘脑13 例,脑叶8 例。对照组:男23 例,女19 例;年龄52~76岁,平均年龄(62.59±6.11)岁;出血部位:基底节区20例,丘脑13例,脑叶9例。两组患者一般资料具有可比性(P>0.05)。本研究经南阳市中心医院医学伦理委员会审核后批准。
纳入标准:均经头颅CT 或MRI 检查证实,符合《中国脑出血诊治指南(2014)》的诊断标准[4];首次发病,发病时间<48 h;家属签署知情同意书。排除标准:凝血功能异常者;伴恶性肿瘤者;伴急慢性感染性疾病者;伴颅内血管畸形者;伴重要脏器功能严重异常者;伴免疫性疾病者;对本研究所用药物过敏者。
1.2 方法
试验组予以脑苷肌肽联合天麻素治疗,脑苷肌肽注射液(生产企业:吉林四环制药有限公司;批准文号:国药准字H22025046;规格:2 mL×6 支/盒)20 mL+5%葡萄糖溶液250 mL静脉滴定,1次/d;天麻素注射液(生产企业:广东邦民制药厂有限公司;批准文号:国药准字H44025145;规格:2 mL∶0.2 g/支)0.6 g+5%葡萄糖溶液500 mL静脉滴定,1次/d;疗程共2周。
对照组予以脑苷肌肽治疗,用法与试验组一致。
1.3 观察指标
1.3.1 标本采集 于治疗前及治疗2周后,采集两组患者患者的早晨空腹肘静脉血5 mL,在4℃条件下,置于TG1850-WS 台式离心机(湖南赛特湘仪离心机仪器有限公司)中,以4 000 r/min 的速度离心10 min,分离血清,置于-20 ℃冰箱中保存待用。
1.3.2 兴奋性氨基酸 采用日立L-8900 型氨基酸分析仪检测两组患者治疗前及治疗2 周后的血清谷氨酸、天冬氨酸水平,试剂盒购自中生北控生物科技有限公司。
1.3.3 氧化代谢产物 采用酶联免疫吸附试验(ELISA)检测两组患者患者治疗前及治疗2 周后的丙二醛(MDA)、活性氧(ROS)、晚期蛋白氧化产物(AOPP)、脂质过氧化氢(LHP)水平,所用仪器为JC-1086A 型酶标仪,试剂盒购自上海酶联生物科技有限公司。
1.3.4 神经相关因子 采用ELISA 法检测两组患者患者治疗前及治疗2 周后的血清脑源性神经营养因子(BDNF)、神经元特异性烯醇化酶(NSE)、神经生长因子(NGF)、神经胶质纤维酸性蛋白(GFAP)水平,所用仪器为JC-1086A 型酶标仪,试剂盒购自上海酶联生物科技有限公司。
1.4 统计学方法
采用SPSS 26.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后兴奋性氨基酸水平情况
治疗后,两组患者的谷氨酸、天冬氨酸均较治疗前明显下降低,且试验组患者低于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者治疗前后兴奋性氨基酸水平情况(±s)μmol/L
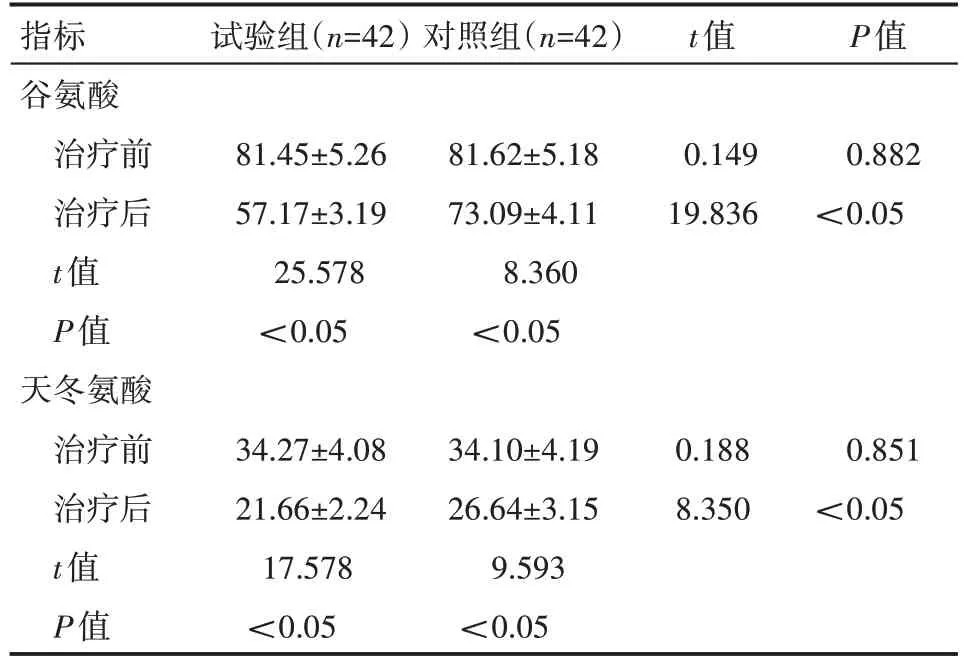
表1 两组患者治疗前后兴奋性氨基酸水平情况(±s)μmol/L
指标谷氨酸治疗前治疗后t值P值天冬氨酸治疗前治疗后t值P值试验组(n=42)对照组(n=42)t值P值81.45±5.26 57.17±3.19 25.578<0.05 81.62±5.18 73.09±4.11 8.360<0.05 0.149 19.836 0.882<0.05 34.27±4.08 21.66±2.24 17.578<0.05 34.10±4.19 26.64±3.15 9.593<0.05 0.188 8.350 0.851<0.05
2.2 两组患者治疗前后氧化代谢产物水平情况
治疗后,两组患者的AOPP、LHP、ROS、MDA 水平均较治疗前明显降低,且试验组患者低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后氧化代谢产物水平情况(±s)
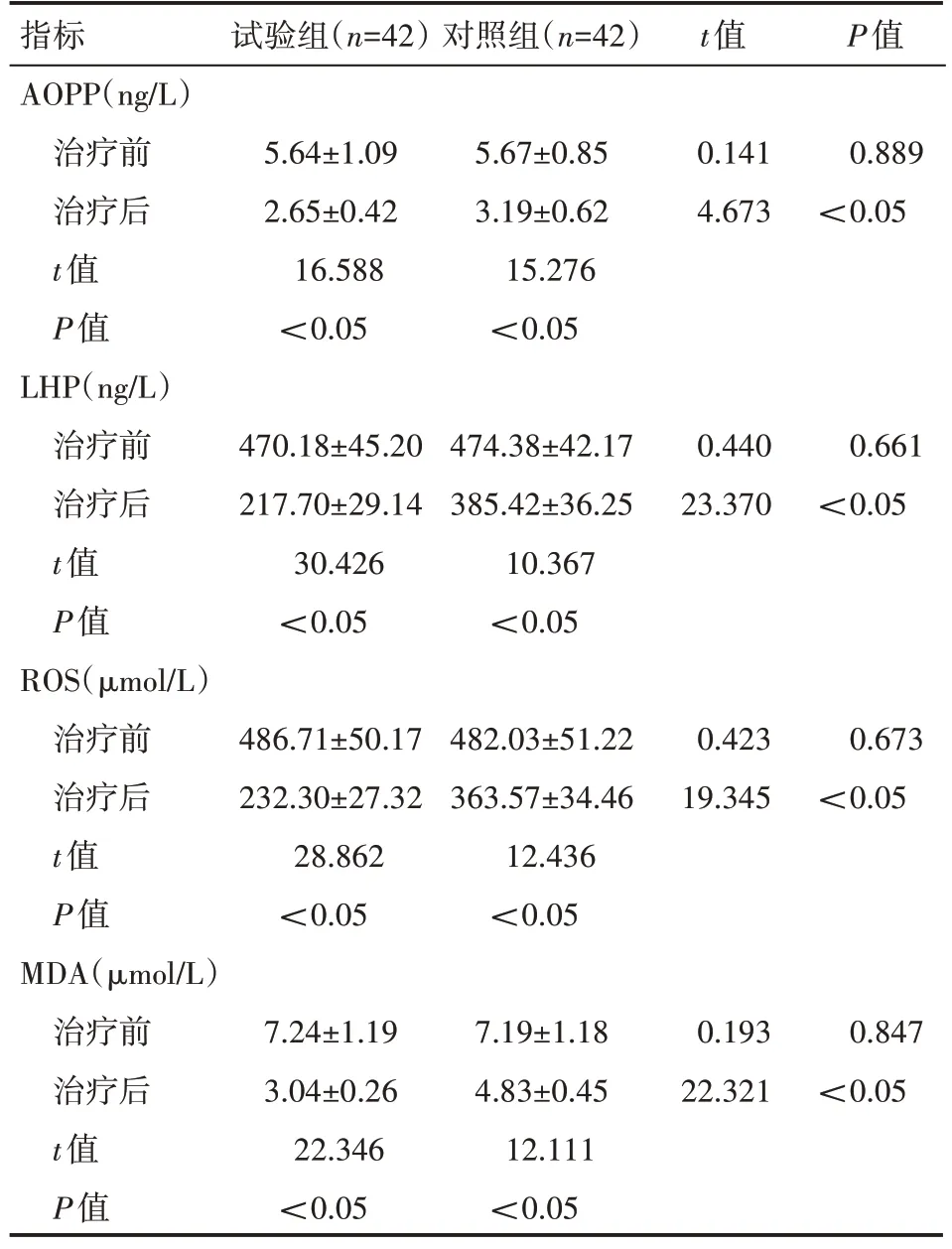
表2 两组患者治疗前后氧化代谢产物水平情况(±s)
指标AOPP(ng/L)治疗前治疗后t值P值LHP(ng/L)治疗前治疗后t值P值ROS(μmol/L)治疗前治疗后t值P值MDA(μmol/L)治疗前治疗后t值P值试验组(n=42)对照组(n=42)t值P值5.64±1.09 2.65±0.42 16.588<0.05 5.67±0.85 3.19±0.62 15.276<0.05 0.141 4.673 0.889<0.05 470.18±45.20 217.70±29.14 30.426<0.05 474.38±42.17 385.42±36.25 10.367<0.05 0.440 23.370 0.661<0.05 486.71±50.17 232.30±27.32 28.862<0.05 482.03±51.22 363.57±34.46 12.436<0.05 0.423 19.345 0.673<0.05 7.24±1.19 3.04±0.26 22.346<0.05 7.19±1.18 4.83±0.45 12.111<0.05 0.193 22.321 0.847<0.05
2.3 两组患者治疗前后神经相关因子水平情况
治疗后,两组患者的BDNF 水平较治疗前明显升高,NSE、NGF、GFAP水平较治疗前明显降低,且试验组患者BDNF 水平高于对照组,NSE、NGF、GFAP 水平低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后神经相关因子水平情况(±s)
指标BDNF(ng/mL)治疗前治疗后t值P值NSE(μg/L)治疗前治疗后t值P值NGF(μg/mL)治疗前治疗后t值P值GFAP(ng/L)治疗前治疗后t值P值试验组(n=42)对照组(n=42)t值P值1.56±0.27 3.21±0.45 20.376<0.05 1.53±0.29 2.54±0.33 14.899<0.05 0.491 7.781 0.625<0.05 13.09±1.39 7.83±0.51 23.023<0.05 13.17±1.26 9.87±0.80 14.329<0.05 0.276 13.936 0.783<0.05 18.64±4.24 4.53±0.37 21.485<0.05 18.15±4.90 7.62±1.14 13.565<0.05 0.49 16.708 0.625<0.05 1.36±0.36 0.55±0.19 12.896<0.05 1.32±0.32 0.86±0.26 7.230<0.05 0.538 6.239 0.592<0.05
3 讨论
ACH 是临床上常见的脑血管疾病之一,发病率较高,患者以中老年人群为主,起病急,病情进展快,颅内血肿压迫周围脑组织,进而引发神经功能障碍,如脑水肿、癫痫、脑室积血等,病情凶险,患者死亡风险较高[5]。由于ACH 的发病机制较为复杂,临床尚未完全明显,治疗难度较大。据调查统计,ACH 患者的病死率高达30%,严重威胁患者的生命安全[6]。对于ACH 患者的治疗,临床常规治疗方案包括降低颅内压、平衡水电解质、营养神经等,虽然可一定程度上改善患者的临床症状,但效果往往不佳,临床治愈率较低,患者的预后较差[7]。因此,寻找有效的药物治疗方案,进一步提升ACH患者的疗效,是当前神经内科医务工作者急需解决的重要课题。
脑苷肌肽由多肽与多种神经节苷脂制成,一般用于治疗神经内科疾病,能够减少控制兴奋性氨基酸释放,降低脑组织毒性,并可提高血液载氧能力,促进神经组织分化、修复及再生,清除局部脑组织氧自由基,促进脑组织新陈代谢,在改善神经功能障碍方面具有重要作用[8]。天麻素可抑制脑内乙酰胆碱酯酶及乙酰胆碱转移酶活性,提高机体抗氧化能力,可清除过量氧化自由基,改善脑内代谢[9]。谷氨酸与天冬氨酸是脑组织中主要的兴奋性氨基酸,具有神经元兴奋作用及神经毒性作用,脑损伤时,血脑屏障被破坏,兴奋性/抑制性氨基酸的合成稳态被打破,导致谷氨酸与天冬氨酸过度释放及堆积,抑制性氨基酸分泌减少,导致神经元兴奋性损伤[10]。BDNF 是脑源性神经营养因子,主要分布于中枢神经系统,可促进神经元细胞生长、发育及分化,可促进神经元再生,促使神经损伤的修复,减少自由基造成的神经细胞凋亡,其表达水平在一定程度上可反映神经功能损伤程度[11]。NSE是神经元及神经内分泌系统分泌的一种酸性蛋白酶,是糖酵解过程的关键酶,常存在于脑灰质神经细胞、末梢神经元内脑胶质细胞及其他神经组织中,脑组织受损后,NSE 会通过损伤的血脑屏障进入血液循环中,检测血清NSE 水平可评估神经元损伤程度[12]。NGF 是支配神经分化及交感神经存活的神经营养因子,可参与脑缺血损伤的保护过程,修复受损神经细胞,维持神经细胞存活,调节神经微丝蛋白,促进神经鞘细胞迁移,减轻缺血缺氧造成的脑损伤[13]。GFAP是构成胶质细胞的重要骨架成分,当发生脑组织损伤时,会从损伤的胶质细胞溢出,通过血脑屏障进入血液[14]。AOPP、LHP、ROS、MDA 均是氧化代谢产物,脑出血病灶局部处于严重缺氧状态,会导致氧化代谢产物增加,进一步诱导中性粒细胞、单核/巨噬细胞聚集,对神经元造成持续性损伤作用[15]。本研究结果表明,治疗后研究组患者的BDNF 水平显著高于对照组,血清LHP、ROS、MDA、谷氨酸、AOPP、GFAP、天冬氨酸、NSE、NGF 水平均低于对照组。结果提示脑苷肌肽联合天麻素治疗能够有效调节ACH患者的神经相关因子,减轻患者的氧化应激反应,促进患者的神经功能恢复,改善患者的脑内代谢状态。ACH 患者存在脑水肿,会促进兴奋性氨基酸生成,导致兴奋性/抑制性氨基酸失衡,患者神经系统处于缺氧状态,神经细胞进行无氧呼吸会增加氧化代谢产物生成,进一步损伤神经细胞。脑苷肌肽与天麻素联用有利于受损神经细胞的能力代谢,抑制兴奋性氨基酸释放,消除局部脑组织氧自由基,减轻对神经细胞的损伤,可促进ATP 合成,加快神经元修复,改善脑部微循环,增加脑血流量,解除缺氧时的脑痉挛,抑制兴奋性氨基酸及副代谢产物的生成,有利于其预后康复[16]。
综上所述,脑苷肌肽联合天麻素治疗可有效提高ACH患者的抗氧化能力,降低氨基酸水平,抑制副代谢产物生成,调节神经相关因子表达,改善脑内代谢水平。

