CT和MRI融合配准在口腔颌面部肿瘤中的应用*
郭建徕 聂 斐 周绪经 邵益森 蒋 琳 涂佛昊
江西中医药大学附属医院口腔科,江西省南昌市 360006
颌面部肿瘤因周围血管神经丰富,术中涉及颈部淋巴结清扫、皮瓣移植、骨移植的多方面,手术难度大,风险高,并发症多[1]。计算机体层摄影(CT)和核磁共振(MRI)是目前外科医师术前评估肿瘤的重要参考标准[2]。CT可清晰显示骨组织影像,了解骨组织肿瘤及侵袭范围,但对软组织结构显示欠佳 ;MRI 则软组织分辨力高,可以很好地显示肿瘤的浸润范围及病变中的不同组织成分,却无法精确显示骨结构。然而,上述影像收集了三维数据,通常只能在二维平面显示,限制了肿瘤病灶的三维立体展示[3]。肿瘤的三维建模结合3D打印可以直观立体、可操作性的多方位了解肿瘤。CT、MRI 的融合配准技术使CT 图像骨组织和MRI软组织成像的优势在融合后的图像中并存[4]。本研究旨在用CT和MRI融合图像数据为基础建模,分离出颌面部肿瘤模型,以精确判定肿瘤的边界及重要毗邻结构,以更好地进行术前规划,同期组织缺损修复,减轻手术并发症,早期恢复功能,提高患者生命质量。
1 资料与方法
1.1 一般资料 收集2018年1月—2021年10月于我院接受诊疗的口腔颌面部肿瘤病例12例,其中男患者10例,女患者2例;年龄35~79岁,平均年龄(51.67±11.89)岁;上颌骨肿瘤患者2例、下颌骨肿瘤患者2例、口底癌1例,舌癌7例,其中3例舌癌累及颌骨、1例累及咽部。纳入标准:术前行CT平扫、MRI 检查,并应用 CT及 MRI 图像配准融合技术建立颌面部肿瘤及颅骨模型、术前规划并模拟手术。排除标准:(1)不能配合检查的患者;(2)未采用手术治疗方案者。
1.2 方法
1.2.1 影像检查与审阅:患者术前行CT 及 MRI检查 ,并保存 CT 和 MRI 数据。CT 检 查:128 排双源 CT 机(炫速双源CT机,德国 Siemens),颌面部CT加后处理。MRI 检查: MR750 3.0T磁共振扫描仪(Discovery MR750 3.0T, 美国 GE),颌面部扫描。所有患者的 CT、MRI 图像均由1名放射科副主任医师和1名颌面外科主任医师双盲评价,确定肿瘤边界,毗邻血管分布,是否累及周围淋巴结。
1.2.2 CT、MRI 配准及肿瘤建模:将患者影像数据导入 3Dslicer,分别选取 CT (见图1-Ⅰ)和 MRI Out of phase OX T2(反相位T2加权横断面)序列(见图1-Ⅱ)进行配准。使用landmark registration模块手工标记4~6个标记点,半自动配准功能计算出CT与MRI坐标系间的转换关系,图像配准后获得重采样的MRI图像,其坐标与CT一致(见图1-Ⅲ)。根据重采样的MRI逐层分割出肿瘤软组织边界(图 1-Ⅳ),骨组织图像(见图1-Ⅳ)可以在segment editor模块通过阈值法自动分割得到,阈值区间采用 [185,3 071] ,并手动修正。最终建模得到肿瘤和颅骨的三维模型[5](见图 2),以 STL 格式导出模型数据,3D打印后进行术前规划,手术模拟,根据预计缺损范围确定术后修复方案。
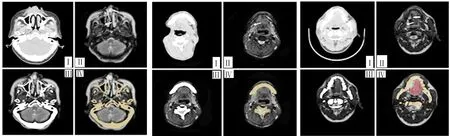
图 1 CT、MRI 图像的配准融合Ⅰ.CT 图像 Ⅱ.MRI 检查Out of phase OX T2序列图像 Ⅲ.CT、MRI的融合图像 Ⅳ.基于融合配准图像重建的颌面部肿瘤模型
2 结果
2.1 患者影像分析及建模 通过3Dslicer软件成功重建出颌面部肿瘤患者 CT、MRI 配准图像,分离颌骨、肿瘤及周边重要结构,建立了颌面部骨组织和肿瘤软组织融合的立体模型,图1分别列举了上颌骨、下颌骨、舌部肿瘤的CT、MRI、融合影像、肿瘤建模横断面影像。图2分别列举了上颌骨肿瘤、下颌骨肿瘤、舌部肿瘤建模后的三维影像。图2c为充分暴露舌部肿瘤,建模时去除了部分上颌骨的影像。

图2 颌面部肿瘤建模后的三维影像a.上颌骨肿瘤 b.下颌骨肿瘤 c.舌部肿瘤
根据建模获得的肿瘤模型,测量肿瘤最大直径,平均值为(4.20±1.76)cm(1.2 ~ 8)cm。根据 TNM分期,T4N0M0的例数最多,有6例;其次为T1N0M0,有2例,T2M0N0 1例,T3M0N0 1例,T4N1M0 1例,T4N2bM0 1例。
2.2 手术结果 术前根据颌面部骨组织和肿瘤软组织三维模型(图2)进行手术切除模拟,评价了不同切除范围对患者颌面部咀嚼、发音、颜面部美观的影响。12 例患者术前模拟的手术方案与实际手术执行的一致。术中冰冻结果切缘均为阴性,按肿瘤模型预备的皮瓣及腓骨合适。术后病理11例为鳞癌,1例考虑淋巴瘤。术后追踪肿瘤有无复发。失访患者 2 例,中位随访时间 7.2个月(2 ~ 12个月)。随访CT或MRI 图像均为正常术后表现,无复发征象。
3 讨论
术前CT、MRI的融合匹配可以更充分地了解颌面部肿瘤与周围组织关系,要将收集到的增强 CT 与 MRI图像进行配准、融合、分割和三维重建,首先CT与MRI拍摄时的头颅的位置应该是一致。CT和MRI半自动匹配是把不同模态的两个序列图像统一到新的坐标系。头颅位置一致,只需要简单的平移变换就可以较快的配准在一起,而且重复性高。如果位置明显不一致,半自动配准后的匹配度较差。可先将CT的图像进行转换,三维方向调整,获得与MRI一致头颅位置的CT图像,再进行半自动匹配,较易匹配,但多次转换可能降低数据的可信度。然后,配准采用半自动的点配准方式进行,分别在CT 及 MRI 图像上选择具有特征性的点、线、面提取标志点。头部可选取左、右侧眼球、第2颈椎椎体及鞍底中心等 4 个解剖标志点进行配准。此外,部分病例还增加了鼻尖点、软硬腭交界的中点等点辅助。这2个标志点靠近颌面部,有利于颌面部组织的优先配准。融合后,MRI获得了与CT匹配的新坐标系,纠正了垂直向的空间失真,配准后再行分割的MRI图像准确度更高。
Longo 等[6]提出了“5P”医学的概念,包含了预防性(Preventive)、预测性(Predictive)、个体化(Personalized)、参与性(Participatory)和精准性(Precision)[7],“5P”医学模型是一种跨学科和多学科的方法。医学影像的日益优化和图像处理技术的智能化为“5P”医学的新兴创造了良好的条件。术前CT、MRI的融合匹配可以更充分地了解颌面部肿瘤与周围组织关系,精准地确定手术安全边界;术前可使用软件对颌骨进行旋转,模拟切除、虚拟修复、模拟内固定置入[8],通过术前手术方案设计、操作预演、颌骨切除导板的使用,可以更好地预测手术风险、损伤范围等;可根据术前设计的最佳截骨范围,预测术后骨骼缺损的形状,可个体化制作出形态、大小完全一致的颌骨缺损模型,最大限度与骨面相贴合,骨骼塑形更快而更好地匹配颌面部复杂的解剖结构[9]。目前虚拟技术亦允许即刻放置腓骨并以咬合为导向引导种植体的位置,也允许即刻的个体化义齿修复[10],但其围手术期管理与手术流程技巧等亟待完善[7];可经患者同意3D打印出颌骨和肿瘤模型的三维建模,直观地为患者提供术前咨询和方案讨论,加强患者的参与感。
CT与MRI配合准融合技术在术后软组织的修复中较单独的CT更具优势。例如其中1例上颌骨缺损肿瘤已向鼻腔延伸,修复时不仅要考虑骨组织的缺损,还要斟酌软组织和黏膜的缺损,可在CT和MRI配准融合的计算机模型上纠正偏曲的鼻中隔及鼻翼,恢复和谐的面中份形态,再计算分割口腔、鼻腔所需要的软组织尺寸;还应考虑到该患者现有上颌骨牙槽嵴低平,为后期牙列的更好修复应尽量恢复正常的牙槽嵴高度,这就需要更多的软组织[10]。
目前颌骨缺损多采用自体骨和异体骨移植,但是自体骨来源不足、异体骨容易免疫排斥,因此衍生了各种人工骨材料。如个性化塑型的骨水泥植入物,聚醚醚酮(PEEK)材料,羟基磷灰石晶体—可溶性胶原支架复合骨髓间充质干细胞和人脐静脉内皮细胞,明胶/海藻酸钠/58S生物玻璃骨缺损修复支架复合大鼠骨髓间充质干细胞,均获得了较多的新生骨,骨密度接近正常骨组织。后续研究中期望能寻找出可推广的骨缺损替代材料,实现颌骨与牙列同日重建。
综上所述,CT、MRI图像配准融合,可以充分发挥CT和MRI图像的优势,更好地了解肿瘤边缘、性质及毗邻解剖关系,提高颌面部肿瘤手术的预测性、个体化、参与性和精准性,在口腔颌面部肿瘤术前规划、预后评估及术后个体化修复中有重要的应用价值。

