Ang-2、IL-6在子宫肌瘤患者中的表达及其与术后转归的相关性
邓正凤 吕 琳 曾德春 范婷婷
重庆市合川区人民医院妇科 401520
子宫肌瘤剔除术不仅可有效切除肌瘤,减轻患者病情,还可保留患者生育功能,改善患者生活质量[1]。研究显示,子宫肌瘤细胞生长活跃且伴有不同程度的核分裂,术后仍具有较高复发风险,影响患者病情转归[2]。缪文莉等[3]研究指出,子宫肌瘤患者术后残留复发风险较高,易增加二次手术风险,影响患者生育功能。可见,为降低子宫肌瘤术后复发风险,探求与其发病及复发有关的生物标志物具有一定临床意义。促血管生成素(Angiopoietin,Ang)-2为促血管生成家族成员,是一类与血管生成有关的蛋白质,在促进新生血管生成中具有重要作用[4]。目前已有研究发现,Ang-2参与良恶性肿瘤生长,与结直肠癌患者预后有关[5]。白细胞介素(Interleukin,IL)-6是免疫细胞作用于其他细胞所产生的蛋白质,在早期评估肿瘤微炎症状态中具有一定优势,可通过介导炎症反应参与肿瘤病情进展[6]。由此认为,Ang-2、IL-6存在于子宫肌瘤组织中,可通过促进血管生成、加重炎症反应等机制促进肌瘤生长,影响术后病情转归,会在一定程度上增加复发风险。鉴于此,本研究将观察Ang-2、IL-6在子宫肌瘤组织中的表达,并分析二者与子宫肌瘤剔除术后肌瘤复发的关系,为降低子宫肌瘤术后复发风险提供一定参考依据,现总结如下。
1 对象与方法
1.1 研究对象 选取我院2018年6月—2019年6月收治的106例子宫肌瘤患者作为研究对象,患者及家属签署知情同意书。纳入标准:(1)子宫肌瘤符合《妇产科学》[7]中相关诊断;(2)首诊子宫肌瘤患者,且均为单发病灶;(3)在本院接受腹腔镜子宫肌瘤剔除术治疗;(4)患者有生育需求,强烈要求保留子宫。排除标准:(1)合并妇科恶性肿瘤,如乳腺癌、卵巢癌等;(2)合并原发性凝血功能障碍;(3)合并妇科炎症疾病,如子宫内膜炎、阴道炎等;(4)合并自身免疫性疾病;(5)妊娠期或哺乳期女性;(6)既往有子宫手术史;(7)长期服用雌激素药物或免疫抑制剂;(8)术前已接受其他治疗;(9)随访期间失访者。本研究经医院医学伦理委员会批准。纳入的106例患者,年龄32~46岁,平均年龄(39.54±2.18)岁;体重指数(BMI)18.2~25.2kg/m2,平均BMI(21.61±0.68)kg/m2;病变部位:子宫体88例、子宫颈18例;疾病类型:肌壁间肌瘤56例、浆膜下肌瘤30例、黏膜下肌瘤20例;肌瘤直径3.6~4.8cm,平均直径(4.23±0.32)cm;孕产史:有孕产史89例、无孕产史17例;家族史:有家族史26例、无家族史80例。
1.2 方法
1.2.1 子宫肌瘤术后转归评估方法:所有患者均在医院接受子宫肌瘤剔除术治疗,于术后接受为期3年随访,全部患者均于术后每3个月返院复查,复查期间行超声检查,评估随访期间肌瘤复发情况,包括局部复发和区域复发,对影像学及生化检查有异常情况患者行穿刺活检,以复发为终点事件。
1.2.2 实验室指标检测方法:术前,采集其空腹外周静脉血4ml,以3 500r/min速率离心10min获取血清(离心半径为10cm,离心机购自南京贝登医疗股份有限公司,型号:Micro-21),放置于-20℃冷藏柜中送检。采用酶联免疫吸附法(试剂盒购自上海研启生物科技有限公司)检测雌激素水平:血清孕酮(P)、卵泡刺激素(FSH)、雌二醇(E2)、黄体生成素(LH)水平;术中待肌瘤剔除后采用生理盐水清洗病灶,并放置液氮中保存,送至检验科检查。定量分析:Western blotting法,将两组标本匀浆,加入尿素裂解液,冰上裂解1h,于4℃下以3 000r/min速率离心20min,收集上清液采用12% SDSPAGE电泳分离蛋白,半干法转印到PVDF膜,取5%脱脂奶粉封闭60min,之后加入一抗,4℃孵育过夜,再加入二抗于37℃孵育50min后,采用化学发光试剂显像,凝胶成像系统成像,观察Ang-2、IL-6表达量,上述操作均遵守实验室及试剂盒相关规定进行。P参考范围:排卵前0~4.8nmol/L、排卵后7.6~97.6nmol/L;FSH参考范围:排卵前1.5~10IU/ml、排卵后2~10IU/ml;LH参考范围:排卵前2~15IU/ml、排卵后4~10IU/ml;E2参考范围:排卵前48~521pmol/L、排卵后272~793pmol/L。
1.3 临床资料收集 设计一般资料调查问卷,统计两组临床资料:年龄、BMI、病变部位(子宫体/子宫颈)、疾病类型(肌壁间肌瘤/浆膜下肌瘤/黏膜下肌瘤)、肌瘤直径、孕产史(有/无)、家族史(有/无)。

2 结果
2.1 子宫肌瘤术后病情转归情况 106例患者术后均完成为期3年随访,无失访者。术后第1年随访复发6例,第2年随访复发12例,第3年随访复发12例,共复发30例,总复发率为28.30%(30/106),未复发占71.70%(76/106)。
2.2 两组一般资料比较 复发组肌瘤直径明显长于未复发组,差异有统计学意义(P<0.05);两组其他一般资料比较,差异无统计学意义(P>0.05)。见表1。
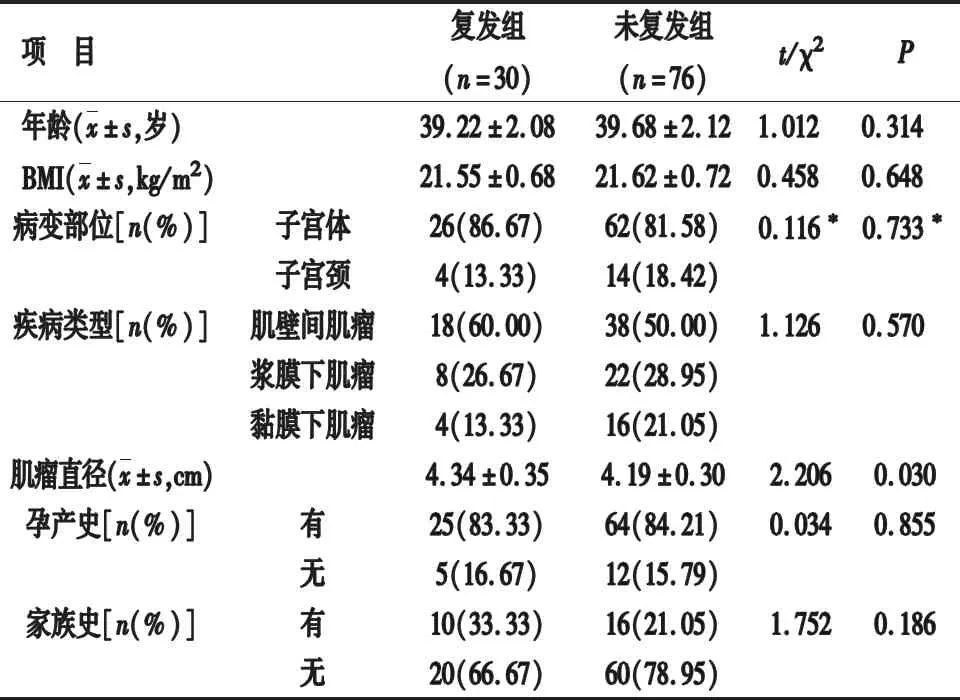
表1 两组一般资料比较
2.3 两组实验室指标比较 复发组组织中Ang-2、IL-6表达以及血清P、FSH、E2、LH表达均高于未复发组,差异有统计学意义(P<0.05)。见表2。

表2 复发组和未复发组实验室指标比较
2.4 各指标与子宫肌瘤术后转归关系的Logistics回归分析 将子宫肌瘤术后转归情况作为因变量(1=复发,0=未复发),将表1及表2中比较差异有统计学意义的变量纳入作为自变量(均为连续变量),经多项Logistic回归分析显示,组织中Ang-2、IL-6过表达,血清P、LH过表达与子宫肌瘤术后复发有关(P<0.05)。见表3。
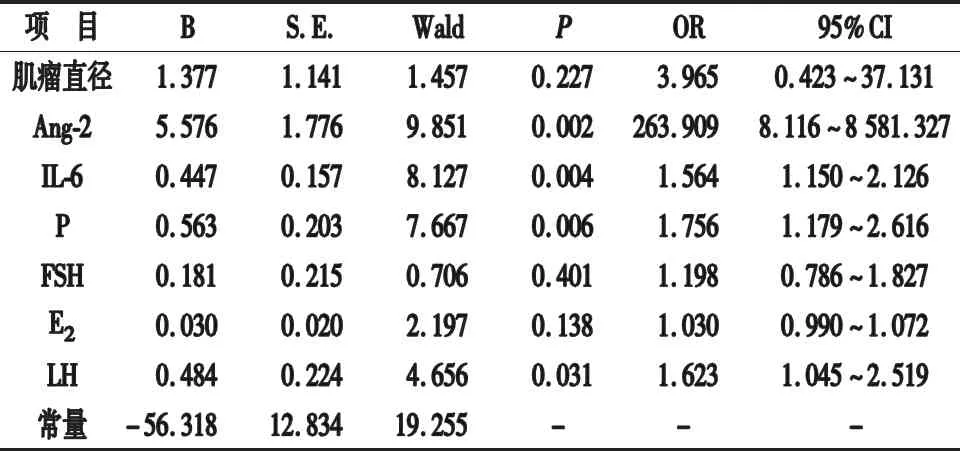
表3 各指标与子宫肌瘤术后转归关系的Logistics回归分析
2.5 组织中Ang-2、IL-6预测子宫肌瘤术后复发的ROC曲线 将子宫肌瘤术后复发情况作为状态变量(1=复发,0=未复发),将组织中Ang-2、IL-6作为检验变量(均为连续变量),绘制ROC曲线图显示,Ang-2、IL-6预测术后复发的AUC分别为0.795、0.803,均有一定预测价值。见表4、图1。
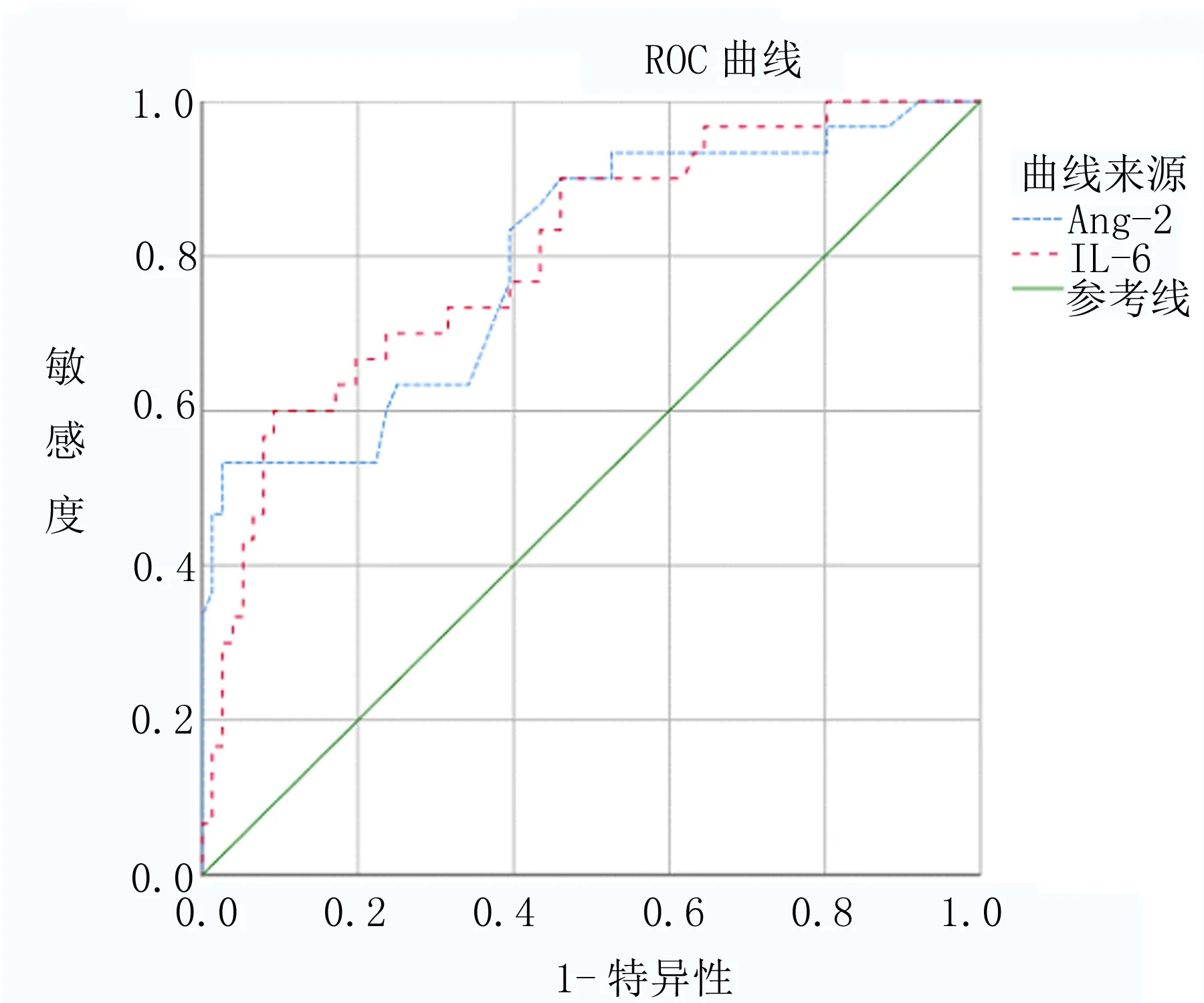
图1 组织中Ang-2、IL-6预测子宫肌瘤术后复发的ROC曲线

表4 组织中Ang-2、IL-6预测子宫肌瘤术后复发的ROC曲线分析
2.6 组织中Ang-2、IL-6联合预测子宫肌瘤术后复发的决策曲线 以净收益率为纵坐标,以高风险阈值为横坐标,绘制决策曲线显示,当高风险阈值为0.0~1.0时,净收益率>0,具有临床意义,且高风险阈值越小,净收益率越大;在阈值0.2~0.5,0.6~1.0范围内,组织中Ang-2、IL-6联合预测子宫肌瘤术后复发的净获益率高于单一检测,见图2。
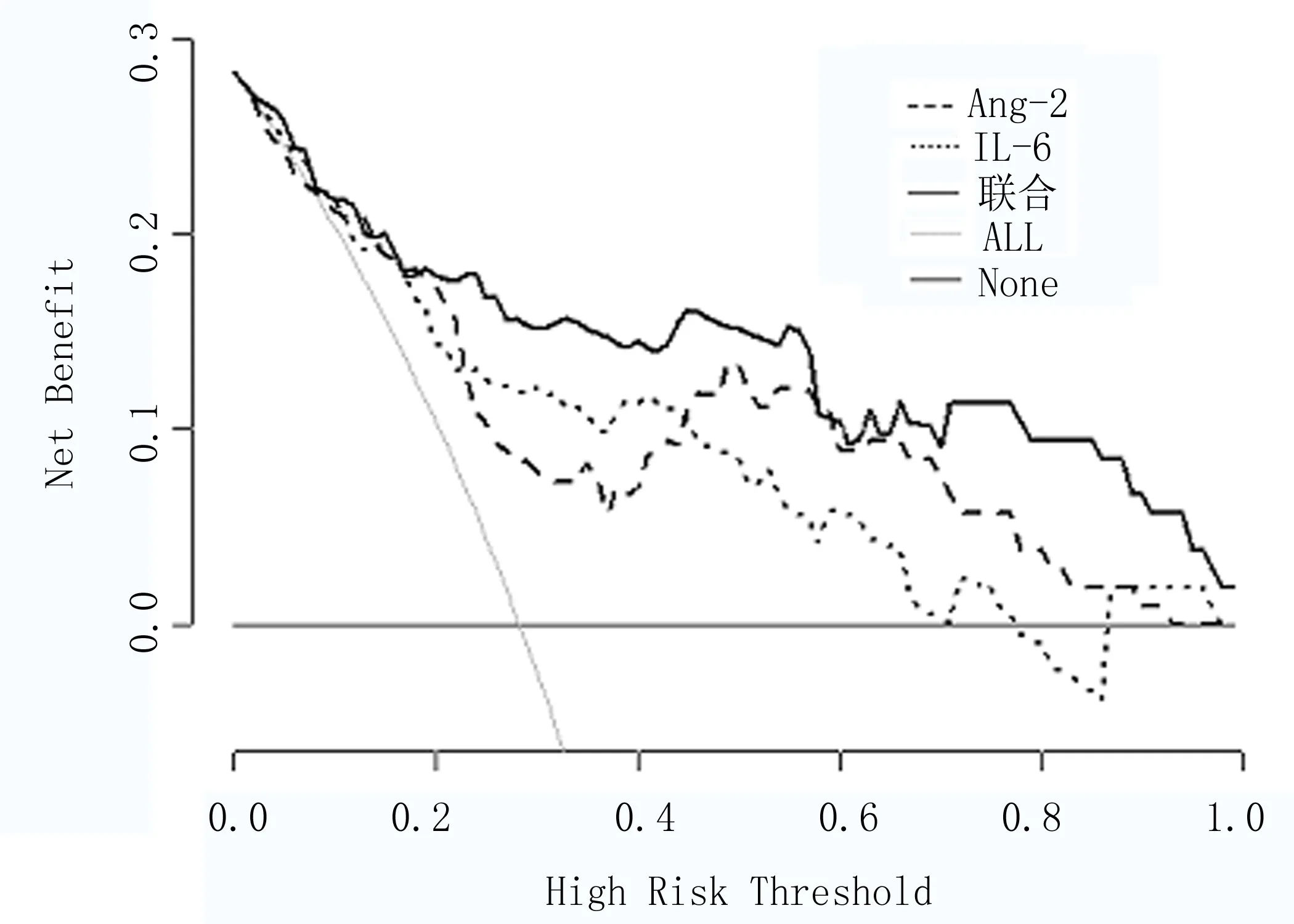
图2 组织中Ang-2、IL-6联合预测子宫肌瘤术后复发的决策曲线
3 讨论
手术是治疗子宫肌瘤的主要方式,子宫肌瘤剔除术可在切除肌瘤同时保障患者生育能力,但术中易存在细小残留病灶,增加术后复发风险,影响患者病情转归。近年来,臧丽娟[8]在研究子宫肌瘤术后复发情况中显示,209例患者术后3年复发率高达25.36%。本研究同样发现,106例患者术后3年复发率约28.30%,进一步证实子宫肌瘤术后复发风险较高。因此,探究可影响其复发的生物标志物对改善子宫肌瘤患者的预后具有重要意义。
研究指出,子宫肌瘤为性激素依赖性肿瘤,性激素不仅可通过刺激表皮生长因子,诱导肌瘤形成,还可改变组织局部供血、促进血管生成,进而促进子宫肌瘤发病、生长,加重患者的病情[9]。但性激素检测在患者经期、排卵期等不同时期差异性较大,且检测结果的准确性受患者内分泌影响,将其用于预测术后转归仍有局限,仍需探究其他指标以提高预测结果准确性。
Ang-2是一种血管生长调节因子,既含有受体激动剂,也含有受体抑制剂,它可通过与内皮细胞酪氨酸激酶受体相结合促进肿瘤血管生成,利于肿瘤生长,影响肿瘤病情转归[10]。IL-6作为一种促炎因子,在慢性炎症维持中发挥重要作用,可通过维持肿瘤局部慢性炎症反应,改善肿瘤生长环境,利于肿瘤生长[11]。本研究结果显示,复发组组织中Ang-2、IL-6表达高于未复发组,初步说明组织中的Ang-2、IL-6与子宫肌瘤术后复发具有一定关系。本研究经过Logistic回归分析显示,组织中的Ang-2、IL-6过表达与子宫肌瘤术后复发有关,进一步证实上述研究结果。
Ang-2的受体为TiE2,该受体参与血管生成的延续过程,促使血管成熟稳定[12]。同时,Ang-2与Tie-2结合后可消除血管基底膜和周围间质细胞对血管形成的限制性,利于促进内皮细胞增生,诱导新生血管生成,为肿瘤生长提供有利条件,进而增加术后复发风险[13]。此外,Ang-2与其受体结合后,还可增加内皮细胞对血管内皮生长因子(Vascular endothelial growth factor,VEGF)的敏感性,加速内皮细胞分裂、迁移,促进肌瘤内部血管持续生成,提高肌瘤内部血流灌注,利于肌瘤生长,影响术后转归[14]。Kim H等[15]研究显示,Ang-2过表达可通过破坏内皮细胞和周围基质,增强诱导血管重建和新生血管生成,为肿瘤血液供应提供保障。李利玲[16]在研究Ang-2与子宫肌瘤术后转归中发现,复发组Ang-2水平显著高于未复发组,认为Ang-2过表达是子宫肌瘤术后复发的危险因素。由此可见,组织中Ang-2过表达可增加子宫肌瘤术后复发风险,影响患者病情转归。IL-6过表达可促使机体炎症细胞因子聚集,产生局部或全身炎症反应,激活局部炎症反应,而肌瘤局部炎症激活后,可刺激内皮细胞、平滑肌异常增殖,利于促进微血管形成,促进肌瘤增生,尽管手术切除后,由于局部炎症反应尚未消退,肌瘤仍有一定复发风险[17]。向红卫等[18]研究显示,IL-6在子宫肌瘤患者中呈高表达,用于评估子宫肌瘤具有一定临床意义。李春容[19]在IL-6与子宫肌瘤的关系研究中也发现,子宫肌瘤组织内IL-6可通过维持慢性炎症反应,参与肌瘤生长过程,可在一定程度上影响患者预后。由此认为,组织中IL-6过表达与子宫肌瘤术后复发有关。
本研究在最后通过绘制ROC曲线验证各研究结果,发现组织中Ang-2、IL-6预测子宫肌瘤术后复发均有一定价值,可见,检测组织中Ang-2、IL-6表达可预测子宫肌瘤术后复发风险。此外,本文还通过绘制决策曲线显示,在阈值0.2~0.5、0.6~1.0范围内,组织中Ang-2、IL-6联合预测子宫肌瘤术后复发的净获益率高于单一检测,进一步证实上述研究结果的真实性。未来可在肌瘤切除后考虑检测组织中Ang-2、IL-6表达量,评估术后复发风险,早期制定相关治疗措施,通过抑制肌瘤血管生成、减轻局部炎症反应,以降低肌瘤复发风险,促进病情转归。但本研究的结果均采用定量分析方法,具有一定主观性,在精确度、敏感度及特异性方面尚存一定误差,此为本研究结果局限,未来仍需对检测方法进一步优化,对检验医师进行专业培训,进一步提高检测结果准确性、真实性。
综上所述,子宫肌瘤组织Ang-2、IL-6过表达与术后肌瘤复发有关,检测组织中Ang-2、IL-6表达可预测术后肌瘤复发风险,且联合检测可进一步提高预测效能,未来可考虑将Ang-2、IL-6作为子宫肌瘤术后治疗靶点之一,通过抑制局部血管生成和炎症反应,降低子宫肌瘤复发风险,以促进患者病情转归。

