DCE-MRI定量灌注参数与原发性肝癌病理分级及预后的关系
张文涛 王 力 王 俊
原发性肝癌(primary liver carcinoma,PLC)是一种恶性程度较高的实体肿瘤,其肿瘤细胞的生长和浸润与肿瘤血管形成密切相关,血供充足时肿瘤组织血管形成并为肿瘤细胞的分化和发育提供了条件,加速疾病进展[1]。PLC在我国的发病率较高,且每年约一半的新增PLC患者在我国,恶性肿瘤死亡患者中约19%为PLC患者[2],严重影响我国人民的生活质量和社会发展。而PLC起病隐匿,多由慢性肝炎和肝硬化发展而来,患者早期可无明显症状,但疾病进展迅速,使得大多数患者在就诊时已处于疾病晚期或已发生转移,预后较差严重影响患者生命健康[3]。因此,早期及时诊断对于延缓疾病进程、改善患者预后有重要意义。病理组织活检作为PLC诊断的“金标准”对于癌变的早期诊断有一定价值,但其有创,往往耗时较长,操作复杂,存在一定局限[4],PLC是典型的富血管肿瘤,肿瘤血管形成后逐渐取代正常血管,使得原本以门静脉为主的血供逐渐转变为以形成的肿瘤动脉血供为主[5],故对肝组织血流动态进行检测有助于判断疾病进展。动态对比增强磁共振成像(dynamic contrast enhanced MRI,DCE-MRI)技术基于三维容积薄层扫描的梯度回波T1WI序列,将磁共振对比剂注入肝组织静脉团内,进而展开反复快速的扫描,检测出肝脏组织内部血流情况,其可定量评估肝脏组织内血管性质[6]。既往研究报道,磁共振技术可评估肿瘤组织内的微循环状况,反映组织病变程度,在评估肝脏恶性肿瘤组织血管的渗透性和血供中起着重要的辅助作用[7]。本研究将着重分析DCE-MRI定量灌注参数与PLC患者Edmondson-Steiner's 肿瘤病理分级之间的关系,对患者预后进行评估,以期为PLC患者的临床治疗提供依据。
1 资料与方法
1.1 临床资料
回顾性分析2018年1月至2019年4月我院收治的原发性肝癌106例患者的临床资料,将其作为观察组,选择同期我院就诊的肝脏良性结节患者52例作为对照组。诊断依据:两组患者均经临床病理组织学检查和临床检查确诊为PLC和肝脏良性结节患者[8]。纳入标准:①符合组织病理学和临床诊断标准;②均为首次发病;③均符合DCM-MRI检查适应症;④知情同意自愿配合;⑤随访信息完整。观察组排除标准:①肿瘤转移或浸润其他组织及器官;②暂未行手术介入治疗等;③合并其他重要脏器损伤。对照组排除标准:①合并恶性肿瘤或其他器官病变;②严重传染性疾病、免疫系统疾病等。观察组106例:男性63例,女性43例;年龄38~61岁,平均(50.13±8.21)岁;基础病史:乙型肝炎47例,高血压20例,冠心病39例;Edmondson-Steiner's肿瘤病理分级[9]:轻度组32例,中度组36例,重度组38例。对照组52例:男性28例,女性24例;年龄35~63岁,平均(51.78±8.64)岁;基础病史:乙型肝炎19例,高血压16例,冠心病17例。两组患者上述一般资料无明显差异(P>0.05)。
1.2 方法
应用磁共振仪(西门子3.0T磁共振成像系统)对上述患者进行DCE-MRI检查,先将腹部相控阵线圈设为6通道,指导患者尽量屏住呼吸,小幅度轻微换气,常规平扫后进行快速、动态和增强扫描,扫描参数设置如下:视野(field of view,FOV)=(320×290)mm,重复时间(repetition time or time of repetition,TR)为4.1 ms,回波时间(echo time or time of echo,TE) 为1.4 ms,间隔为0层,3.6 mm层厚,矩阵为290×185,设置激励次数为1,增强扫描时每个周期持续约6 s,30层,全程扫描共5 min左右。从第二个周期开始在肘正中静脉注入对比剂钆双胺(Gd-DTPA-BMA)0.2 ml/kg,注入速度保持在4 ml/s,对比剂注入完成后按照同样速度注入20 ml生理盐水冲洗,扫描过程中指导患者屏住呼吸,可进行快速轻微换气。DCE-MRI扫描完成后,使用西门子4D-Tissue配套处理软件系统选择Tofts双室模型对结果进行分析,避开坏死组织、血管区域。选择3个感兴趣视野,测定定量灌注参数:对比剂从血管到组织间的渗透率(volume transfer constant,Ktrans)、血管容积分数(vascular plethysmography,Vp)、血管外细胞外间隙体积百分比(the extravascular-ex tracellular volume fraction,Ve)、血管外细胞外间隙转运至血管内的速率常数(rate constant,Kep)值,测定至少3个视野后取平均值,扫描图像与结果由两名经验丰富的影像医师进行判读。
1.3 统计学方法

2 结果
2.1 观察组与对照组DCM-MRI定量参数值的比较
观察组DCM-MRI定量参数Ktrans、Vp、Ve和Kep均较对照组高(P<0.01),见表1。

表1 观察组与对照组DCM-MRI定量参数值的比较
2.2 不同严重程度PLC患者DCM-MRI定量参数的比较
重度组患者DCM-MRI定量参数Ktrans、Vp、Ve和Kep均较轻度组和中度组高,中度组上述参数较轻度组高,差异均有统计学意义(P<0.01),见表2。

表2 不同严重程度PLC患者DCM-MRI定量参数的比较
2.3 DCM-MRI各定量参数之间的关系及其与肿瘤病理分级的相关性
Spearman相关性结果显示,DCM-MRI各定量参数Ktrans、Vp、Ve和Kep与PLC病理分级均为正相关(γ=0.522、0.501、0.513、0.574,P<0.05),见表3。
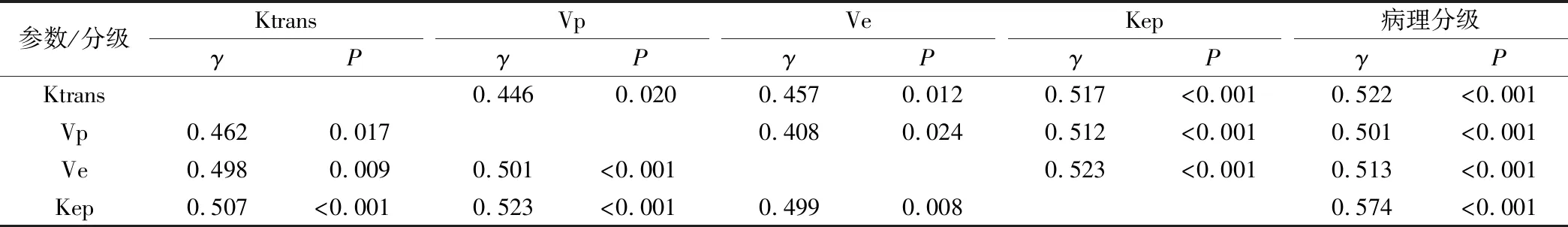
表3 DCM-MRI各定量参数之间的关系及其与肿瘤分级的相关性
2.4 DCM-MRI各定量参数及联合指导PLC病理分级的ROC分析
经过ROC曲线分析,DCM-MRI各定量参数Ktrans、Vp、Ve和Kep指导PLC轻度与中、重度的分级均有较高效能,四者联合时效能最高,其曲线下面积为(area under the curve,AUC)为0.841,约登指数为0.797,敏感度、特异性分别为92.31%、93.24%,见表4和图1。
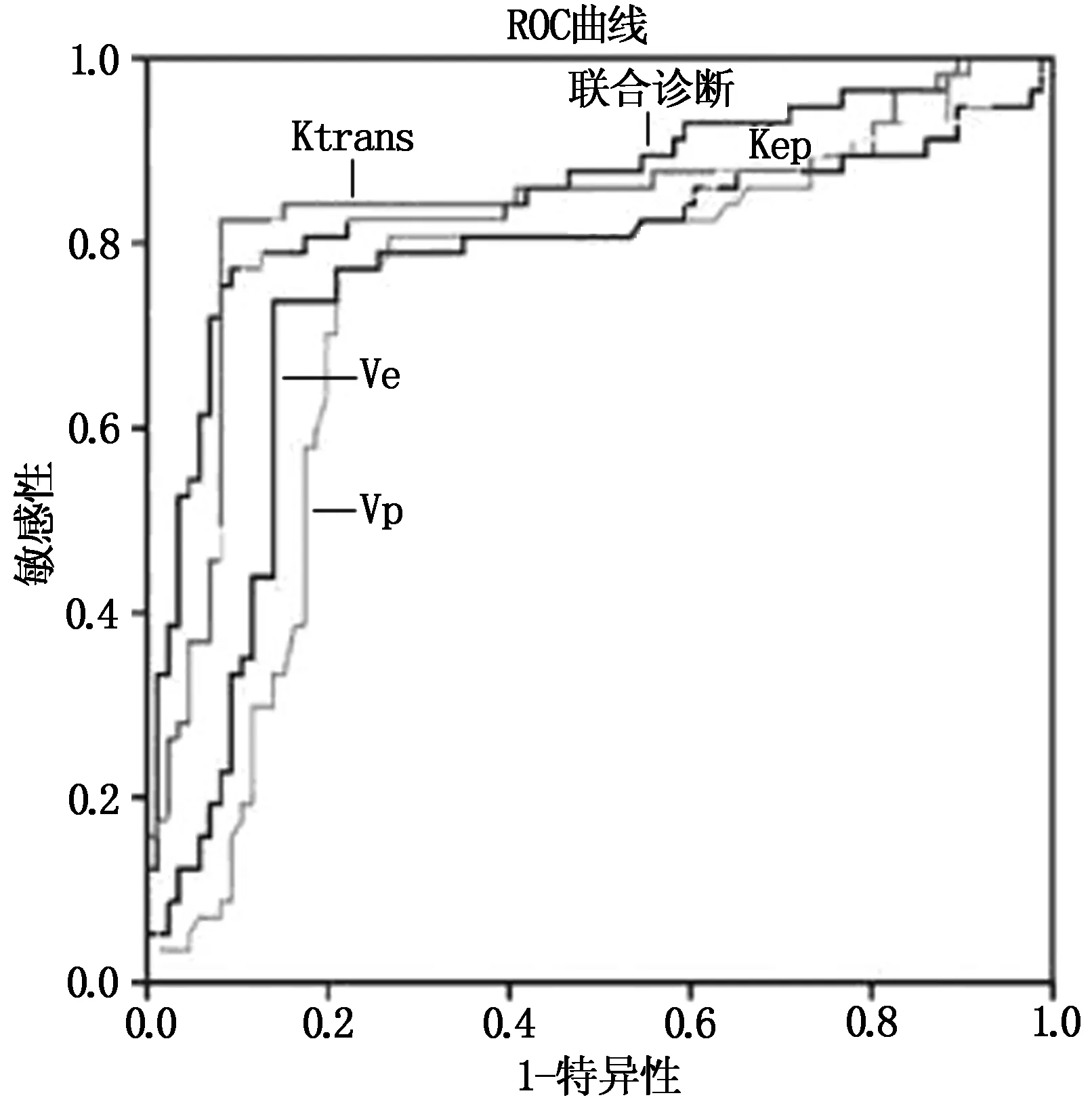
图1 DCM-MRI各定量参数指导PLC病理分级的ROC曲线
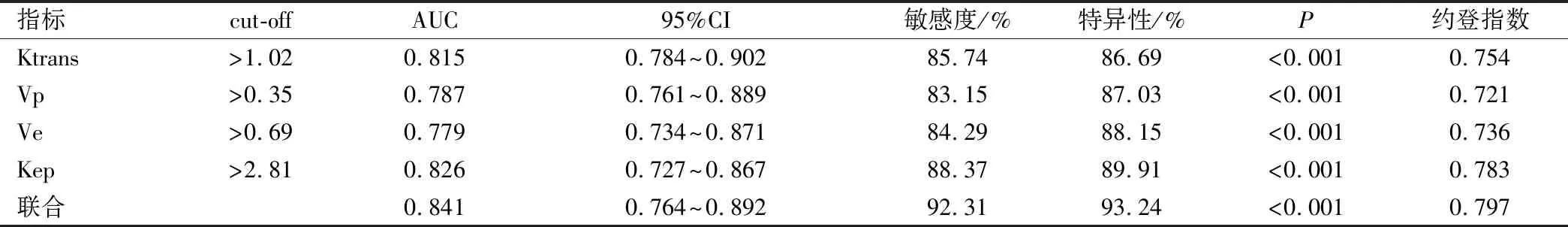
表4 DCM-MRI各定量参数及联合指导PLC病理分级的ROC分析
2.5 不同预后患者DCM-MRI定量参数值的比较
死亡组患者DCM-MRI各定量参数Ktrans、Vp、Ve和Kep均较存活组明显升高,差异均有统计学意义(P<0.01),见表5。

表5 不同预后患者DCM-MRI定量参数值的比较
2.6 DCM-MRI各定量参数指导PLC预后评估的ROC曲线分析
经过ROC曲线分析,DCM-MRI各定量参数Ktrans、Vp、Ve和Kep指导PLC预后均有较高效能,四者联合时效能最高,其AUC为0.893,约登指数为0.834,敏感度、特异性分别为86.67%、96.70%,见表6和图2。
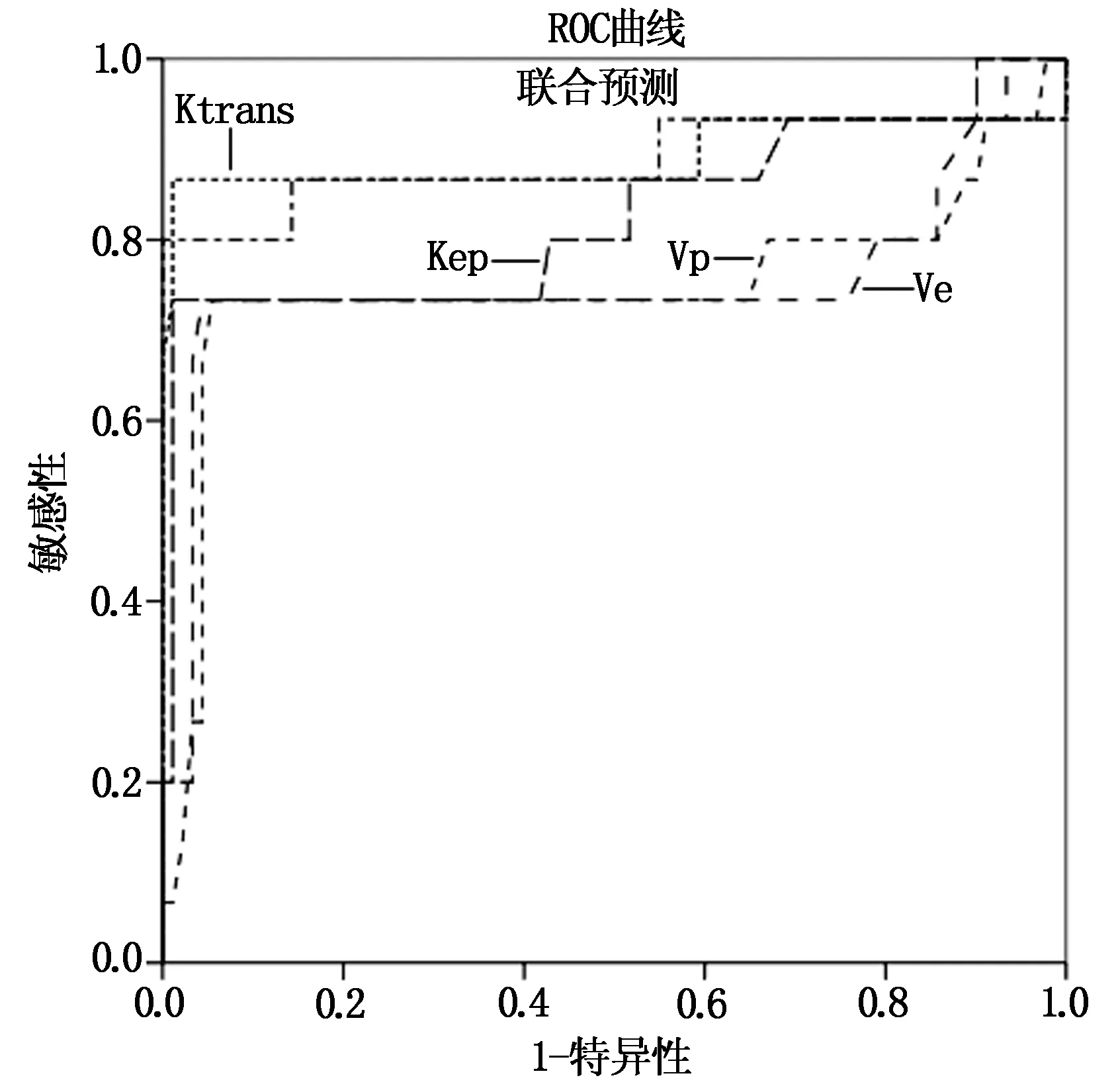
图2 DCM-MRI各定量参数指导PLC预后评估的ROC曲线
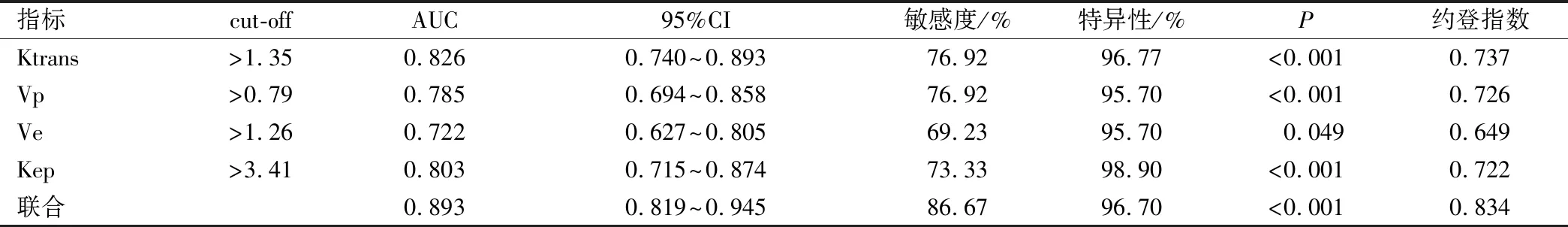
表6 DCM-MRI各定量参数及联合指导PLC预后评估的ROC分析
3 讨论
DCM-MRI是临床较常用的基于T1WI的新型MRI灌注成像技术,其原理主要是在患者血管内注入顺磁对比剂后进行不同时相的连续跟踪扫描,造影剂可以对毛细血管外的质子产生影响,通过肿瘤组织和正常组织间的磁化率差别以显示对比剂灌注和廓清的整个过程,可以明确组织内信号强度的变化,经专业软件对定量参数进行处理后进而测出病变组织的血流灌注情况[10-11]。近年,DCM-MRI参数与诸多肿瘤如宫颈癌、乳腺癌、结直肠癌、前列腺癌等的病理分级的相关性研究是近年学者们较为关注的一个方向,DCM-MRI成像技术在评价血管通透性以及肿瘤内微循环水平变化中的应用也更加成熟[12-13]。PLC的发生与肿瘤血管的形成密切相关,在原发性肝癌发病早期,肿瘤细胞的生长及繁殖所需要的养分主要来源于邻近组织,当肿瘤发展到血管期阶段后肿瘤细胞需要充足的血液供应以促进其自身快速生长,肿瘤新生血管的生长速度会随肿瘤组织的扩大而提高,为肿瘤的持续、快速发展提供条件。随着肿瘤新生血管的增多,肿瘤可表现出更高的的侵袭性,对组织浸润和机体损伤也增加,导致疾病进展,组织病理分级增高[14]。因此,对于PLC患者进行血流动力学进行评估有助于明确肿瘤进展。
本研究数据显示,PLC患者DCM-MRI定量参数Ktrans、Vp、Ve和Kep均较对照组高,且随着Edmondson-Steiner's肿瘤病理分级增加而升高,与肿瘤进展呈正相关,且DCM-MRI定量参数对于PLC轻度与中重度区分效能较高,说明DCM-MRI定量参数的升高能够反映PLC病情进展,对于判断PLC病理分级具有较好的指导效能。分析原因为肿瘤组织内新生血管状态能够在一定程度上反映微血管密度,发育尚未成熟的肿瘤新生血管的通透性较好。韩晨阳等[15]的相关研究中提出,随着PLC患者肿瘤组织的增大和分化加剧,动脉血液供应随之增加,肝窦可出现毛细血管样形态变化。潘晓奇等[16]的研究认为在PLC早期,若肿瘤新生血管尚未分化成熟,其通透性比较大,在行DCM-MRI检测时注入的对比剂分子量较小,容易通过肿瘤新生血管渗出至细胞外的间隙中。Ktrans变化能够反映血管表面的通透性和血液的流速,能够提示肿瘤组织微血管病变的程度,而肿瘤组织微血管的分化发育和肿瘤生长密切相关,Kep为对比剂血管外对比剂渗入进血管内的速度,Ve主要反映对比剂渗出至细血管外与细胞外间隙的容积比,若肿瘤组织周边血管通透性明显增加,Ktrans、Vp、Ve和Kep会明显增加,DCM-MRI定量参数能够较好的反映肿瘤新生血管的通透性及肿瘤周边组织血管的渗透情况,肿瘤新生血管的形成为PLC肿瘤的快速生长提供了条件,因此,随着疾病进展,DCM-MRI定量参数Ktrans、Vp、Ve和Kep会明显增加,参数变化对于指导PLC病理分级也有较好的效能。
本研究数据还显示,随访2年内PLC死亡组患者DCM-MRI各定量参数Ktrans、Vp、Ve和Kep均高于存活组,且上述参数联合指导PLC患者预后评估有较高的效能,说明DCM-MRI定量参数能够反映患者病情严重程度,指导预后评估。原发性肝癌患者死亡率较高[17],本研究中死亡患者13例,占比12.26%。随着PLC患者肿瘤血管的形成和增加,各定量参数明显升高,肿瘤组织快速分化发育和成长使得肝小叶结构出现严重损坏,肿瘤和纤维组织大量增生甚至是血液循坏途径出现改变,肝门静脉回流受阻,肝动脉间出现异常分流导致肝血流阻力增加,导致患者出现消化道出血等症状[18]。另外,PLC患者肝静脉、门静脉等分支在纤维条索的作用下出现狭窄甚至是闭塞,导致胶原纤维大量沉积于肝细胞间隙加重肝组织的损伤,使得流经肝脏的对比剂耗时延长,而且随着肝脏血流阻力的不断增加,流经门静脉的血流异常减少,肝循环中肝动脉血流的占比增加,导致肝脏总灌注量下降,死亡组患者Ktrans、Vp、Ve和Kep均升高说明DCM-MRI定量参数与PLC患者门静脉血流受阻和血栓形成相关,随着病情恶化,门静脉血流受阻严重形成血栓的风险增加,因此DCM-MRI定量参数能够反映PLC患者肝脏血流情况,判断肝门静脉血流情况从而为预后提供指导。
DCM-MRI定量灌注参数与原发性肝癌患者病理分级密切相关,可以依据DCM-MRI定量灌注参数对患者预后进行评估并指导临床治疗。

