高危型HPV感染人群TLR2、TLR4基因多态性与罹患宫颈癌风险的相关性
于 晓 肖 艳 杨 柳
高危型人乳头瘤病毒(HPV)的持续感染是引发宫颈癌的主要原因之一,近年来随着HPV疫苗的问世,宫颈癌发病率和死亡率有下降趋势,但其发生发展机制依然是医学界研究的热点问题。遗传是影响宫颈癌发生的因素之一,单核苷酸多态性是指基因水平上单个核苷酸变异引发的DNA序列多态性,进一步造成转录核苷酸变化,是一种常见的人类可遗传变异[1]。目前已有研究报道亚甲基四氢叶酸还原酶(MTHFR)[2]、抑癌基因p53[3]等基因多态性与妇女感染高危HPV后发生宫颈癌有关。Toll样受体(TLR)家族是一类能识别微生物保守分子成分的蛋白,能通过激活机体免疫系统从而清除病原菌。相关研究显示,TLR2/4基因多态性与HPV感染者的尖锐湿疣易感性有关,而与宫颈癌易感性尚不明确[4]。基于此,本次通过分析宫颈癌、宫颈上皮瘤变、无病变的HPV感染人群TLR2/4基因多态性,旨在为宫颈癌发病机制研究提供参考。
1 材料与方法
1.1 一般资料
选择2019年1月到2021年12月我院收治的83例高危型HPV感染宫颈癌患者作为宫颈癌组,纳入标准:①经病理活检确诊为宫颈癌,参考2014年NCCN提出的诊断标准[5];②HPV筛查阳性,存在高危型HPV感染者;③本地区常住人口;④病历资料完整。排除标准:①存在其他恶性肿瘤或存在放化疗及免疫治疗史;②存在严重肝肾功能不全、糖尿病、心血管疾病等。另选75例高危型HPV感染的同期体检女性作为对照组,2组患者一般资料比较无显著差异(P>0.05),见表1。
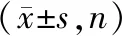
表1 2组一般资料比较
1.2 方法
采集所有受试者静脉血5 mL,经EDTA抗凝后于-4 ℃保存,并在7 d以内采用蛋白酶K消化饱和NaCl盐析法提取其中DNA。根据Pubmed官网查询的基因序列进行引物设计,引物序列及产物见表2。TLR2-196 to -174 del基因多态性检测:PCR扩增,95 ℃预处理5 min,变性95 ℃ 30 s,退火58 ℃ 40 s,延伸72 ℃ 30 s,共30 cycle,最后72 ℃ 10 min。获得的产物采用琼脂糖凝胶电泳,然后在紫外凝胶成像系统中观察。TLR2 15607(A/G)及TLR4 Asp299Gly、Thr399Ile的基因多态性检测:PCR扩增,95 ℃预处理5 min,变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 30 s,共30 cycle,最后72 ℃ 10 min。获得产物采用限制性内切酶进行切割,每个样本各取5 μL在琼脂糖凝胶电泳,结果在紫外凝胶成像系统中观察。选择有代表性的产物采用末端终止法进行测序,完成后与基因库中对应野生型序列进行对比,以验证PCR-RFLP结果。

表2 引物序列比较
1.3 统计方法

2 结果
2.1 2组TLR2-196 to -174 del基因多态性比较
宫颈癌组、对照组TLR2-196 to -174 del基因缺失率(ins/del+del/del)分别为57.83%、61.34%,组间比较无明显差异(P>0.05),表明TLR2-196 to -174 del多态性与宫颈癌发生无明显关系(P>0.05),见表3。
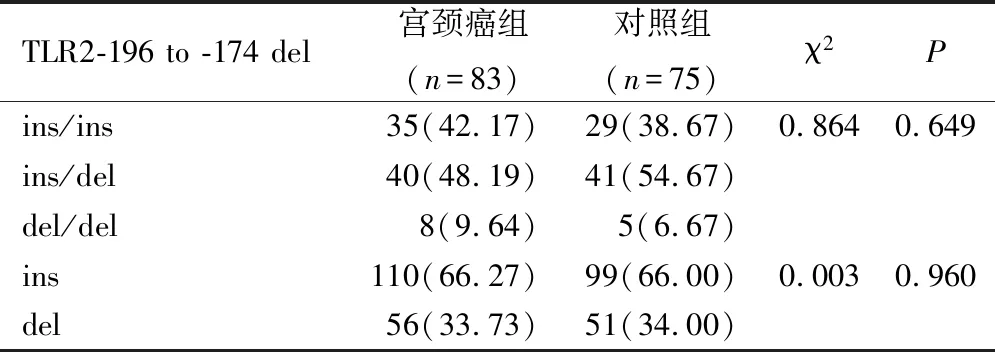
表3 各组TLR2、4基因多态性比较(例,%)
2.2 2组TLR2 15607(A/G)基因多态性比较
宫颈癌组和对照组TLR2 15607(A/G)基因型及等位基因频率无明显差异(P>0.05),见表4。
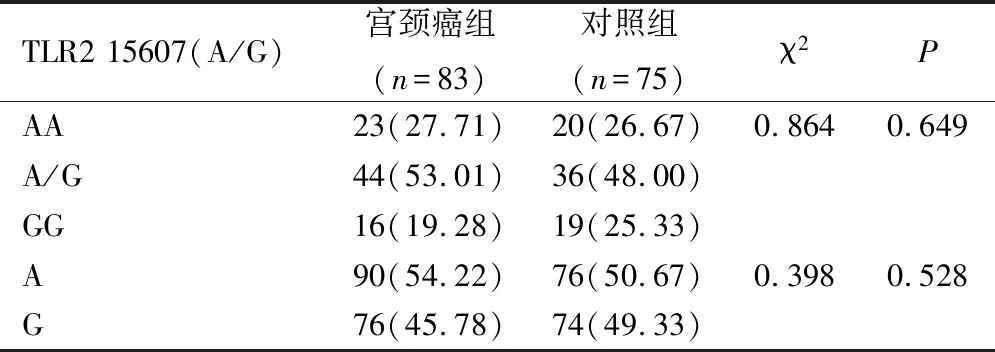
表4 2组TLR2 15607(A/G)基因多态性比较(例,%)
2.3 2组TLR4 Asp299Gly基因多态性比较
宫颈癌组和对照组TLR4 Asp299Gly基因型及等位基因频率无明显差异(P>0.05),见表5。
表5 2组TLR4 Asp299Gly基因多态性比较(例,%)
2.4 2组TLR4 Thr399Ile基因多态性比较
宫颈癌组和对照组TLR4 Thr399Ile基因型及等位基因频率无明显差异(P>0.05),见表6。
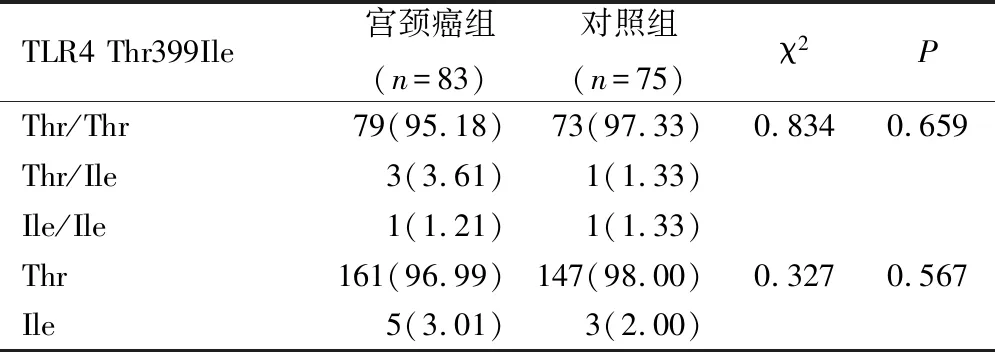
表6 2组TLR4 Thr399Ile位点多态性比较(例,%)
3 讨论
HPV是一种双链DNA病毒,能通过激活端粒酶植入癌蛋白从而使抑癌基因失活,并逐步引发宫颈上皮病变和宫颈癌的发生[6]。目前已经发现有30多种HPV的持续感染可导致宫颈癌的发生,常见有高危型HPV16/18[7-8]。HPV感染后可刺激机体免疫系统产生免疫应答,起到清除病原体作用,而此过程依赖于模式识别受体起作用。TLR2是模式识别受体TLR家族的重要成员,具有广泛配体特异性,可协助TLR4参与机体对内毒素脂多糖(LPS)的免疫反应[9]。有研究发现,TLR2、4基因突变可引发其配体信号传导过程,进而影响机体免疫功能和HPV感染进程,最终导致宫颈癌的发生[10]。临床观察也可发现,仅有小部分HPV感染者最终会发展为宫颈癌,推测TLR2、4基因突变可能在其中起了重要作用。
目前关于TLR2、4基因多态性与HPV易感性研究较多,如有学者认为,TLR2、4基因突变可引发机体免疫系统对HPV清除能力不足,引发HPV的持续感染及对宫颈癌上皮的损伤,最终导致宫颈癌的发生[11]。还有学者研究认为,TLR2、4、9基因多态性与HPV感染及宫颈癌易感性无明显关系[12],但目前相关研究结论并未达成一致。本次研究显示2组人群TLR2-196 to -174 del基因频率分布无明显差异,提示其与宫颈癌发生无关。TLR2-196 to -174 del突变会导致其出现22 bp位点缺失,有研究认为其可能会影响TLR2启动子区功能,进而影响蛋白的转录和翻译[13]。但本次研究中宫颈癌患者与对照组人群此位点基因缺失率较高(57.83%和61.34%),但组间比较均无明显差异,与Hu等[14]调查结果类似。此外,有研究发现TLR2 15607(A/G)多态性与HPV感染及生殖器疱疹皮损数目有关[15],本次研究显示其与宫颈癌发生无明显相关,推测TLR2 15607(A/G)基因突变在不同性别人群或不同疾病进程中作用存在差异。TLR4是免疫系统识别LPS后激活免疫应答的必经途径,其基因突变可引发TLR4受体功能不足,针对LPS反应的Th1型细胞因子分泌减少,从而影响机体免疫功能及炎症反应。目前主要针对TLR4的Asp299Gly、Thr399Ile位点进行研究,但相关结论差距较大。有学者检测了挪威地区宫颈癌及正常人群TLR4的两位点基因频率,但并未发现单核苷酸多态性[16]。还有学者研究了日本地区健康人群,发现两位点突变率分别19.5%和22.0%[17]。本次研究显示,TLR4 Asp299Gly、Thr399Ile位点基因多态性与宫颈癌发生无明显相关性,与Makni等[18]研究一致。有研究发现TLR4 Asp299Gly、Thr399Ile位点的基因多态性与印度北部妇女发生宫颈癌相关,但在亚洲其他地区妇女中并不相关,推测TLR4基因多态性可能有地域及种族差异,这也可能是各研究结果不一致的原因[19]。还有研究发现TLR2 597、1350位点及TLR4 896、1196位点的基因频率变化与HPV感染及尖锐湿疣(CA)治疗后复发有关[20],推测TLR2、4基因多态性与HPV易感性关系可能在不同位点中存在差异。
综上所述,高危型HPV感染人群TLR2-196 to-174del、15607(A/G)及TLR4 Asp299Gly、Thr399Ile基因多态性与罹患宫颈癌无明显相关性。但不同基因多态性位点差异导致生物学功能改变的相关机制尚不明确,具体情况有待更多研究进一步证实。

