基质金属蛋白酶-9、CD44在食管鳞癌组织中的表达及其临床意义
徐梦娇 廖应英 马娟 孙泽群
食管癌作为一种侵袭性极强的恶性肿瘤,在全世界的发病率正迅速上升,其发病率在消化系统肿瘤中居于第3位,致死率居于第6位,通常确诊即为中晚期且预后不良[1-3],故探究食管癌的分子机制具有重要临床意义。食管癌的演变是一个多基因参与的过程,其中基质金属蛋白酶(MMP)-9可通过降解细胞外基质(ECM)参与肿瘤侵袭和转移,其过表达和失调也与多种疾病相关[4-5];CD44属Ⅰ型跨膜糖蛋白的多功能跨膜分子,不仅在透明质酸(HA)的重塑和降解中起主要作用,也能作为HA表面受体,与其结合并激活后会增强细胞信号通路,介导上皮-间充质转化(EMT)[6],EMT现已成为参与恶性肿瘤侵袭、细胞迁移和转移的关键调控因子[7]。在一些实体瘤中CD44也被广泛认为是恶性肿瘤预后不良的标志[8],同时也作为恶性肿瘤治疗的分子靶点。本文通过研究MMP-9、CD44在食管鳞癌组织中的表达及其临床意义,旨在探究食管鳞癌侵袭与转移的重要机制,寻找用于判断预后的有效检测指标,以期为食管癌的早期诊断和个体化治疗提供参考依据。
对象与方法
1.对象:选取2013年1月~2017年12月于我院行食管癌根治性切除术(简称根治术)的完整癌组织(癌组织组)及对应癌旁组织(癌旁组织组)各60例。组织来源患者纳入标准:(1)食管鳞癌的诊断符合第八版美国癌症联合会(AJCC)分期标准[9];(2)具备完整的临床病理资料;(3)均行单纯根治术,术后组织病理检查明确诊断为鳞癌。组织来源患者排除标准:(1)术前或术后接受过放疗、化疗等其他抗肿瘤治疗;(2)肿瘤发生远处转移。本研究已通过本院伦理委员会审核批准(2022-001)。
2.方法:收集组织来源患者的临床资料,包括性别、年龄、肿瘤直径、分化程度、肿瘤TNM分期(Ⅰ期~Ⅳ期)、淋巴转移及预后情况。采用免疫组化(SP法)同时对食管鳞癌组织及对应癌旁组织切片进行染色,显微镜下可观察到细胞膜和细胞质显色,极少见于细胞核,当镜下呈现棕黄色或褐色视为MMP-9、CD44阳性。选择两位经验丰富的病理医师采用双盲法在显微镜下阅片判别,每张切片于镜下(×400)随机观察10个视野后采用半定量法赋分。定性:取阳性细胞百分比与着色强度值进行综合阳性评分。阳性细胞百分比:阴性为0分,≤25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;着色强度值:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。综合阳性评分(分)=着色强度值分值(分)×阳性细胞百分比分值(分)。判定标准:0~2分为不表达,3~4分为低表达,≥5分为高表达。根据食管鳞癌组织中MMP-9的综合阳性评分结果,将其分为高表达组(A组,36例)和低表达/不表达组(B组,24例);根据食管鳞癌组织中CD44的综合阳性评分结果,再将其分为高表达组(C组,33例)和低表达/不表达组(D组,27例)。
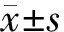
结 果
1.癌组织组及癌旁组织组MMP-9、CD44免疫组化染色结果及其表达阳性率比较:MMP-9、CD44在癌组织组中均呈阳性表达(高表达或低表达),在癌旁组织组中均呈阴性表达(未表达),见图1。癌组织组MMP-9及CD44的阳性率分别为68.33%(41/60)、61.67%(37/60),癌旁组织组MMP-9及CD44的阳性率分别为11.67%(7/60)、15.0%(9/60);癌组织组MMP-9及CD44的阳性率均明显高于癌旁组织组(P<0.05)。
2.食管鳞癌组织不同MMP-9及CD44表达情况组别患者的临床资料比较:A组肿瘤低分化、肿瘤TNM分期 Ⅲ~Ⅳ期及淋巴转移患者比例均高于B组(P<0.05);两组患者其余指标比较差异均无统计学意义(P>0.05)。见表1。C组肿瘤TNM分期Ⅲ~Ⅳ期及淋巴转移患者比例均高于D组(P<0.05);两组患者其余指标比较差异均无统计学意义(P>0.05)。见表2。
3.不同组别食管鳞癌患者预后情况比较:所有患者均随访36个月,随访截至2020年12月。随访结束,60例患者中失访29例。MMP-9阴性患者3年生存率高于MMP-9阳性患者[73.86%(14/19)比41.46%(17/41),P<0.05],CD44阴性患者3年生存率高于CD44阳性患者[73.91%(17/23)比37.84%(14/37),P<0.05]。Log-rank检验分析结果显示,CD44、MMP-9低表达或不表达的食管鳞癌患者3年生存率均高于CD44、MMP-9高表达患者(P<0.05)。
图1 癌组织组及癌旁组织组MMP-9及CD44的表达情况(A、B、D、E:癌组织,C、F:癌旁组织;A、B、C:MMP-9高、低及未表达,D、E、F:CD44高、低及未表达;SP法,×400)
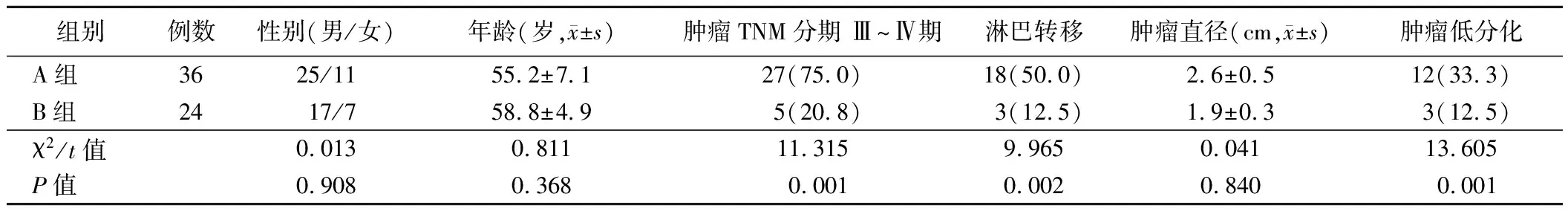
表1 食管鳞癌组织中不同MMP-9表达情况组别患者临床资料比较[例,(%)]
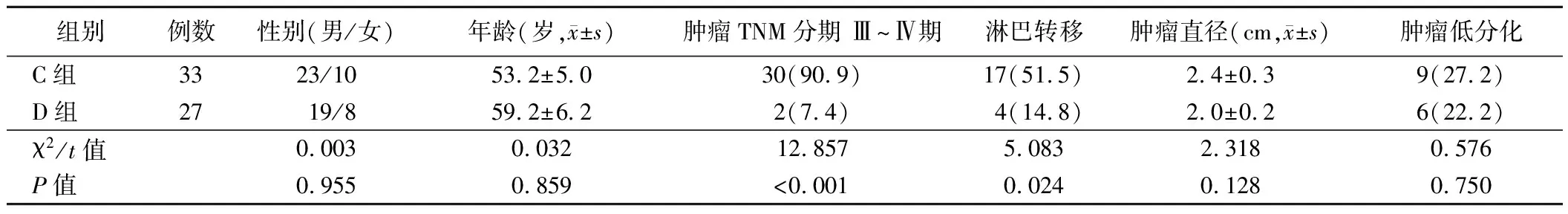
表2 食管鳞癌组织中不同CD44表达情况组别患者临床资料比较[例,(%)]
4.MMP-9与CD44表达的相关性分析:Spearman相关分析结果显示,食管鳞癌组织中MMP-9与CD44表达水平呈正相关(r=0.613,P=0.003)。
讨 论
作为MMP家族(MMPs)中最复杂的形式之一,MMP-9能直接降解ECM,在伤口愈合、骨吸收和血管生成过程中很重要。其主要机制是分解ECM中的弹性纤维和明胶,ECM受损利于肿瘤进一步转移,ECM降解过程与肿瘤的浸润和转移密切相关,肿瘤转移过程中原癌基因激活会导致转录MMP-9蛋白的产生,MMP-9有助于癌细胞的侵袭[10]。肿瘤转移各阶段均与MMPs活性相关[11],过表达MMPs可加快肿瘤的转移[12-13],导致预后差。Zeng等[5]的Meta分析结果发现,MMP-9蛋白在乳腺癌、胃癌、结直肠癌、非小细胞肺癌中均异常表达。既往Xia等[14]的研究显示MMP-9能侵犯血管内皮细胞,从而使肿瘤向血管内浸润,还能够活化与肿瘤转移相关的信号通路。MMP-9抑制剂可作为抗肿瘤药物[11]。Gu等[15]的研究报道了MMP-9表达与食管鳞癌相关性,MMP-9在食管鳞癌中作为疾病结局和复发的独立预测因子,与肿瘤细胞分化、淋巴转移有关,与本研究结果一致。
CD44在非小细胞肺癌、肾癌中过表达,与预后差相关[16-17]。CD44对配体的特异性与细胞的迁移和生长有关,HA作为CD44常见的配体,HA与CD44的相互作用受到E-cadherin负向调节,CD44的上调与食管癌中E-cadherin的缺失相关,机制为CD44与HA结合促进肿瘤细胞的生长和转移,还能促进肿瘤血管的增殖[18-19]。CD44有望成为预测食管癌预后的工具[20]。
CD44促进MMP-9介导的肿瘤侵袭,和MMP-9蛋白水解形式的相互作用还参与了前列腺癌骨转移的侵袭,CD44相关的细胞表面MMP-9促进细胞介导的Ⅳ胶原降解。总之,MMP-9在细胞表面的定位是靠CD44提供的细胞表面受体,这有助于介导肿瘤的侵袭[4]。在结肠癌的SW480细胞株里,转染MMP-9后肿瘤侵袭和转移能力提升,介导结肠癌中EMT[21],还可通过激活 Wnt信号通路提高肿瘤干细胞标志物表达,使癌细胞更易获得干细胞特性。研究发现CD44激活可直接提高结肠癌细胞中MMP-9水平,导致细胞侵袭性增加[22]。本研究中CD44、MMP-9之间存在协同关系,在探究食管癌的机制方面提出了更多的可能,试验结果也支持其作为生物标志物的进一步研究。本研究Speaman相关分析结果显示,CD44、MMP-9在食管鳞癌组织中过表达且二者呈正相关,故可作为重要的生物标记物用于食管鳞癌的诊断和预后的预测。然而本研究仅限于CD44、MMP-9协同关系方面机制的研究和分析,食管癌的信号调节机制是一个非常复杂的过程,由此推测CD44可能通过某些信号通路或基因调控MMP-9的表达。

