尕海湿地草甸土退化过程土壤氮矿化演变特征
陈 好,马维伟,龙永春,常文华,杨永凯
甘肃农业大学林学院,兰州 730070
土壤氮素的有效性能够调节植物生长和影响植物物种竞争而成为限制植物生长关键因素[1]。湿地土壤氮素以有机氮和无机氮两种形态存在,其中有机氮占土壤全氮的95%以上,而可供植物吸收的无机氮仅占2%左右[2],这些有机态氮只有通过氨化、硝化等矿化作用转化为有效氮,才能被植物吸收利用[3—4]。故土壤有机氮的矿化作用是控制湿地生态系统生产力的关键过程,其净氮矿化速率是衡量土壤氮素有效性的重要指标。随着全球气候变暖和人类活动加剧,全球湿地正遭受不同程度的退化,改变了湿地土壤氮矿化作用,最终影响氮素的有效性。因此,研究湿地退化过程中土壤氮矿化演变特征,对于精准估算湿地土壤氮的有效性,确定湿地生态系统生产力变化具有重要意义。
土壤氮矿化具有明显的时空异质性[5],受到多个因素的影响,如温度[6]、湿度[7]、土地利用变化和植被类型[8]等。已有不少学者针对原始湿地研究了植物[9]、水热变化[10]、土壤性状对其土壤矿化作用、氮矿化速率[6]等的影响。然而,湿地退化后,土壤理化性质、土壤温湿度和植被均发生改变,引起土壤中有效氮库和氮转化速率发挥的作用和强度不同。研究表明,湿地退化过程中,随着水分梯度的不断减少,植物演替模式变化趋势表现为水生—湿生—中生—旱生[11]。未退化湿地植物相对丰富,为微生物活动提供丰富的有机物质,有利于土壤净氮矿化的发生[12]。而演替过程中地上总生物量和植被总盖度都有所下降[13]。到中度退化阶段部分湿地物种因环境而消失,中生和旱生植物增多。且随着退化程度的加剧,至重度退化时,生境旱化已十分明显,大部分中生、旱生植物因不适应生境而退出群落[11],致使地表土壤裸露程度增大,蓄水保水能力降低,土壤水分含量减少,加速了养分的流失,从而影响了土壤有效氮含量和氮矿化速率[14]。同时,不同的植物生长阶段,植物对养分的吸收过程存在一定差异。研究表明,植物在生长盛期对养分需求最多,土壤氮转化过程最为活跃,氮矿化速率也应提高来满足植物的需求[15],且植物在休眠期土壤氮素转化以净氨化作用为主[16]。而且植物生长的不同阶段,温度、降水量等气候条件存在差异,影响了土壤有效氮含量和氮矿化速率。研究表明,土壤净氮矿化和净硝化速率随温度增加呈指数递增[17—18],随土壤水分增加出现先增加后减少的趋势[19]。因此,推测高寒湿地退化过程中土壤有效氮库和氮矿化速率可能存在明显的时空特征,但目前对这一时空特征,特别随植物生长的时空变化特征仍不清楚,需要进一步验证。
尕海湿地是我国独特的青藏高原高寒湿地的重要组成部分,位于全球气候变化最为敏感的青藏高原东北缘,其生态系统氮转化过程对区域氮库的稳定和氮循环过程具有重要意义[20]。然而,近年来尕海湿地降水量每年递减二到三成,蒸发量大于降水量,致使湖水面积不断缩小,同时受排水疏干和过度放牧等影响,湿地退化严重,引起湿地植物种类旱生化,植被生物量、生物多样性和丰富度下降,使得碳氮组分、理化性质等发生变化,对区域氮矿化过程产生了巨大影响。虽然近年来关于高寒湿地退化过程中土壤氮矿化特征已有一定的研究,但仅限于室内培养条件[21—22]。室内培养与自然生态系统的氮矿化相比有一定局限性。而树脂芯方法通过野外原位培养,能较好地反映土壤氮的实际氮矿化速率[23]。基于以往研究存在不足和研究方法局限性,本研究以尕海不同退化程度的湿地土壤为研究对象,通过植物生长季不同生长阶段的野外树脂芯原位培养观测,研究尕海湿地退化过程中土壤净硝化、氨化及氮矿化速率的时空变异特征,并结合环境,分析其与土壤氮矿化的关系,为尕海高寒湿地生态演替机理及其氮循环过程的深入研究提供基础数据和理论意义。
1 材料与方法
1.1 研究区概况
尕海湿地位于青藏高原东北边缘甘肃省碌曲县境内(33°58′12″—34°32′16″ N,102°05′00″—102°47′39″ E),是尕海-则岔国家级自然保护区的重要组成部分,平均海拔3430—4300 m,面积57846 hm2[24]。土壤为高山草甸土、灰褐土、暗黑色草甸土、泥炭土和沼泽土。该区属于青藏高原气候带高寒湿润气候,年平均降水量为781.8 mm,年蒸发量为1150.5 mm,长冬无夏,年平均冬季240 d。主要植物种类有蕨麻(PotentillaanserinaL.)、青藏苔草(CarexmoorcroftiiFalc.ex Boott)、草玉梅(AnemonerivularisBuch.-Ham)、唐松草(Thalictrumaquilegiifoliumvar.sibiricumLinnaeus)、线叶蒿(ArtemisiasubulataNakai)、珠芽蓼(PolygonumviviparumL.)、散穗早熟禾(PoasubfastigiataTrin.)等。
1.2 样地设置
选择尕海沼泽草甸的典型退化区域为研究对象,采用空间序列代替时间序列方法,以现在生长季可见的原生湿地为中心向外延伸的办法,选择地势相对平缓坡向一致的地段,将沼泽化草甸划分为未退化(ND)、轻度退化(LD)、中度退化(MD)及重度退化(HD)4种退化梯度,每个退化梯度的研究样地布设为10 m×10 m,重复3次。同一退化样地间至少保留5 m间隔,共12块样地。样地示意图见图1。样地详细情况见表1。土壤理化性质见表2。湿地土壤粒径组成见表3。

表1 不同退化程度的湿地样地基本情况[24]Table 1 Basic information of different degraded wetland plots

表2 不同退化程度的湿地土壤的基本理化性质Table 2 Basic soil physical and chemical properties of different degraded wetland plots

表3 不同退化程度的湿地土壤粒径组成[25]Table 3 Soil particle size distribution of different degraded wetland plots

图1 样地示意图 Fig.1 Schematic diagram of plot
1.3 研究方法
2020年,根据湿地植物生长和降雨情况,分别于6—7月份(生长初期),7—8月份(生长盛期),8—9月份(生长盛期),9—10月份(植物枯萎)对上述4个退化梯度分别进行30天野外树脂芯原位矿化培养,测定土壤净氮矿化量和土壤净氮矿化速率,探讨不同湿地退化程度和植物生长阶段对土壤氮矿化的影响。具体培养如下,每个研究样地内沿对角线随机选取3个点,去除地表凋落物,在每个点随机打入6个PVC管 (长25 cm、直径7 cm,埋入土壤深20 cm),将3支取出,用装有冰袋的保温箱将土样带回实验室,用来测定硝铵态氮的初始值。将另3支PVC管取出,用小刀去除底部约2 cm厚的土样,然后在PVC管底部先放入1张滤纸,再放入装有3 g阴离子的交换树脂袋,继续在下面放一张滤纸,再用泡沫板封住底端,最后插入土壤原位中,然后封住PVC管的顶端,进行野外树脂芯原位培养。培养结束后从每个样地取出3个培养管,在新的培养期按上述培养过程再进行重新培养。四个培养期总共打入24个PVC管。将重复的同一退化梯度,同一土层土壤混合,取部分样品带回实验室,磨碎过2 mm筛,进行土壤硝铵态氮含量的测定,测定重复3次。
1.4 计算方法
Amin=Anit+Aamm
Δt=t2-t1
Rnit=Anit/Δt
Ramm=Aamm/Δt
Rmin=Amin/Δt

1.5 数据处理与分析
本文先用Excel 2016软件对数据进行的初步的整理,然后用SPSS 20.0统计分析软件对数据进行处理,采用单因素方差分析(One-way ANOVA)和邓肯(Duncan)法分析不同退化梯度各变量间的显著差异性(P<0.05)。用重复测量双因素方差分析(Two-way ANOVA)分析不同退化梯度和培养时间以及二者的交互作用对湿地土壤氮矿化速率的差异。采用Canoco 5.0对氮矿化速率和土壤环境因子以及土壤酶活性进行冗余分析(redundancy analysis,RDA)。
2 结果与分析
2.1 尕海湿地退化过程中土壤环境因子及酶活性变化
2.1.1土壤含水量和温度
不同退化梯度湿地土壤含水量和温度如图2所示。可以看出,随退化程度的加剧,湿地土壤平均含水量逐渐减小。随时间推移,未退化梯度土壤含水量呈逐渐减小趋势,而中度呈逐渐增加趋势,轻度退化和重度退化变幅不大。0—10 cm土层土壤含水量(33.1%)明显高于10—20 cm土层(28.4%)。土壤温度在不同退化梯度也存在显著差异(P<0.05)。随着退化程度的加剧,湿地土壤平均温度逐渐增大;土壤温度在0—10 cm和10—20 cm土层随着时间变化呈现单峰曲线,在7、8月份值较高,均值分别为11.9℃、11.5℃。

图2 不同退化梯度湿地土壤的含水量和温度 Fig.2 Soil moisture content and temperature in wetlands with different degradation gradients
2.1.2土壤酶活性
由6、7、8、9月份土壤酶活性均值处理结果(图3)可知,湿地土壤酶活性在不同退化梯度之间存在显著差异(P<0.05)。亚硝酸还原酶和蛋白酶活性随着退化程度加剧而逐渐减小。其中轻度退化、中度退化和重度退化在0—10 cm土层亚硝酸还原酶活性较未退化分别显著减小了7.93%、15.91%、33.98%(P<0.05);而在10—20 cm土层分别减小了2.14%、9.29%、18.11%,且仅中度、重度退化显著低于未退化。未退化梯度湿地土壤蛋白酶活性显著高于其他退化梯度,在0—10 cm土层,轻度退化、中度退化和重度退化较未退化梯度显著降低了12.9%、16.7%、23.7%;在10—20 cm土层,未退化显著高于重度和中度退化,而与轻度退化差异不显著。而对于土壤硝酸还原酶活性,重度退化阶段均显著高于其他退化阶段,随着退化程度加剧,0—10 cm土层重度退化阶段湿地土壤硝酸还原酶活性较未退化、轻度退化和中度退化分别增加了12.5%、132.4%、359.7%;10—20 cm土层分别增加了12.7%、37.4%、144.6%。湿地土壤脲酶活性也随着退化程度加剧逐渐增大,0—10 cm土层脲酶活性在轻度退化、中度退化和重度退化较未退化阶段分别增加了6.99%、9.46%、11.03%;10—20 cm分别增加了7.55%、15.67%、23.48%,且其变化幅度也较小。

图3 不同退化梯度湿地的土壤酶活性Fig.3 Soil enzyme activities in wetlands with different degradation gradients不同大写字母表示同一土层不同退化梯度间显著差异(P<0.05)
2.2 尕海湿地退化过程中土壤氮矿化的时空变化特征
重复测量双因素方差分析显示(表4),在不同时间,湿地土壤净氨化、净硝化和净氮矿化速率存在极显著差异(P<0.01),而在不同退化梯度湿地土壤净氨化速率也存在极显著或显著差异(P<0.05)。由F值可以看出时间对湿地土壤净氨化、净硝化和净氮矿化速率的影响程度大于退化梯度。退化程度和时间对净氨化、净硝化和净氮矿化速率存在显著的交互效应(P<0.05)。

表4 湿地退化程度和时间的交互作用方差分析Table 4 Two-way ANOVA of interaction between wetland degradation degrees and time
2.2.1尕海湿地退化过程中净氨化速率时空变化特征
由图4可知,随退化程度的加剧湿地土壤净氨化速率逐渐减小,且不同退化梯度之间差异性显著(P<0.05)。具体来看:在0—10 cm土层,不同时间土壤净氨化速率均值大小分别为:未退化(0.100 mg kg-1d-1)>轻度退化(0.067 mg kg-1d-1)>中度退化(0.049 mg kg-1d-1)>重度退化(0.033 mg kg-1d-1),且8月份未退化梯度土壤净氨化速率值显著高于其他退化梯度;在10—20 cm土层,均值大小顺序为未退化(0.092 mg kg-1d-1)>轻度退化(0.089 mg kg-1d-1)>中度退化(0.043 mg kg-1d-1)>重度退化(0.041 mg kg-1d-1),7月份重度退化梯度显著低于其他退化梯度,8月份未退化和轻度退化梯度土壤净氨化速率显著高于中度退化和重度退化梯度。

图4 不同退化梯度湿地土壤净氨化速率Fig.4 Net ammonification rate in wetland soils with different degradation gradients不同大写字母表示同一时间不同退化梯度的显著差异(P<0.05);不同小写字母表示同一退化梯度不同时间的显著差异(P<0.05)
各退化梯度湿地土壤净氨化速率在不同时间段也存在显著差异(P<0.05),各退化阶段土壤净氨化速率整体表现为随时间的推移逐渐减小,但在不同土层表现不尽一致。在0—10 cm土层,除未退化阶段先增后减外,其他退化阶段均随时间推移呈逐渐减小的趋势,且在8月份未退化梯度湿地土壤净氨化速率显著高于其他月份,值为0.201 mg kg-1d-1;在10—20 cm土层,未退化阶段净氨化速率逐渐减小,其他3个退化阶段净氨化速率均呈先减后增的趋势,且在7月份各退化阶段土壤净氨化速率均值显著高于其他月份,为0.068—0.161 mg kg-1d-1,10月份值较小,为0.011—0.046 mg kg-1d-1。可见,湿地退化显著降低了土壤净氨化速率,同时各退化阶段净氨化速率在7、8月份出现最大值。
2.2.2尕海湿地退化过程中净硝化速率时空变化特征
由表4和图5可见,随着退化程度的加剧湿地土壤净硝化速率逐渐增大。具体来看:在0—10 cm土层,重度退化(0.094 mg kg-1d-1)>中度退化(0.079 mg kg-1d-1)>轻度退化和未退化(0.061 mg kg-1d-1),7、8月份重度退化梯度湿地土壤净硝化速率显著高于其他退化梯度(P<0.05);在10—20 cm土层,重度退化(0.078 mg kg-1d-1)>中度退化(0.067 mg kg-1d-1)>未退化(0.035 mg kg-1d-1)>轻度退化(0.034 mg kg-1d-1),7月份湿地土壤净硝化速率显著高于其他退化阶段。统计分析显示,在不同生长阶段,仅在10—20 cm土层湿地土壤净硝化速率在不同退化梯度之间存在显著差异(P<0.05),而在0—10 cm土层差异不显著。

图5 不同退化梯度湿地土壤净硝化速率Fig.5 Net nitrification rate in wetland soils with different degradation gradients
在不同退化梯度下,随着时间的推移显著降低了土壤净硝化速率(P<0.05)。在0—10 cm土层,未退化和重度退化阶段随着时间的推移净硝化速率逐渐减小、未退化和中度退化阶段先减小后增大,且在7月份各退化阶段土壤净硝化速率显著较大,其值为0.109—0.213 mg kg-1d-1;在10—20 cm土层,轻度退化和重度退化阶段湿地土壤先减小后增大再减小,中度退化湿地土壤先增大后减小,而未退化阶段逐渐减小,且在7月份各退化阶段土壤净硝化速率值较大,为0.061—0.237 mg kg-1d-1,10月份值较小,为0.002—0.069 mg kg-1d-1。可见,湿地退化显著提高了土壤净硝化速率,同时各退化阶段净硝化速率在7月份出现最大值。
2.2.3尕海湿地退化过程中净氮矿化速率时空变化特征
由表4和图6可以看出,湿地土壤净氮矿化速率随着退化程度的加剧不变或者逐渐减小,具体来看:在0—10 cm土层,不同时间土壤净氮矿化速率均值大小分别为:未退化(0.159 mg kg-1d-1)>轻度退化(0.127 mg kg-1d-1)>重度退化(0.126 mg kg-1d-1)>中度退化(0.125 mg kg-1d-1),8月份未退化阶段土壤净氮矿化速率显著高于其他退化阶段,其值为(0.286 mg kg-1d-1);在10—20 cm土层,均值大小顺序为,未退化(0.126 mg kg-1d-1)>轻度退化(0.123 mg kg-1d-1)>重度退化(0.119 mg kg-1d-1)>中度退化(0.110 mg kg-1d-1),8月份各退化阶段差异显著。在不同生长阶段,仅在10—20 cm土层湿地土壤净氮矿化速率在不同退化梯度之间存在显著差异(P<0.05),而在0—10 cm土层差异不显著。
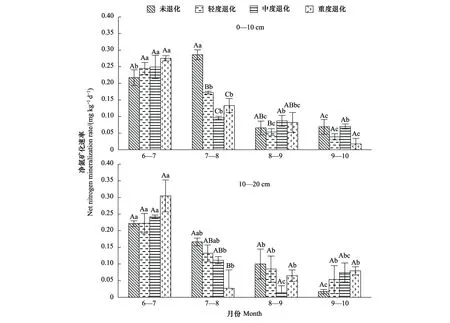
图6 不同退化梯度湿地土壤净氮矿化速率Fig.6 Soil net nitrogen mineralization rate in wetlands with different degradation gradients
在0—10 cm土层,随着时间的推移除了未退化阶段湿地土壤净氮矿化速率先增大后减小,其他退化阶段均逐渐减小,且7月份除了未退化阶段其他各退化阶段土壤净氮矿化速率显著高于其他月份;在10—20 cm土层,随着时间的推移未退化和轻度退化阶段湿地土壤净氮矿化速率逐渐减小,且7月份各退化阶段土壤净氮矿化速率显著高于其他月份;中度退化和重度退化先减小后增大。0—20 cm土层,在7月份土壤净氮矿化速率较大,10月份较小。7月份土壤净矿化速率的变化范围为0.217—0.305 mg kg-1d-1,10月份为0.017—0.079 mg kg-1d-1。在不同退化梯度下,湿地土壤净氮矿化速率在不同时间段存在显著差异(P<0.05)。可见,湿地退化显著降低了土壤净氮矿化速率,同时各退化阶段净氮矿化速率在7、8月份出现最大值。
2.3 土壤环境因子和酶活性对土壤氮矿化速率的影响
对湿地土壤氮矿化速率与土壤环境因子以及酶活性的关系进行RDA二维排序(图7),前两个排序轴的特征值为0.5663和0.1816,占总特征值的74.8%。前两轴与土壤因子的相关系数分别为0.9417和0.7087,累积解释量达到99.98%,表明排序效果良好。图7中,SWC、PRO、URE的箭头投影连线较长,表明不同退化梯度湿地土壤氮矿化作用受其影响较大。净硝化速率与NR、URE、TEM呈显著正相关,与PRO、NIR、SWC呈显著负相关;净氨化速率以及净氮矿化速率与土壤因子相关性基本保持一致,与NIR、SWC和PRO呈显著正相关,与NR、URE、TEM显著负相关;其中TEM与NR、URE呈显著正相关,与其他因子呈显著负相关,SWC与NIR、PRO呈显著正相关,与NR、URE、TEM均呈显著负相关。

图7 土壤环境因子和土壤酶活性与净氮矿化速率冗余分析Fig.7 Redundancy analysis of soil environmental factors,soil enzyme activity and net nitrogen mineralization rateURE:脲酶 Urease;PRO:蛋白酶 Protease;NR:硝酸还原酶 Nitrate enzyme;NIR:亚硝酸还原酶 Nitrite enzyme;SWC:土壤含水量 Soil moisture content;TEM:温度 Temperature
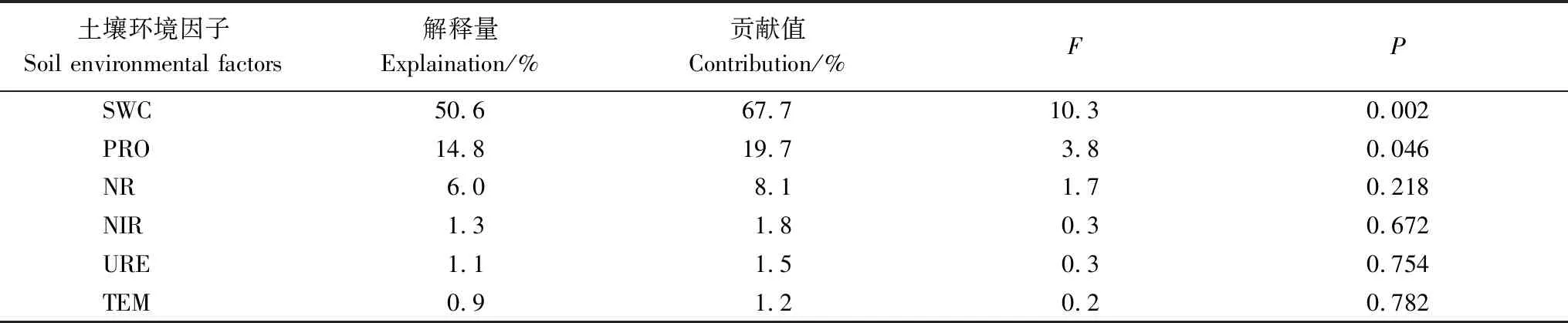
土壤环境因子Soil environmental factors解释量Explaination/%贡献值Contribution/%FPSWC50.667.710.30.002PRO14.819.73.80.046NR6.08.11.70.218NIR1.31.80.30.672URE1.11.50.30.754TEM0.91.20.20.782
由土壤环境因子和土壤酶活性显著性检验结果可知(表5),各土壤因子对湿地土壤净氨化、硝化和氮矿化速率的影响从大到小依次为SWC、PRO、NR、NIR、URE、TEM。其中SWC和PRO对湿地土壤净氨化、硝化和氮矿化速率存在显著影响(P<0.05),其他因子影响不显著,而SWC湿地土壤氨化、硝化和氮矿化速率贡献率高达67.7%。可见,土壤含水量是影响尕海湿地退化过程中土壤氮矿化的最主要的驱动因素。
3 讨论
3.1 湿地退化过程中土壤氮矿化的变化特征
氮矿化过程是土壤有效氮库的重要来源,净氮矿化速率是衡量氮素有效性的重要指标[30],对调节土壤的氮循环具有重要意义[31]。本研究结果表明,净氨化速率随着退化程度的加剧显著减小。可能原因是随着退化程度的加剧,植物种类和植被盖度减小,使得凋落物数量减少,可供微生物利用的氮源减少,微生物需要吸收更多的无机氮来满足自身生长需求,从而促进氮同化导致氨化细菌减小,铵态氮含量降低,氨化速率减小[32]。本研究结果表明亚硝酸还原酶与蛋白酶活性、土壤含水量与净氨化速率呈显著正相关关系。所以土壤亚硝酸还原酶活性、蛋白酶活性以及土壤含水量降低也是影响土壤净氨化速率减小的原因。土壤亚硝酸还原酶参与土壤氮素转化过程,在土壤硝酸还原酶作用下硝态氮被还原为亚硝态氮,而经过土壤亚硝酸还原酶作用,被进一步还原成铵态氮[33]。而土壤蛋白酶活性降低,使得铵态氮含量减少,从而降低了土壤净氨化速率[34]。土壤含水量降低,减弱参与土壤氮转化的微生物活性,进而降低了土壤无机氮含量[35]。
不同退化梯度湿地土壤净硝化速率与土壤净氨化速率变化趋势恰好相反,这与肖瑞晗[36]的研究结果一致。这可能与含水量有关,随着退化程度加剧土壤含水量降低,土壤透气性增加,土壤微生物表现活跃,硝态氮含量增加,土壤硝化速率增大[37]。此外,随着退化程度的加剧土壤硝酸还原酶活性和脲酶活性增大,净硝化速率与硝酸还原酶活性和脲酶活性呈显著正相关,硝态氮含量增加(表2),促进了土壤反硝化过程,增强了土壤硝酸还原酶活性,反过来进一步促进铵态氮的硝化作用[38],而脲酶的作用是将尿素转化为铵态氮,脲酶活性越大,转化能力越强[39],土壤中铵态氮含量较高,进而促进土壤硝化作用。
本研究也显示,湿地退化显著抑制了土壤氮素矿化过程,净氮矿化速率随着退化程度加剧不变或逐渐减小,且以氨化作用为主,这与马源[40]的研究结果一致。净氮矿化速率减小可能有以下几个方面原因:首先,湿地退化过程中土壤微生物量氮含量明显减小(表2),微生物量氮的矿化率较高,促进土壤氮矿化作用;其次,湿地土壤退化相对较弱时,土壤含水量较高(图2),水分易饱和,导致土壤通气性较小,铵态氮的固化作用大于硝化作用,从而导致净氮矿化速率下降[41];再次,湿地退化导致高寒草甸植物种类减少,植被盖度降低,植物种类减少,使得固氮菌的数量和种类减少,降低了土壤的固氮能力[42],进而降低了湿地土壤氮矿化作用;土壤蛋白酶也是影响土壤氮矿化作用的关键酶,本研究结果表明,尕海湿地土壤净氮矿化速率与蛋白酶活性呈显著正相关,所以蛋白酶活性的降低也是造成土壤氮素矿化作用降低的原因之一,这与胡容在若尔盖高寒湿地退化过程中土壤有机氮矿化演变特征的部分研究结果一致[43]。
3.2 湿地退化过程中土壤氮矿化的时间变化特征
温度和水分通过影响微生物活动和区系而显著影响氮矿化过程[26]。本研究发现,随着时间的推移,不同退化梯度湿地土壤净氨化速率、净硝化速率和净氮矿化速率存在显著差异,7、8月份出现最大值,且变化幅度减小,基本上趋于一致,这与肖好燕对亚热带不同林分土壤矿质氮库及氮矿化速率的季节动态的研究结果一致[44]。这可能是由于不同生长期,温度、降水量等气候条件的差异,土壤净氮矿化过程不同[44]。一些研究发现一定的温度范围内,温度升高对土壤氮矿化过程具有明显促进作用[45],因为土壤温度越高,土壤微生物种类、数量及活性越强[46],在微生物的作用下,土壤氮矿化速率进一步提高,干燥和低温对土壤微生物种类、数量及活性具有限制作用,反映在时间变化上更为明显。土壤含水量是影响氮矿化作用的最主要驱动因素,且与氮矿化速率呈显著正相关,土壤水分对氮矿化的作用也主要是通过影响土壤微生物活性来作用的,较高的土壤含水量造成有利于微生物的繁殖和更新条件,使得微生物量氮周转过程加快,促进土壤氮矿化过程[47]。同时,较多的含水量限制了土壤中铵态氮的有效性,所以在植物不同生长阶段土壤氮矿化速率具有较大差异[47]。且7、8月份降雨量大,加剧了土壤硝态氮淋失,促进湿地土壤的硝化作用[48]。除了温湿度影响外,土壤酶活性也是影响土壤氮矿化的重要因素。土壤酶直接参与土壤养分的转化过程,对环境或者管理因素的变化较敏感,具有时效性[49]。本研究中土壤蛋白酶活性与土壤氮矿化速率呈显著正相关关系。且常文华[50]的研究结果表明,尕海湿地在植物生长初期土壤蛋白酶活性较高,进而有利于土壤氮矿化作用。
土壤植被生长也对湿地土壤氮矿化有重要作用。研究区7、8月份是植物生长的旺季,降雨量较大,植物生长速度较快,对氮素需求量大,从而提高了湿地土壤的氮矿化速率。10月是植物生长季末,对氮素需求降低,从而抑制了土壤净氮矿化作用[51];同时10月份尕海湿地气温已相对较低,抑制了土壤的微生物和酶活性,导致土壤氮矿化作用显著降低。
4 结论
(1)湿地退化对土壤氮矿化过程具有显著抑制作用。随着退化程度的加剧湿地土壤净氮矿化速率不变或者逐渐减小,土壤净氨化速率也显著减小。而土壤净硝化速率逐渐增大,重度退化阶段显著高于其他退化阶段(P<0.05)。
(2)土壤净氨化、净硝化速率和氮矿化速率在不同培养时间也有所差异,各退化阶段在7、8月份出现最大值,10月份值较低,且随着时间的推移其变化幅度趋于一致。湿地退化和培养时间对土壤氮矿化作用存在显著交互影响(P<0.05),且反映在时间变化上更为显著。
(3)冗余分析结果表明,土壤环境因子和酶活性对湿地退化过程中的氮矿化过程均有显著影响(P<0.05),净硝化速率与硝酸还原酶、脲酶活性及温度呈显著正相关(P<0.05),与蛋白酶、亚硝酸还原酶、含水量呈显著负相关(P<0.05),而净氨化和净氮矿化速率与其恰好相反,其中土壤含水量是影响尕海湿地退化过程中土壤氮矿化变化关键驱动因素。

