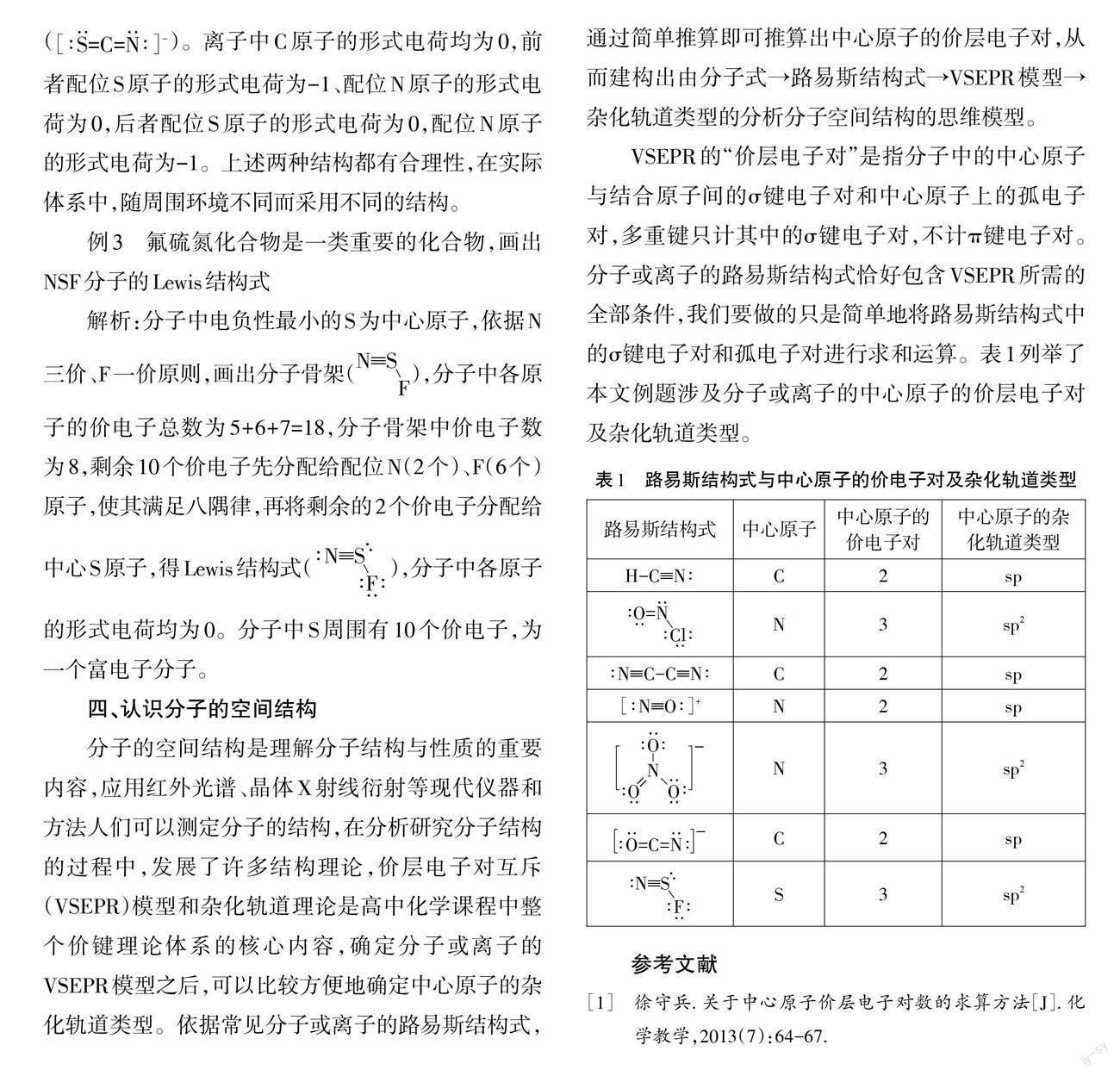
路易斯结构式



摘要:介紹一种既能适用于满足八隅律分子体系,也能适用于一些缺电子体系、富电子体系的路易斯结构式的书写方法。建构出由分子式→路易斯结构式→VSEPR模型→杂化轨道类型的分析分子空间结构的思维模型。
关键词:路易斯;Lewis;结构式;分子结构
文章编号:1008-0546( 2023)09-0071-04
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j.issn.1008-0546.2023.09.014
一、路易斯学说
1904年,是科学史上倍受关注的一年,这一年,诺贝尔物理学奖和化学奖都颁发给了稀有气体的发现研究者。稀有气体发现的意义,不仅是实现了周期表的完美结构,更重要的是稀有气体的化学稳定性使科学家找到了原子之所以相互结合的原因,原子通过相互作用获得了与稀有气体一样的价电子排布,从而变得更加稳定。
1916年美国物理化学家路易斯(G.N.Lewis)通过对一些实验现象的归纳总结,认为分子中的原子都有形成稀有气体电子结构的趋势,以求得本身的稳定。而达到这种稳定结构,并非通过电子转移形成离子键来完成,而是通过共用电子对来实现。提出同种原子以及电负性相近的原子间可以通过共用电子对形成共价分子,分子中的每一个原子都具有稀有气体的稳定结构,原子间通过共用电子对形成的化学键称为共价键。Lewis学说成功地解释了由相同原子组成的分子的形成,也成功解释了电负性相近原子组成的分子的形成。
二、路易斯结构式
1.八隅律
1916年,路易斯(G.N.Lewis)提出了共价键理论,认为由共价键形成的分子中,每个原子均应具有稳定的稀有气体的8电子外层电子构型(He为2个),习惯称之为“八隅律”,即原子外层由于共享电子对,满足稀有气体的八电子外层电子构型时,就可以形成共价键。共享一对电子(A:B)的单键表示为A-B,共享两对电子(A::B)的双键表示为A=B,共享三对电子(A:::B)的三键表示为A-B。原子上未共用的价电子对(A:)叫孤电子对。孤电子对虽然不直接成键,但会影响分子的形状并在分子性质方面发挥重要作用。
2.八隅律的许多例外
随着对分子结构认识的深入,人们认为,原子间共享电子,不仅仅是为了获得稀有气体价电子结构,而是因为共享的电子能增加正电荷原子核间的电子密度,由此产生的原子核对电子的吸引作用是将原子粘合在一起的“胶水”。现代价键理论认为中心元素原子可能形成的共价键数与原子的价轨道数及价电子数有关,并不一定受八隅律限制。例如:第二周期原子价轨道是4,当中心原子价电子数充足形成4个共价键时,满足八隅律规则;但当中心原子价电子数小于价轨道时,形成的分子中心原子周围的价电子数可能不足8个电子,如BeC12、BeH2、BH3、BF3等缺电子分子;超出第二周期后的元素,可以类似于第二周期形成许多满足八隅体结构的物种,如第三周期的Si、P、S、CI分别是四价、三价、二价和一价时,可以形成许多符合八隅律规则的分子,如SiC14、PCl3、SCl2等。但由于它们存在可供利用的d轨道,产生了价层扩充,可以形成稳定的更高价态的化合物,此时这些元素被多于8个的电子所围绕,形成可称之为满足扩展的八隅律的物种,如PCl5、SF4、SF6、CIF3等富电子分子。
3.路易斯结构式
用短线表示共用电子对将成键的元素符号连接起来,并在元素符号周围用小黑点表示未成键的价电子,这种描述分子结构的式子称为Lewis结构式。例如:
一个正确的Lewis结构应该表示出所有的孤对电子,但有机化学家在写结构式时常常忽略部分甚至全部的孤对电子。由于我们阅读时常常需要猜想非共价电子的正确数目,所以有机化学中的这些结构式并不是真正的Lewis结构式。
三、路易斯结构式的书写
路易斯结构式是了解分子结构的基础。实际上当我们对分子结构有了一些基础性的认识之后,路易斯结构式的书写也有多种方法,如依据成键数和孤电子对数推测Lewis结构式、依据分子骨架和八隅律推测Lewis结构式等。限于篇幅,本文仅介绍一种既能适用于满足八隅律也能适用于一些例外情况的书写方法。
步骤1,确定中心原子。分子不是原子的简单堆积,而是通过复杂的化学结合力按一定的顺序排列起来的,自然就存在着中心原子和配位原子。在一个分子中,中心原子一般是单原子,如BF3分子的中心原子是B原子,XeF4分子的中心原子是Xe原子;如果一个分子中有多个单原子,中心原子一般是化合价数最高的单原子,如POC13的中心原子是P原子,NOF的中心原子是N原子,NSF的中心原子是S原子;如果一个分子中有多个同主族的单原子,中心原子一般是原子序数大的单原子,如SOCl2的中心原子是S原子。个别情况下,单原子并不是中心原子,如N20分子中中心原子是N原子。
确定中心原子的一般原则是:(1)H原子总是作为配位原子,因为H原子只有一个电子,故出现在中心的情况很罕见。(2)F原子永远作为配位原子,因为F原子为第二周期元素,无可供利用的d轨道,而其本身已有7个价电子,这样只能作为配位原子形成一个共价键。(3)O原子一般为配位原子,而当分子或离子中存在H原子时,可以形成OH基团作为配位基团。(4)C原子形成数不胜数有机分子的结构特点表明它应当总是位于中心。(5)电负性较小的原子一般为中心原子,电负性大的原子为配位原子。
步骤2,画出共价分子骨架。将中心原子和相邻配位原子按满足配位原子八隅律的键合关系用单键、双键或三键相连接,得分子或离子骨架。配位原子满足八隅律与中心原子形成共价键的类型一般为卤族元素形成单键、氧族元素形成双键、氮族元素形成三键。注意,如果微粒带负电荷,计算时负电荷归配位原子,如NO3带一个负电荷,其中一个配位O原子的价电子数视为7,该O原子和中心原子形成单键。
步骤3,分配剩余价电子数。路易斯结构式仅利用有关原子的价电子来显示分子或离子中原子之间的联系,对于主族元素,中心原子带入路易斯结构的价电子数与其在周期表中的族数相同,如果我们研究的对象是离子,求算价电子总数时,特别要注意计算阴离子价电子数目时要加上所带的电荷数,计算阳离子价电子数目时要减去所带的电荷数。
合计组成原子的所有价电子,根据成键情况得出骨架连接所用价电子数,将剩余价电子首先分配给配位原子使其满足八隅律,多余的价电子再分配给中心原子。
步骤4,分配形式电荷给分子中的原子。许多分子的路易斯结构是不完整的,直到我们确认它们的原子是否带有形式电荷。形式电荷提供一个保持电子踪迹的方法,它们可能是也可能不是真实的电荷。形式电荷的概念有助于我们确定一个带电荷的分子里谁带了这个电荷的大部分,同时还可以帮助我们看清在整个分子或离子里所有原子携带电荷的情况。
在计算分子中每个原子的价电子数时,每个孤电子对给分子中的一个原子贡献2个电子,每个共用电子对为成键双方各提供1个电子。如果计算得到的某个原子的价电子数和周期表中该原子的最外层电子数有差别,则该原子是带形式电荷的。这样,通过下式可以计算出一个给定原子的形式电荷:
形式电荷(FC)=主族序数一非键电子数一键数
当一个分子或离子,依据上述规则写出的路易斯结构式有多种时,能量最低的结构通常是各原子形式电荷最小的结构(一般在+1和一1之间),特别是所有原子的形式电荷都等于零的结构。
例1 画出下列分子的Lewis结构式。
(1)氢氰酸(HCN);(2)亚硝酰氯(NOCI); (3)(CN)2
解析:(1)C原子为中心原子,依据H一价、N三价原则,画出分子骨架(H-C-N),分子中各原子的价电子总数为1+4+5=10,分子骨架中价电子数为8,剩余2个价电子分配给N原子,使其满足八隅律,得Lewis结构式(H-C-N:),分子中各原子的形式电荷均为O。
(2)N原子为中心原子,依据O二价、CI一价原则,画 分子骨架O=N
,分子中各原子的价电子总数为6+5+7=18,分子骨架中价电子数为6,剩余1 2个价电子先分配给配位O(4个)、Cl(6个)原子,使其满足八隅律,再将剩余的2个价电子分配给中心原子,得Lewis结构式(:Q=N
:),分子中各原子的形式电荷均为o。
(3)C原子为中心原子,依据N三价原则,画出分子骨架(N-C-C-N),分子中各原子的价电子总数为5+4+4+5=18,分子骨架中价电子数为1 4,剩余4个价电子分别分配给两个配位N(2个)原子,使其满足八隅律,得Lewis结构式(:N-C-C-N:),分子中各原子的形式电荷均为O。
例2 画出下列离子的Lewis结构式。
(1)NO+(2)NO3
(3)SCN-
解析:(1)NO+中N原子为中心原子,O原子为配位原子,离子带一个正电荷,计算时正电荷归配位原子,这样,配位O原子的价电子数视为5,和中心原子形成三键,画出离子骨架([N=O]+)。离子中各原子的价电子总数为5+6-1=10,离子骨架中价电子数为6,剩余4个价电子先分配给配位0(2个)原子,使其满足八隅律,再将剩余的2个价电子分配给中心N原子,得Lewis结构式([:N三O:]+),离子中N原子的形式电荷为O、O原子的形式电荷为+1。
(2)NO3中N原子为中心原子,O原子为配位原子.离子带一个负电荷,计算时负电荷归其中一个配位O原子,这样,该配位O原子的价电子数视为7,另二个O原子应以正常二价和中心N原子相连接,画出
离子骨架(
)。这是一个具有欺骗性的离子骨架,其中心N原子形成的价键数刚好和化合价一致,但它是错误的,因为N元素位于第二周期,只有4个价轨道,价键数最大值为4,故应调整离子骨架为
(
)。离子中各原子的价电子总数为5+3×6+ 1=24,离子骨架中价电子数为8,剩余16个价电子先分配给二价配位0(4个)原子,再分配给二个一价配位O(各6个)原子,使其满足八隅律,得Lewis结构式 (
),离子中N原子的形式电荷为+1、二价配 位O原子的形式电荷为O,二个一价配位O原子的形式电荷均为一1。
(3)SCN一中C原子为中心原子,离子带一个负电荷,计算时负电荷归其中一个配位S原子或N原子,若归S原子,该配位S原子的价电子数视为7,应以一价和中心C原子相连接,画出离子骨架([S-C-N]一);若归N原子,该配位N原子的价电子数视为6,应以二价和中心C原子相连接,画出离子骨架([S=C=N]一)。离子中各原子的价电子总数为6+4+5+1=16.离子骨架中价电子数为8,剩余8个价电子分别分配给配位S原子及N原子,得Lewis结构式([:S-C-N:]一)或([:§=C=N:]一)。离子中C原子的形式电荷均为O,前者配位S原子的形式电荷为一1、配位N原子的形式电荷为O,后者配位S原子的形式电荷为O,配位N原子的形式电荷为一1。上述两种结构都有合理性,在实际体系中,随周围环境不同而采用不同的结构。
例3 氟硫氮化合物是一类重要的化合物,画出NSF分子的Lewis结构式
解析:分子中电负性最小的S为中心原子,依据N三价、F一价原则,画出分子骨架(N-Sx),分子中各原子的价电子总数为5+6+ 7=18,分子骨架中价电子数为8,剩余1 0个价电子先分配给配位N(2个)、F(6个)原子,使其满足八隅律,再将剩余的2个价电子分配给 中心S原子,得Lewis结构式(,分子中各原子
的形式电荷均为O。分子中S周围有1 0个价电子,为一个富电子分子。
四、认识分子的空间结构
分子的空间结构是理解分子結构与性质的重要内容,应用红外光谱、晶体X射线衍射等现代仪器和方法人们可以测定分子的结构,在分析研究分子结构的过程中,发展了许多结构理论,价层电子对互斥(VSEPR)模型和杂化轨道理论是高中化学课程中整个价键理论体系的核心内容,确定分子或离子的VSEPR模型之后,可以比较方便地确定中心原子的杂化轨道类型。依据常见分子或离子的路易斯结构式,通过简单推算即可推算出中心原子的价层电子对,从而建构出由分子式→路易斯结构式→VSEPR模型→杂化轨道类型的分析分子空间结构的思维模型。
VSEPR的“价层电子对”是指分子中的中心原子与结合原子间的σ键电子对和中心原子上的孤电子对,多重键只计其中的σ键电子对,不计π键电子对。分子或离子的路易斯结构式恰好包含VSEPR所需的全部条件,我们要做的只是简单地将路易斯结构式中的σ键电子对和孤电子对进行求和运算。表1列举了本文例题涉及分子或离子的中心原子的价层电子对及杂化轨道类型。
参考文献
[1] 徐守兵.关于中心原子价层电子对数的求算方法[J].化学教学,2013 (7):64-67.

