珊瑚菜盐胁迫相关GlRTH 基因的克隆和表达量分析
徐 瑶,任宏伟,张馨方,王 芳,朱 丹,谭玲玲,袁 涛,高 婷*
1. 青岛农业大学生命科学学院 山东省高校植物生物技术重点实验室,山东 青岛 266109
2. 青岛农业大学建筑工程学院,山东 青岛 266109
珊瑚菜GlehnialittoralisFr. Schmidt ex Miq.是伞形科(Umbelliferae)珊瑚菜属GlehniaF. Schmidt的多年生草本植物[1]。其干燥根称为北沙参,是我国重要的传统中药材,药用价值较高,具有益胃生津、养阴清肺、镇咳祛痰等功效[2-3]。珊瑚菜属于盐生植物,生长地主要在中国山东、福建、辽宁、河北省以及俄罗斯、朝鲜、日本、北美等的沿海沙滩和沙堤上,对于海岸固沙及盐碱地改良均发挥了重要的作用[4-5]。目前珊瑚菜野生资源越来越少,已经列为我国渐危物种、国家二级重点保护植物[1-2]。此外,珊瑚菜的茎和根有很高的食用价值,随着市场需求的不断扩大,受到了越来越多的关注。
土壤盐碱化是目前人类面临的重要环境问题,根据2015 年联合国粮食及农业组织发布的世界土壤资源状况报告,全球受盐碱影响的土壤总面积达10 亿hm2,对农牧业的可持续发展构成了严重威胁[6-7],耐盐碱作物资源对扼制土地的盐渍化和提高盐荒地的利用具有重要意义,培育耐盐碱性的植物资源就成为了当下急需解决的问题之一。目前,对于耐盐碱植物的研究主要围绕着植物耐盐碱反应机制以及在抗逆反应机制有作用的因子[8],珊瑚菜中抗盐相关的基因尚未被研究。
植物激素乙烯影响着许多植物生长发育过程中的生物学过程[9]。RTE1(reversal to ethylenesensitivity 1)基因是近年来发现的一个在植物、动物和某些原生生物中保守的新基因[10]。研究表明乙烯受体ETR1 存在于内质网(endoplasmic reticulum,ER)膜上,跨膜蛋白RTE1 定位于ER 和高尔基体,且 ETR1 受到 RTE1 的负调控[11-12]。RTE1-HOMOLOG(RTH)是拟南芥RTE1基因家族中唯一的同源蛋白,RTH 突变体对外源乙烯具有不敏感性,过表达可导致乙烯过敏感[12-13]。同时,乙烯作为一种植物胁迫激素,也可以提高植物的抗逆性。有研究显示水稻和拟南芥外施乙烯和乙烯前体ACC后对盐胁迫的敏感性明显降低,显著增加了野生型拟南芥幼苗在高盐环境下的抗盐能力及成活率[12]。通过拟南芥盐胁迫下的转录组分析表明:大量乙烯应答基因的表达量均发生了显著变化[14]。大量研究显示:乙烯信号途径中的重要组分EIN3 等均参与了植物的盐胁迫反应[15-17]。RTH 蛋白响应乙烯信号,可能也在植物抗盐过程中发挥重要作用。
本研究在前期已完成的珊瑚菜转录组高通量测序数据(GenBank 号PRJNA387325)的基础上,使用关键词RTE1-HOMOLOG(RTH)对珊瑚菜转录组数据库进行筛选,筛选到1 条转录组序列(c48547g1)。克隆获得了珊瑚菜GlRTH基因序列,对分析了该基因在珊瑚菜不同部位及在NaCl 和1-氨基环丙烷羧酸(1-aminocyclopropanecarboxylic acid,ACC)不同处理时间的表达量变化。该研究结果有助于揭示乙烯信号通路分子和植物响应高盐胁迫的关系。
1 材料与仪器、试剂
1.1 材料
实验室培养的开花期珊瑚菜以及2 个月珊瑚菜幼苗。由青岛农业大学高婷副教授鉴定为珊瑚菜G.littoralisFr. Schmidt ex Miq.。
1.2 仪器
SIM-F140AY65 型制冰机(日本三洋公司),G154TW 型灭菌锅(AUTO CLAVE 公司),Anke GL-20C-II 低温冷冻离心机(飞鸽),DV215CD 型电子天平(Ohaus Discovery),Tanon 500 凝胶成像分析系统(上海领成公司),核酸电泳系统(美国Bio-RAD 公司),S1000PCR 仪(美国伯乐公司),小型台式离心机(德国Eppendorff Centrifuge 5424),Milli-Q 型超纯水仪,Stratagene Mx3000P 实时荧光定量PCR 仪(美国安捷伦),超微量分光光度计(美国Thermo NanoDropOne 公司)。
1.3 试剂
TaKaRa Ex Taq 酶,TaKaRa TaqTM试剂盒,胶回收试剂盒,pMD™18-T 质粒载体,大肠杆菌DH5α 感受态,天根多糖多酚植物总RNA 提取试剂盒,诺唯赞反转录试剂盒,TaKaRa SMARTer RACE 5’/3’ Kit试剂盒,诺唯赞TB Green®Premix Ex Taq™ II 荧光定量试剂盒。
2 方法
2.1 GlRTH 基因开放阅读框(open reading frame,ORF)的克隆和测序
以新鲜珊瑚菜幼苗为材料,使用多糖多酚植物总RNA 提取试剂盒提取珊瑚菜幼苗总RNA,使用超微量分光光度计检测RNA 浓度及其在260、280 nm 下的吸光度值(A)比值(A260/A280),并进行记录。通过反转录试剂盒对珊瑚菜幼苗总RNA 进行反转录,从而获得珊瑚菜cDNA。使用1%琼脂糖凝胶进行cDNA 检测,并放-20 ℃保存备用。
在前期已完成的珊瑚菜转录组高通量测序数据(GenBank 号PRJNA387325)的基础上,使用关键词RTE1-HOMOLOG(RTH)进行筛选得到的1 条转录组序列(c48547g1)。以此为模板设计引物,送青岛擎科生物技术公司合成引物GlRTH-F 和GlRTH-R。使用Ex Taq 酶通过qRT-PCR 进行克隆,TaKaRaTaqTM试剂盒对PCR 产物末端加入A 尾,电泳后使用胶回收试剂盒对扩增正确的目的片段进行胶回收。将回收片段连接到18-T 载体上。将构建完毕的18-T 载体转入大肠杆菌感受态细胞中,随后涂布在氨苄青霉素(AMP)抗性的LB 固体培养基中培养,37 ℃倒置黑暗培养过夜。次日挑取饱满圆形的大肠杆菌菌斑放入AMP抗性的LB液体培养基中培养6 h,使用Ex Taq 酶对挑取的大肠杆菌进行菌液PCR 电泳检测。选取与目标基因片段处对应的菌液送至生物工程股份有限公司测序,引物见表1。

表1 GlRTH 基因克隆及qRT-PCR 所用的引物序列Table 1 Primer sequences of GlRTH gene cloning and qRT-PCR
2.2 cDNA 末端快速扩增(rapid amplification of cDNA ends,RACE)
参考TaKaRa SMARTer RACE 5’/3’ Kit 试剂盒说明书进行操作。使用DNAMAN6.0 软件对已知GlRTH基因的部分序列分别设计3’RACE 特异性引物,GlRTH-3'RACE long 和GlRTH-3'RACE short。对已知GlRTH基因的部分序列的3’端进行3’ Race PCR。随后进行电泳、胶回收、连接、转化以及测序,与“2.1”项中的步骤一致。使用DNAMAN 6.0软件,将测序结果与原序列进行拼接,从而获得GlRTH基因的全长ORF 序列。
2.3 GlRTH 基因荧光定量检测
2.3.1 样品的处理以及cDNA 获取 选取开花期珊瑚菜植株的根、叶和花各3 份,将样品迅速放于液氮中。从种植苗圃中挑选健康的刚生长出真叶的珊瑚菜幼苗以及一年生珊瑚菜全株,用蒸馏水洗净表面泥沙,吸干多余水分,分为2 份备用。在培养皿中铺上干净的滤纸,并倒入200 mmol/L 的NaCl 溶液,另一份倒入100 mmol/L 的ACC 溶液,盖好培养皿盖子,放入黑暗培养箱中培养。NaCl 处理样本在0、3、6、12、24、36 h 各取样1 次,每个样本3份重复,ACC 处理样本在0、3、6、12 h 各取样1次,每个样品3 份重复,样品全株及时放入液氮中,-80 ℃保存。根据“2.1”项中的步骤对所取得不同珊瑚菜样本进行RNA 的提取以及反转录。
2.3.2 目的基因荧光定量PCR 以高通量测序获得的序列为依据,以珊瑚菜Actin作为内参基因,利用NCBI 软件设计荧光定量PCR 的正反向引物c48547g1-F 、 c48547g1-R 、GlActin-F 以 及GlActin-R。构建qRT-PCR 体系,以不同部位的即花、叶和根中提取出的RNA 以及200 mmol/L NaCl 处理0、3、6、12、24、36 h 以及100 mmol/L ACC 处理0、3、6、12 h 的幼苗得到的cDNA 为模板,每组3 个重复。利用荧光定量PCR 获得Ct值,使用2-ΔΔCt数据分析法对荧光定量数据进行分析。
2.4 生物信息学分析
使用生物信息学相关网站以及软件:NCBI,DNAMAN、Protparam、ProtScale、TMHMM、SOPMA、SWISS-MODLE、ClustalX、MEGA6 等,对目的基因GlRTH进行ORF 的识别和保守结构域分析、蛋白质理化性质及跨膜结构域分析、蛋白质二级及三级结构预测、同源蛋白比对以及分子发育系统分析。
3 结果与分析
3.1 GlRTH 基因的扩增检测和测序结果
为了获得珊瑚菜GlRTH基因全长ORF 序列,通过转录组已有GlRTH序列设计引物,对珊瑚菜GlRTHORF 序列进行PCR 扩增以及克隆、测序,如图1 电泳图GlRTH电泳条带位置与转录组GlRTHORF 长度相一致,对GlRTH电泳条带进行回收测序,测序结果显示与转录组序列一致,表明获得了珊瑚菜GlRTH的ORF 序列,见图1。

图1 GlRTH 的ORF 克隆电泳 (A) 及GlRTH 的ORF 克隆测序比对结果 (B)Fig. 1 Electrophoresis of GlRTH ORF cloning (A) and GlRTH ORF cloning sequencing comparison results (B)
3.2 RACE 结果
为了确定GlRTH基因的全长ORF 序列,对其进行3’RACE PCR,结果如图2 所示,推测PCR 正确片段长度大约在500~750 bp,因此对图中正确的DNA 条带(箭头所指)进行回收并测序。将3’RACE测序结果与ORF 测序结果进行比对,结果一致最终确定了GlRTH基因的全长ORF 序列进行后续分析。

图2 GlRTH 3’RACE PCR 电泳图Fig. 2 Electrophoresis of GlRTH gene 3’ RACE PCR
3.3 生物信息学分析
3.3.1 ORF 的识别 利用NCBI 提供的ORF Finder对得到的GlRTH序列进行分析,如图3 可知该序列ORF 长为690 bp,共编码229 个氨基酸。

图3 GlRTH 基因序列与氨基酸序列Fig. 3 GlRTH gene sequence and amino acid sequence
3.3.2 保守结构域分析 将GlRTH 蛋白序列于NCBI在线网站进行保守结构域预测。预测结果如图4 所示,40~173 氨基酸编码区属于DUF778 超家族保守结构域。推测GlRTH 蛋白行使转录调控因子的作用。

图4 GlRTH 蛋白的保守结构预测Fig. 4 Prediction of conserved structure of GlRTH protein
3.3.3 蛋白质理化性质及跨膜结构域分析 使用ExPASy 对GlRTH 蛋白进行了亲疏水性预测以及蛋白跨膜结构域预测,如图5 所示,GlRTH 蛋白相对分子质量为26 150.28,等电点为6.05。不稳定系数为30.08,从而说明该蛋白稳定。总平均亲水性为0.145,为疏水性蛋白,GlRTH 蛋白在第6 个氨基酸位点出现最低峰值,最低峰值为-3.256,在第187个氨基酸位点,出现最高峰值,最高峰值为2.733。同时预测GlRTE1 蛋白存在跨膜结构域。蛋白进行三级结构预测。结果如图6-B 所示,预测AtRTH 蛋白使用模体为4q95.1.B,预测GlRTE1 蛋白使用模体为4q95.1.A,GlRTH 蛋白三级结构包含了103 个氨基酸,占编码氨基酸总数的44.98%可信度较高。通过比对发现GlRTH 与AtRTH 预测蛋白空间结构较为相似,普遍包含空间结构相似的无规则卷曲、β-片层、α-螺旋3 种空间结构,推测两者蛋白在功能上可能存在一定的保守型与相似性。

图5 GlRTH 蛋白质亲疏水性预测 (A) 以及GlRTH 蛋白质跨膜结构域分析 (B)Fig. 5 Prediction of hydrophilicity and hydrophobicity of GlRTH protein (A) and GlRTH protein transmembrane domain (B)
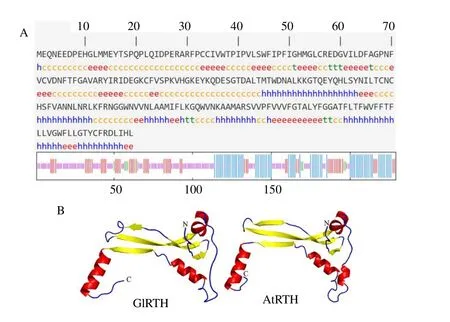
图6 GlRTH 蛋白的二级结构预测 (A) 以及GlRTH 与AtRTH 蛋白三级结构预测 (B)Fig. 6 Prediction of secondary structure of GlRTH protein (A) and tertiary structure of GlRTH protein and AtRTH protein (B)
3.3.4 蛋白质二级、三级结构预测 对GlRTH 蛋白二级结构进行预测。结果如图6-A 所示,GlRTH 二级结构中有70 个氨基酸参与形成了α-螺旋,占30.57%。55 个氨基酸参与了延伸链的形成,占24.02%。95 个氨基酸参与了无规卷曲的形成,占41.48%。GlRTH主要结构均为α-螺旋和无规卷曲,α-螺旋是最为稳定的蛋白质空间结构,其中α-螺旋的比例仅为30.57%,因此推测此蛋白稳定性一般。对GlRTH蛋白与AtRTH
3.3.5 GlRTH 蛋白系统进化分析与氨基酸比对对不同物种的RTH 蛋白进行了氨基酸序列比对与系统进化树分析,如图7-A 所示,GlRTH 蛋白与在这些序列中珊瑚菜的 RTH 蛋白与黄胡萝卜Daucuscarotasubsp.sativus的RTH 蛋白亲缘关系最近,而与豇豆VignaunguiculateL.、铁皮石斛DendrobiumcatenatumL.、拟南芥Arabidopsis thaliana(L.) Heynh.的RTH 蛋白亲缘关系较远,因此符合进化关系。
通过GlRTH 蛋白与其他物种RTH 蛋白氨基酸比对结果图7-B 发现,图中所有物种的RTH 蛋白存在部分保守性基序,从而说明图中各个物种的RTH 蛋白存在一定的同源性。对图中所有物种RTH 蛋白进行三级结构及保守结构域预测,结果显示各蛋白结构均与GlRTH 蛋白结构相似,各蛋白氨基酸序列均包含1 个DUF778 超家族的蛋白保守结构域。
3.4 GlRTH 基因的表达量分析
3.4.1 不同部位的表达量分析 以珊瑚菜花为对照,分析根、叶、花不同部位的GlRTH基因表达量差异。图8 可以看出,在珊瑚菜的不同部位GlRTH基因的表达量存在明显差异,该基因在花中的表达要明显高于叶和根,而在根和叶中的表达没有显著差异。以上结果表明,GlRTH在不同的部位功能有所差异。

图8 珊瑚菜GlRTH 基因组织表达分析Fig. 8 Differential expression analysis of GlRTH gene in leaves, roots and flowers of G. littoralis
3.4.2 盐胁迫和ACC 处理后表达量分析 不同时间200 mmol/L NaCl以及100 mmol/L ACC处理叶片后得到的GlRTH基因表达结果如图9 所示:经过200 mmol/L NaCl 处理后,珊瑚菜GlRTH基因表达量有明显的变化,整体均为上调趋势,36 h 最为显著。由图9-B 可以看出ACC 处理3 h 时GlRTH基因表达量上调显著,而在6 h 和12 h 时GlRTH基因表达量下调,整体呈先上升再下降的趋势。

图9 NaCl (A) 以及ACC (B) 处理不同时间GlRTH基因表达Fig. 9 GlRTH gene expression at different NaCl (A) and ACC (B) treatment time
4 讨论
珊瑚菜作为我国重要的传统中药材,具有养阴清肺、镇咳祛痰等功效,同时作为主要生长于沙质环境的盐生植物,珊瑚菜在盐碱地改良上也起到了不容忽视的作用。本研究筛选得到了药用盐生植物珊瑚菜中响应盐胁迫的乙烯信号分子GlRTH基因,首次克隆得到该基因的ORF 全长,并通过生物信息学以及表达量分析对该基因进行了初步研究,为后续的研究奠定了基础。
有研究表明,跨膜蛋白RTE1 负向调节乙烯信号受体蛋白ETR1 从而参与乙烯信号转导[18],如在拟南芥中过表达月季的RhRTE1基因起到了降低乙烯敏感性的作用[19]。在拟南芥中,RTH 作为RTE1基因家族的唯一同源基因同样是通过RTE1 在调节乙烯反应和信号传导方面发挥作用,RTH缺失突变体对外源性ACC 的敏感性较低,而RTH过表达导致乙烯超敏反应[12]。水稻OsRTH 调节水稻的乙烯反应,OsRTH1过表达回补了rte1-2 功能缺失突变,并以ETR1 依赖的方式导致植株乙烯不敏感[20]。
植物激素在抵御非生物胁迫中发挥了关键作用,乙烯作为一种气态植物激素同样参与到了植物应对非生物胁迫中[18,21],当植物体接收到胁迫信号时,体内乙烯含量发生改变,乙烯信号通过相应的信号转导途径进行传递后,可以对下游相关基因进行调控,进而使植物细胞在生理水平发生变化,以应对胁迫[22]。乙烯信号转导途径中的各个组分均参与植物的盐胁迫反应。如拟南芥中乙烯信号传导的中心膜蛋白EIN2 的突变导致极端的盐敏感性,而EIN2 的过表达抑制了ein2-5的盐敏感性,这表明EIN2 参与了拟南芥耐盐反应[23]。EIN3 是乙烯信号转导中的正调控因子,拟南芥中缺失突变体ein3-1对盐的敏感性明显增加而过表达株系则表现出低盐敏感性[15]。拟南芥中乙烯信号通路下游组分AtNAC2 的表达量受到盐和乙烯两者同时诱导,而盐对该基因的诱导依赖于乙烯信号途径[24]。过表达乙烯受体NtHK1 使烟草对盐胁迫更敏感[25]。ERFs作为EIN3 的下游调控因子,对植物响应盐胁迫也能起到一定的作用[26]。
对珊瑚菜进行NaCl 和ACC 处理后表达量分析结果显示,2 种处理后GlRTH基因表达量均变化明显,在3 h 时均呈现上调趋势,说明GlRTH 蛋白是乙烯的响应因子,并且与珊瑚菜的耐盐性相关。GlRTH基因的表达量在ACC 处理后先于NaCl 处理达到峰值。推测GlRTH可能通过响应乙烯信号对下游基因进行调控,从而影响珊瑚菜的耐盐性。本实验室前期在拟南芥中对AtRTH基因的表达、亚细胞定位、蛋白互作、作用机制开展了一系列研究[12]。根据前期研究,推测珊瑚菜中响应盐胁迫的乙烯信号转导通路的大体途径可能如下:RTH 接受乙烯信号继而影响RTE1,RTE1 负向调节受体蛋白ETR1,然后将其传递给受体CTR1 和EIN3,最终影响下游ERFs 家族,诱导一些盐胁迫相关的基因表达,从而引起珊瑚菜的耐盐反应。
本研究首次在药用植物珊瑚菜中对该基因开展分析,有助于揭示乙烯信号通路和药用植物抗盐反应的关系,后续将继续对此基因的具体功能及其在植物抗盐反应中的分子及生化机制开展研究。本研究为提高盐生植物珊瑚菜及其他药用植物耐盐性提供了一定研究依据。
利益冲突所有作者均声明不存在利益冲突

