丁酸钠对高尿酸血症模型小鼠肠道屏障的保护作用
李宇鹍 刘欣 王荣 沈茜 丁雪丽 田字彬
(1 青岛大学附属医院消化内科,山东 青岛 266003; 2 潍坊医学院整形外科医院)
高尿酸血症是一种常见代谢性疾病,由嘌呤代谢失调引起[1]。在大多数哺乳动物中,尿酸通过尿酸氧化酶转化为更容易溶解的尿囊素排出体外。然而尿酸氧化酶基因在人类和类人猿的进化过程中发生了沉默突变,因此人类易患高尿酸血症[2]。
人体尿酸主要通过肾脏途径和肠道等肾外途径进行排泄,其中肾脏排泄约占70%,肠道排泄约占30%[3-4]。尿酸的肠道排泄依赖于完整的肠道屏障及其维持的肠道稳态。本课题组前期研究发现,高尿酸血症模型小鼠粪便中短链脂肪酸(SCFAs)的含量明显降低,可能存在有肠道黏膜屏障的损伤[5-6]。SCFAs是由特定的厌氧菌发酵膳食纤维和抗性淀粉等产生,在调节能量代谢、免疫、肠道发育方面有重要作用[7]。SCFAs主要为乙酸、丙酸和丁酸,其中丁酸是结肠上皮细胞最主要的能量来源,直接影响肠细胞生长和分化,对维持肠黏膜的健康和完整有重要意义[8]。研究表明丁酸钠能够调节脂肪性肝炎小鼠的肠道菌群,保护肠道屏障,从而减轻小鼠的脂肪性肝炎[9]。本研究旨在探讨丁酸钠对高尿酸血症模型小鼠肠黏膜屏障的保护作用及机制。现将结果报告如下。
1 材料与方法
1.1 动物和试剂
SPF级6周龄雄性C57BL/6小鼠24只,体质量18~23 g,来自山东省痛风实验室。氧嗪酸钾(美国Sigma公司);丁酸钠(上海源叶生物科技有限公司);BCA蛋白浓度试剂盒(武汉伊莱瑞特生物科技股份有限公司);ZO-1兔单克隆抗体(英国Abcom公司);Occludin兔单克隆抗体(Servicebio);GAPDH、Tublin鼠单克隆抗体(上海爱必信生物科技有限公司);ELISA试剂盒、超敏化学发光(ECL)底物液(武汉伊莱瑞特生物科技股份有限公司)。
1.2 方法
1.2.1动物分组和处理C57BL/6小鼠于24 ℃、湿度50%、标准12-12 h昼夜节律环境下适应性喂养7 d。随机分为对照组、模型组、丁酸钠组,每组8只。模型组每天腹腔注射氧嗪酸钾250 mg/kg,并自由取食高酵母饲料,制备高尿酸血症模型[10],丁酸钠组小鼠在模型组饲养基础上每天灌胃丁酸钠200 mg/kg,对照组每天腹腔注射和灌胃等剂量生理盐水,共干预21 d。
1.2.2样本采集和制作 在干预的第7天,所有小鼠腹腔均注射氧嗪酸钾1 h以后,于内眦静脉取血0.5 mL,检测血尿酸水平,以判断高尿酸血症小鼠模型是否成功。第21天时,记录所有小鼠体质量,并收集小鼠新鲜粪便,用于后续实验。然后CO2法处死,处死12 h前禁食,取所有小鼠小肠组织,置于液氮中,-80 ℃冰箱保存备用。取各组小鼠小肠组织0.5 cm,以40 g/L多聚甲醛固定后,经脱水、包埋、透明、切片等步骤,制作成4 μm厚的病理切片。HE染色显微镜下观察小肠组织病理改变。
1.2.3Western blot方法检测各组小鼠肠组织中ZO-1和Occludin蛋白表达 提取所有小鼠小肠组织总蛋白,BCA法测定蛋白浓度。制备10%分离胶、5%浓缩胶,将玻璃板固定在电泳槽上,先80 V后120 V恒压电泳,290 mA恒流湿转法转膜。完成以后,用抗体稀释液按说明书稀释一抗(ZO-1、Occludin 1∶1 000稀释,Tublin、GAPDH 1∶5 000稀释),将一抗完全浸润PVDF膜后置于4 ℃摇床孵育过夜,使用与一抗相对应的稀释过的二抗(1∶15 000稀释)室温孵育PVDF膜1.5 h,ECL化学显影,暗室曝光。实验重复3次,用Image J软件分析条带灰度值,目的蛋白的相对表达量以目的蛋白灰度值/内参蛋白灰度值计算。
1.2.4免疫组化检测小肠组织中ZO-1和Occludin蛋白的表达 取所有小鼠小肠组织切片,烘烤2 h后二甲苯脱蜡,复水;用TRIS-EDTA修复抗原3 min;用体积分数0.03的H2O2-甲醇溶液在暗匣中避光室温孵育10 min,阻断内源性过氧化物酶活性;以体积分数0.10的羊血清37 ℃下孵育30 min,封闭非特异性抗原;滴加一抗(ZO-1 1∶100稀释,Occludin 1∶500稀释),湿盒内4 ℃下孵育过夜;滴加二抗,37 ℃下孵育30 min,DAB显色5~10 min;苏木素复染,乙醇脱水,二甲苯透明,中性树脂封片。荧光显微镜下随机选取不重叠的视野5个,采用Image Pro-Plus 6.0进行免疫组化染色结果分析,免疫组化ZO-1和Occludin蛋白染色阳性结果呈现棕黄色,分离色彩后选取黄色部分,测定阳性颗粒积分吸光度和阳性表达面积。
1.2.5RT-qPCR方法检测小鼠肠组织中ZO-1和OccludinmRNA表达 根据试剂盒说明书使用RNAiso Plus从所有小鼠小肠组织中提取总RNA。用Evo M-MLV反转录预混型试剂盒,去除gDNA,将其反转录为cDNA,以β-actin作为内参照,进行 RT-qPCR。每个样品分别设置3个复孔,实验重复3次。RT-qPCR扩增条件为,94 ℃预变性5 min;然后95 ℃变性3 s,60 ℃退火/延伸30 s,共进行40个循环。采用2-△△CT的方法计算目的基因的相对表达量,引物名称及序列见表1。
1.3 统计学处理


表1 引物名称及其序列
2 结 果
2.1 模型组小鼠血清尿酸和粪便丁酸含量水平
当灌胃至第7天时,对照组和模型组小鼠的血清中尿酸水平分别为(110.35±18.33)、(353.18±57.32)μmol/L,两组差异有显著意义(t=9.95,P<0.05),提示高尿酸血症小鼠模型建立成功。灌胃第21天时,对照组和模型组小鼠粪便中丁酸含量分别为(217.90±78.15)、(29.75±9.24)μg/g,两组小鼠比较差异显著(t=4.78,P<0.05),表明高尿酸血症小鼠粪便丁酸含量降低,小鼠可以用于后续实验。
2.2 各组小鼠体质量变化
干预期间3组小鼠均毛色黑亮,精神状态、行动力正常,整体状态良好。干预结束时,对照组、模型组和丁酸钠组小鼠的体质量分别为(21.56±0.83)、(20.33±0.36)、(21.66±0.95)g,3组小鼠体质量比较差异有显著性(F=4.70,P<0.05),其中模型组比对照组体质量显著降低(t=3.03,P<0.05),丁酸钠组与模型组相比体质量显著升高(t=2.90,P<0.05)。
2.3 各组小鼠小肠组织中ZO-1和Occludin蛋白和mRNA表达水平
3组小鼠小肠组织中ZO-1、Occludin蛋白表达量比较差异均具有显著意义(F=13.65、51.42,P<0.05),其中模型组与对照组、丁酸钠组2种mRNA表达量比较差异均具有显著意义(t=2.55~11.04,P<0.05),见图1。
3组小鼠小肠组织中ZO-1、OccludinmRNA表达量比较差异均有显著性(F=6.07、10.63,P<0.05),其中模型组与对照组、丁酸钠组2种mRNA表达量比较差异均具有显著性(t=3.72~5.12,P<0.05),见表2。
免疫组化染色结果显示,与对照组小鼠相比,模型组小鼠小肠组织ZO-1以及Occludin蛋白阳性染色面积和强度降低,丁酸钠组小鼠小肠组织ZO-1和Occludin蛋白阳性染色面积和强度均高于模型组,见图2。
2.4 各组小鼠小肠组织病理改变比较
显微镜下观察显示,对照组小鼠小肠上皮结构完整,未见明显病理损伤;模型组小鼠小肠局部上皮脱落、绒毛大量减少、断裂;丁酸钠组小肠上皮相对完整,绒毛轻度断裂,见图3。
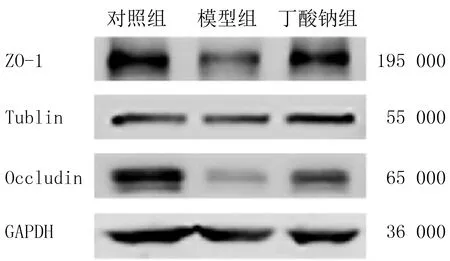
图1 各组小鼠小肠组织中ZO-1和Occludin蛋白表达情况
表2 各组小鼠的小肠组织中ZO-1和Occludin的蛋白和mRNA表达情况
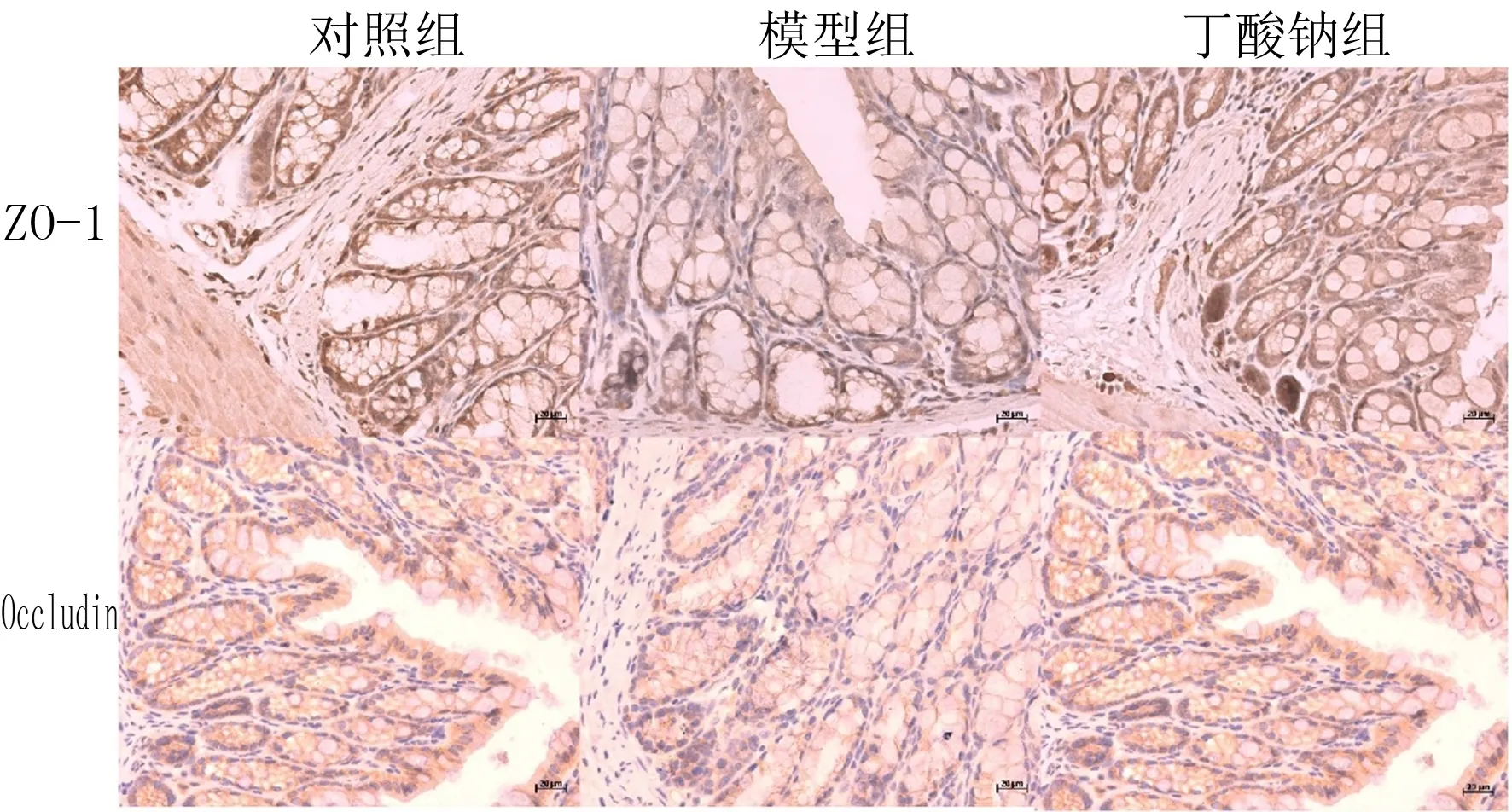
图2 各组小鼠小肠组织中ZO-1和Occludin的表达情况(免疫组织化学染色,400倍)

图3 各组小鼠小肠组织病理改变(HE染色,400倍)
2.5 各组小鼠小肠组织中TNF-α、IL-6水平比较
对照组、模型组、丁酸钠组小鼠的小肠组织当中TNF-α的水平分别为(62.40±13.33)、(190.56±53.02)、(57.40±9.88)ng/L,小肠组织当中IL-6的水平分别为(309.80±40.03)、(801.39±113.88)、(310.54±45.92)ng/L。3组小鼠小肠组织TNF-α、IL-6水平比较差异均有显著意义(F=80.15、26.29,P<0.05),其中模型组与对照组、丁酸钠组,小鼠小肠组织中2种炎症因子水平比较差异均具有显著意义(t=5.74~9.79,P<0.05)。
3 讨 论
高尿酸血症可以促进糖尿病、代谢综合征、高血压、动脉粥样硬化和慢性肾脏病等疾病的发生和发展[11]。流行病学调查显示,高尿酸血症患病率逐年上升,如爱尔兰男性高尿酸血症发病率为19.7%~25.0%,女性发病率为20.5%~24.1%[12];中国女性高尿酸血症的发病率为7.9%,男性为19.4%,高尿酸血症已经成为全球公共卫生问题[13-14]。而高尿酸血症患者是否存在肠道屏障损伤,目前还缺少明确研究报道,仅有少量研究表明高尿酸血症可能会引起肠道炎症和肠道生态失衡,从而影响肠道屏障的功能[15]。人体中的尿酸约有30%是通过肠道排泄的,肠道对尿酸的排泄发挥着重要作用,近年来尿酸的肠道排泄与肠道菌群的关系成为研究热点之一。促进尿酸的肠道排泄,可减轻高尿酸血症患者肾脏排泄负担,防止和减缓因高尿酸血症导致的慢性肾功能不全。肠道屏障由肠上皮与细胞间的紧密连接构成[16-18],ZO-1和Occludin是2种重要的紧密连接蛋白,对于维持肠道屏障的完整性发挥着重要的作用[16,19]。本研究结果显示,模型组小鼠小肠组织存在小肠绒毛断裂、稀疏和肠上皮损伤,小肠组织中ZO-1和Occludin蛋白和mRNA表达明显低于对照组小鼠,同时模型组小鼠小肠炎症因子TNF-α和IL-6水平明显高于对照组,提示高尿酸血症诱导的炎症反应可能与肠道屏障功能受损有关,高尿酸可增加肠道炎症反应及诱发肠道屏障功能损伤。
SCFAs是小肠内难以消化的碳水化合物经肠道微生物发酵的最终产物,丁酸是结肠上皮细胞的能量的底物,可促进肠道紧密连接蛋白表达,从而起到维护肠道屏障完整性的作用[20]。SCFAs可能通过促进肠上皮细胞的生长,加强肠道紧密连接,调节肠道菌群,维持肠道屏障功能发挥有益影响[20-21]。同时SCFAs对肠道微生物群具有调节和改善作用,可抑制有害菌增殖并增加有益菌的数量[22]。肠道绒毛的高度是衡量小肠结构完整性的重要指标之一。本研究显示模型组小鼠粪便中丁酸含量显著降低,给予丁酸钠干预后,丁酸钠组小鼠小肠病理损伤较模型组明显减轻,提示丁酸钠可保护小肠上皮的完整性及维护肠道屏障。有研究表明肠黏膜上皮细胞紧密连接蛋白在肠黏膜屏障完整性中发挥着至关重要的作用,当紧密连接蛋白出现表达异常,会导致肠道通透性的增强,进而导致多种疾病发生[23-24]。本研究显示丁酸钠组小鼠小肠组织中的ZO-1以及Occludin的蛋白和mRNA表达水平均明显高于模型组小鼠,免疫组化结果显示丁酸钠组小鼠小肠组织中ZO-1和Occludin的阳性染色面积和强度均高于模型组小鼠,提示丁酸钠可能通过增加肠上皮紧密连接蛋白ZO-1和Occludin的表达保护高尿酸血症引起的肠道屏障损害。
炎症因子增加可导致上皮功能及肠道屏障损伤,细胞因子及炎性介质的产生会导致肠黏膜通透性增强、免疫功能障碍以及菌群失调,引起肠屏障功能障碍[25-26]。有研究显示高尿酸血症患者的炎症细胞因子水平升高[27]。本研究结果显示,丁酸钠组小鼠小肠组织中TNF-α和IL-6水平明显低于模型组小鼠,提示炎症因子水平与肠上皮紧密连接功能障碍相关,丁酸钠可能通过抑制肠道的炎症反应来维护肠道屏障。
综上所述,通过腹腔注射氧嗪酸钾联合高酵母饲料可成功构建小鼠高尿酸血症模型,且高尿酸血症模型小鼠小肠存在肠道屏障损伤;丁酸钠灌胃治疗可以上调小鼠小肠紧密连接蛋白表达,减轻肠道炎症,从而发挥对肠道屏障的保护作用。本研究为丁酸钠治疗高尿酸血症及痛风提供了理论依据,但具体机制还有待进一步研究。
伦理批准和动物权利声明:本研究涉及的所有动物实验均已通过青岛大学附属医院实验动物福利与伦理委员会批准(文件号AH-QU-MAL20210430)。所有实验过程均遵照《实验动物管理条例》进行。
作者声明:田字彬、李宇鹍、刘欣、王荣参与了研究设计;李宇鹍、沈茜、丁雪丽参与了论文的写作和修改。所有作者均阅读并同意发表该论文。所有作者均声明不存在利益冲突。

