晚期胰腺癌患者的临床特征及预后分析
郭继红 朱 宁 葛 洋 安广宇
(首都医科大学附属北京朝阳医院肿瘤科,北京 100020)
胰腺癌恶性程度高,病死率高,发病率在全球呈上升趋势。中国2005-2015年胰腺癌的总体发病率平均每年上升2.78%,总体病死率平均每年上升2.24%[1]。胰腺癌在中国所有恶性肿瘤中发病率排第10位,病死率为第6位[2]。在美国,预估2030年胰腺癌将成为美国第2位癌症死亡原因[3]。47%的胰腺癌患者发病时为晚期,早期胰腺癌仅占13%,还有30%为局部晚期,胰腺癌总体5年生存率只有11%[4]。
目前缺乏分子和遗传生物标志物对晚期胰腺癌患者进行最佳分层并指导治疗。因此,寻找识别预测及预后的生物标志物和新的治疗手段对于改善晚期胰腺癌患者的预后同等重要。本文拟探索了解真实世界晚期胰腺癌患者临床特征和生存情况,并分析预后及疗效预测的影响因素。
1 对象和方法
1.1 研究对象
纳入2017年1月至2020年12月就诊于首都医科大学附属北京朝阳医院肿瘤科的晚期胰腺癌患者共55例。纳入标准:①病理学诊断为胰腺腺癌;②临床分期为Ⅳ期;③具备符合实体瘤疗效评价标准的可测量病灶。排除标准:①腺癌以外的其他病理类型的胰腺恶性肿瘤;②同时存在其他器官或系统的第2原发恶性肿瘤者;③失访。
1.2 研究方法
疗效及不良反应评价:治疗前进行影像学基线检查,后每6周进行1次影像学评估,包括胸、腹、盆腔电子计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging, MRI),头部CT或MRI,全身浅表淋巴结超声、骨扫描等检查。采用RECIST 1.1版标准进行近期疗效评估,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。远期疗效采用总生存期(overall survival,OS)和无进展生存期(progression free survival,PFS)进行评价。按照美国国立癌症研究院通用毒性标准4.0版评价治疗中的不良反应。
随访采用查阅病历资料、门诊复查、电话访问等方式,随访结束时间为2022年6月 31日或确认死亡时间。此研究中OS定义为胰腺癌复发或转移至死亡或末次随访的日期,PFS为开始一线治疗时间至疾病进展或死亡。
1.3 统计学方法
采用SPSS 27.0对数据进行分析。采用描述性统计学方法对患者的所有基本资料包括年龄、病理特征、治疗等进行分析。组间分类变量比较时采用χ2检验。采用Kaplan-Meier法和Log rank检验进行OS、PFS分析,采用比例风险回归模型(proportional hazards model,简称Cox)进行多因素分析。所有的统计学检验均采用双侧检验,以P≤0.05为差异有统计学意义。
2 结果
2.1 晚期胰腺癌的基本临床特征
55例晚期胰腺癌患者中位年龄63岁,最小年龄42岁,最大年龄79岁。男性34例,女性21例。39例(70.9%)患者的美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~1分,16例(29.1%)患者ECOG评分≥2分。30例(54.5%)患者肿瘤位于胰腺头颈部,25例(45.5%)患者肿瘤位于胰腺体尾部。31例(56.4%)患者合并肝转移,24例(43.6%)无肝转移。30.9%的患者糖类抗原19-9(carbohydrate antigen19-9,CA19-9)数值大于正常上限100倍。55例患者中,8例患者因全身情况差,未进行过化学药物治疗(以下简称化疗),47例(85.5%)患者进行了一线化疗,21例(38.2%)患者进行了二线化疗,10例(18.2%)患者进行了三线及以上化疗,详见表1。

表1 55例晚期胰腺癌的临床病理特点 Tab.1 Clinical pathological features of patients with metastatic pancreatic cancer n(%)
2.2 OS分析
55例患者中位随访时间为55.3个月,中位OS为7.7个月。6个月、1年、2年生存率分别为61.8%、34.0%和11.6%。单因素分析显示,未进行化疗的患者中位OS仅2.5个月,进行过一线化疗的患者中位OS为9.9个月,两组间差异有统计学意义(P<0.001),是否进行二线及三线治疗对OS影响的差异无统计学意义(P=0.151及P=0.247)。ECOG评分0~1分的患者中位OS为11.6个月,而评分2~3分的患者中位OS仅为5.1个月,两组间差异有统计学意义(P<0.001)。做过胰腺癌手术的患者中位OS为11.6个月,而未做过手术的患者中位OS为5.4个月,两组间差异有统计学意义(P=0.01)。无肝转移的患者中位OS患者中位OS为13.0个月,有肝转移的患者中位OS为4.9个月,两组间差异有统计学意义(P<0.001)。CA19-9数值对OS影响的差异有统计学意义(P=0.019),详见图1。年龄、性别、吸烟史、饮酒史、是否有合并症、体质量指数(body mass index,BMI)、有无家族史及肿瘤位置均对OS无显著影响。将有无一线治疗、ECOG评分、有无手术、有无肝转移及CA19-9数值纳入COX多因素回归分析,结果显示ECOG评分、有无手术及有无肝转移是OS的独立影响因素,详见表2。
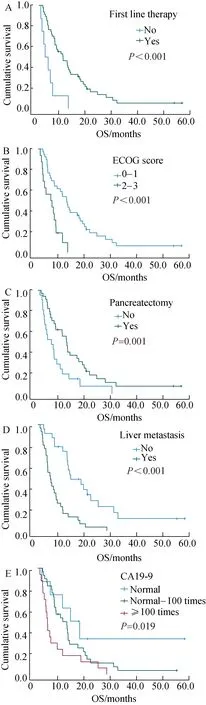
图1 OS的预后影响因素Fig.1 Prognostic factors for OS
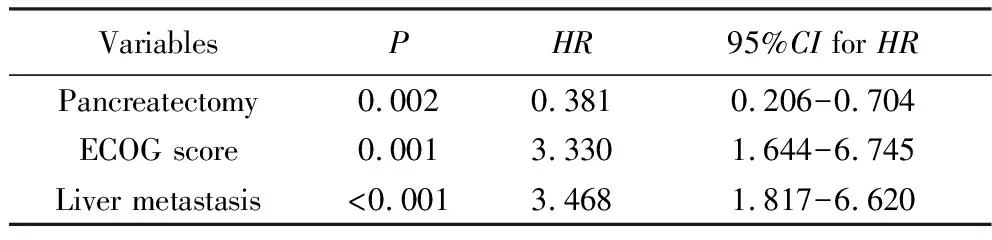
表2 影响OS的Cox分析Tab.2 Cox for OS
2.3 一线治疗疗效及预后分析
47例进行晚期一线治疗的患者中,2例采用FOLFIRINOX(5-氟尿嘧啶、亚叶酸钙、伊立替康和奥>沙利铂)化疗方案,24例采用吉西他滨为基础的化疗方案,20例采用氟尿嘧啶为基础的化疗方案,1例采用靶向药治疗。应用靶向药的1例患者为71岁老年男性,ECOG评分2分,有心脏病和糖尿病病史,基因检测提示PALB2基因突变,应用靶向药奥拉帕利治疗,最佳疗效为PR,PFS为5个月,生存期为6.2个月。采用一线治疗的患者中,1例患者达到CR,3例PR,24例SD,19例PD。中位PFS为3.7个月。单因素分析显示一线治疗PFS的影响因素有ECOG评分(P=0.021)、有无肝转移(P=0.002)、CA19-9数值(P=0.028)和疗效(P<0.001)。有无胰腺癌手术史及一线治疗方案的不同选择对PFS的影响无统计学意义(P=0.171和P=0.523)。不同化疗方案之间疗效的差异无统计学意义(P=0.720)。47例进行一线治疗的患者中,11例患者在治疗过程中出现过感染,8例为胆系感染,3例为其他部位感染,选择一线化疗方案的患者出现感染后PFS显著缩短为1.4个月,未感染的患者PFS为3.8个月(P=0.01),详见图2。将ECOG评分、有无肝转移、CA19-9数值、一线治疗疗效及有无感染纳入COX多因素回归分析,结果显示有无肝转移及一线治疗疗效是一线PFS的独立影响因素,详见表3。
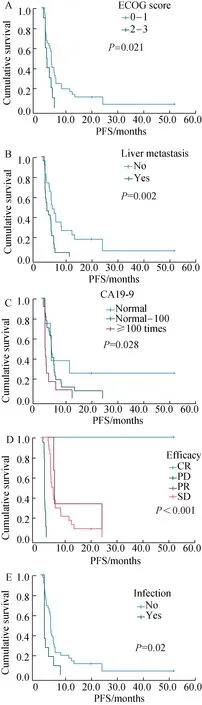
图2 一线治疗PFS的预后影响因素Fig.2 Prognostic factors for PFS in first line therapy

表3 影响一线PFS的COX分析Tab.3 Cox for PFS
2.4 不良反应
采用一线治疗的47例患者中,应用奥拉帕利的1例患者仅出现了Ⅰ级恶心、呕吐,未出现其他不适。其余46例患者,发生1级骨髓毒性9例(19.6%),发生2级骨髓毒性9例(19.6%),发生3级骨髓毒性15例(32.6%)。出现1级胃肠道反应26例(55.3),出现2级胃肠道反应5例(10.6%),出现3级胃肠道反应3例(6.4%)。5例(10.9%)患者出现肝功能异常。
3 讨论
近些年,胰腺癌发病率及病死率逐年上升,但是胰腺癌患者治疗机会少,总体预后很差[4-5]。肺癌、肝癌等恶性肿瘤靶向治疗、免疫治疗发展很快,肿瘤患者的生存也获得了突破性的进展。而胰腺癌患者仅有很少比例能获得靶向治疗及免疫治疗的机会,晚期胰腺癌一线及二线应用免疫治疗的临床试验均以失败告终[6-7],大部分患者仍以化疗为主。
许多类型的恶性肿瘤治疗状况均是一线治疗率高,而后续治疗机会显著下降。文献[8]提示,晚期胰腺癌二线治疗率为40%~50%,三线及以上治疗为13%[9]。本研究中,晚期胰腺癌的一线治疗率为85.5%,二线治疗率降至 38.2%,三线治疗率为18.2%。治疗率与文献报道基本相符。本研究提示是否进行一线化疗是总生存期的独立影响因素,未进行一线治疗的患者中位生存期仅2.5个月。因此,一线治疗至关重要。
晚期胰腺癌一线化疗方案有FOLFIRINOX、吉西他滨联合白蛋白紫杉醇方案、吉西他滨为基础的化疗方案等[10-12]。2011年PRODIGE研究[13]显示,FOLFIRINOX与吉西他滨单药方案相比,患者的中位生存期从6.8个月延长到了11.1个月。2013年MPACT研究[14]显示吉西他滨+白蛋白紫杉醇用于晚期胰腺癌一线治疗优于吉西他滨单药化疗,中位生存期从6.7个月延长到了8.5个月。Meta分析结果显示[15]只有ECOG评分好(0或1分)的患者可从联合化疗中获益,而ECOG评分差(2分)的患者不能从联合化疗中获益。
目前,基于患者疗效、安全性和生活质量等方面,缺乏将不同一线治疗方案进行正面比较的前瞻性Ⅲ期临床研究。本研究结果显示,一线治疗方案的选择对疗效、PFS及OS均无显著影响。因此,针对国内患者的真实情况,应根据患者身体状况及临床病理特征选择适合患者的最佳治疗方案,不同治疗方案之间对预后的影响差异无统计学意义。
本研究中仅有1例患者基因检测提示PALB2基因突变,因患者为71岁老年男性,合并症多,体质弱,不能耐受化疗,未选择一线含铂化疗方案,直接予以奥拉帕利靶向药进行一线治疗,达到了5.0个月的PFS,该患者疾病进展后因全身情况差没有后续化疗机会,OS为6.2个月。POLO研究[16]提示BRCA突变的晚期胰腺癌患者一线应用含铂方案化疗后,应用奥拉帕利靶向维持治疗可显著延长PFS(7.4vs3.8 个月,P=0.004),因数据不成熟,OS差异无统计学意义。基于上述研究结果,2019年12月,奥拉帕利在美国被批准应用于晚期胰腺癌,成为晚期胰腺癌第一个基于标志物的靶向药物。有研究[17]提示,针对突变靶点应用靶向药物治疗的患者比没有靶向药治疗机会的晚期胰腺癌患者,总生存期可延长1年。因胰腺癌靶向及免疫治疗机会少,至今为止,仍未常规推荐全部晚期胰腺癌患者进行二代基因测序(next generation sequencing,NGS)检查,本研究结果显示在经济、身体状况、治疗意愿等均允许的情况下建议进行NGS检测,从而有机会选择更佳治疗方案,以延长患者生存期。
本研究选择一线治疗的47例患者中,有11例发生了感染,其中8例为胆系感染,3例为其他部位感染,感染发生率为23.4%。有研究[18]揭示了感染与胰腺癌发生之间的关系,但是胰腺癌发生后感染对预后的影响,文献报道较少。本研究提示:一线治疗患者中发生感染对PFS有显著影响。胰腺及胆管等壶腹周围的手术因为解剖及手术方式的原因,导致感染的风险提高。国内有文献[19]报道胆管癌术后患者的胆系感染率达到56.6%,即使无胆系感染证据的,胆汁细菌培养阳性率也能达到41.2%。根据解剖学关系推测胰腺癌尤其是胰头颈部恶性肿瘤,胆系感染发生率较高,但目前尚无文献支持。根据本研究结果,建议临床医生要重视胰腺癌感染的发生,并进行积极预防。在实际临床工作中,笔者发现当患者第一次出现感染征象,积极的予以经皮肝胆管引流术等临床干预手段,可以减少后续感染的机会,进一步延长患者生存期。因此,发现感染及预防感染也将是我们以后工作中不能忽视的重点。
本研究为单中心的回顾性研究,可能存在一定的偏倚。但仍然真实反映了晚期胰腺癌患者一线、二线、三线治疗率、疗效、疾病进展、生存情况及预后影响因素。本研究结果提示临床医生在诊治患者过程中,可以根据患者的临床病理特征初步判断患者的预后情况,制定更加个体化的诊疗方案。此外,建议患者完善NGS检查,如结果提示有靶向及免疫治疗的机会,可以更好地延长晚期胰腺癌患者生存期。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明郭继红:提出研究思路,设计研究方案,采集病历,统计分析,撰写论文;朱宁:采集病历;葛洋:提供研究思路; 安广宇:审定论文,总体把关。

