高脂血症患者SLCO1B1和APOE基因多态性与血脂水平的相关性
赵雪杰,李晓娜,张璐,荆浩,种丽莉,吕毅(河南大学附属郑州颐和医院检验医学中心,郑州 450018)
他汀类药物作为主要的调脂类及心脑血管疾病预防的药物,已被临床上广泛应用,但其对患者的降脂效果和不良反应存在较大的个体差异,部分人群会出现肌肉毒性,严重者出现横纹肌溶解症,这种差异的部分原因可能与遗传因素相关[1]。他汀类药物是羟甲基戊二酰辅酶A还原酶抑制剂,其分子作用机制是通过阻断细胞内羟甲戊酸的代谢途径,减少血清和细胞内的胆固醇的合成,从而使低密度脂蛋白(LDL)和极低密度脂蛋白(VLDL)的合成下降[2]。SLCO1B1的突变基因型会导致编码的有机阴离子转运多肽1B1(OATP1B1)转运蛋白活性减弱,造成肝脏摄取药物的能力下降,引起体内他汀类的血药浓度上升,从而增加了横纹肌溶解症或肌病发生的风险[3]。载脂蛋白E(APOE)通过多种途径参与机体的脂代谢过程,是影响机体血脂水平主要的内在因素,APOE基因多态性被认为是高脂蛋白血症、心脑血管疾病、老年痴呆症和动脉粥样硬化等疾病的易感候选基因。研究表明,APOE2、APOE3和APOE4 载脂蛋白对不同的脂质颗粒存在偏好性结合,其中APOE2和APOE3倾向于结合小颗粒脂蛋白(HDL),而APOE4倾向于结合大颗粒脂蛋白(VLDL和LDL),从而造成不同基因型携带者的血脂水平存在一定的差异[4]。
为探讨SLCO1B1和APOE基因多态性在脂代谢异常患者中的表型情况,本研究拟选择154例脂代谢异常患者作为研究对象,113例健康志愿者作为健康人对照组,采用PCR-荧光探针技术检测各组人群的SLCO1B1和APOE基因型,分析基因频率分布特征并比较不同基因型组间各项血脂水平的差异,以及探讨SLCO1B1和APOE基因型与各项血脂水平的相关性,以期达到指导临床合理应用他汀类药物的目的。
1 资料与方法
1.1研究对象 选取2019年1月至2021年12月郑州颐和医院收治的154例脂代谢异常患者作为疾病组,其中男71例,女83例,年龄(49.2±13.4)岁。纳入与排除标准: (1)满足三酰甘油(TG)≥1.70 mmol/L、总胆固醇(TC)≥5.72 mmol/L、低密度脂蛋白胆固醇(LDL-C)≥3.40 mmol/L和高密度脂蛋白胆固醇(HDL-C)≤1.00 mmol/L中的任意一项;(2)排除甲状腺、糖尿病、冠心病及肝肾功能不全等疾病的病例;(3)排除正在服用他汀类以及其他降脂药物治疗的患者。同期选取体检健康者113例作为健康人对照组,其中男51例,女62例,年龄(48.4±11.8)岁。所有纳入的研究对象均为郑州市籍贯汉族人群,本研究通过郑州颐和医院医学伦理委员会审核批准,免除患者知情同意。
1.2仪器和试剂 AU5821型生化自动分析仪及配套的TC、TG、LDL-C和HDL-C试剂盒(贝克曼库尔特公司),SLANP-96全自动医用PCR分析系统(上海宏石医疗科技公司),Biospin全血基因组DNA提取试剂盒(杭州博日科技公司,浙杭械备20150184),人类SLCO1B1和APOE基因多态性检测试剂盒(武汉友芝友医疗科技公司)。
1.3SLCO1B1和APOE基因多态性检测
1.3.1基因组DNA提取 采用乙二胺四乙酸二钾(EDTA-K2)抗凝管采集受检者晨起空腹静脉血2~3 mL,使用Biospin全血基因组DNA提取试剂盒提取基因组DNA,操作严格按试剂盒说明书进行。
1.3.2PCR扩增 PCR扩增反应体系按照人类SLCO1B1和APOE基因多态性检测试剂盒说明书操作。根据SLCO1B1和APOE基因各SNP位点的不同多态性设计了4套特异性引物和探针组合,在1个反应体系中通过两种不同通道检测1个位点的基因多态性。荧光信号采集通道:(1)SLCO1B1*1b 388A、SLCO1B1*5 521T、APOE2526C和APOE4388T通过FAM通道采集荧光信号;(2)SLCO1B1*1b 388G、SLCO1B1*5 521C、APOE2 526T和APOE4 388C通过VIC通道采集荧光信号;(3)内标基因通过ROX通道采集荧光信号。PCR反应条件: (1)UNG处理,37 ℃ 10 min;(2)预变性95 ℃ 5 min;(3) 95 ℃ 15 s,共40个循环。
1.4血脂测定 采集受检者清晨空腹静脉血3~5 mL于促凝管中,1 500 r/min离心5 min,分离血清,采用AU5821型生化自动分析仪及其配套试剂检测TC、TG、LDL-C和HDL-C等血脂水平指标。 TC参考区间:2.85~5.70 mmol/L,TG参考区间:0.00~1.70 mmol/L,LDL-C参考区间:2.07~3.37 mmol/L,HDL-C参考区间:1.00~2.10 mmol/L。

2 结果
2.1SLCO1B1等位基因表型和等位基因频率分布情况 疾病组和健康人对照组SLC01B1基因正常代谢型基因型均占比最高,分别为79.87%和85.84%,中间代谢型次之,分别为16.23%和13.27%,弱代谢型占比最低,分别为3.90%和0.88%。各基因表型频率组间比较差异均无统计学意义(P>0.05)。其中疾病组各单体型频率分布以*1b占比最高,为64.29%,*1a与*15分别为23.71%和11.70%,*5为0.31%。见表1。
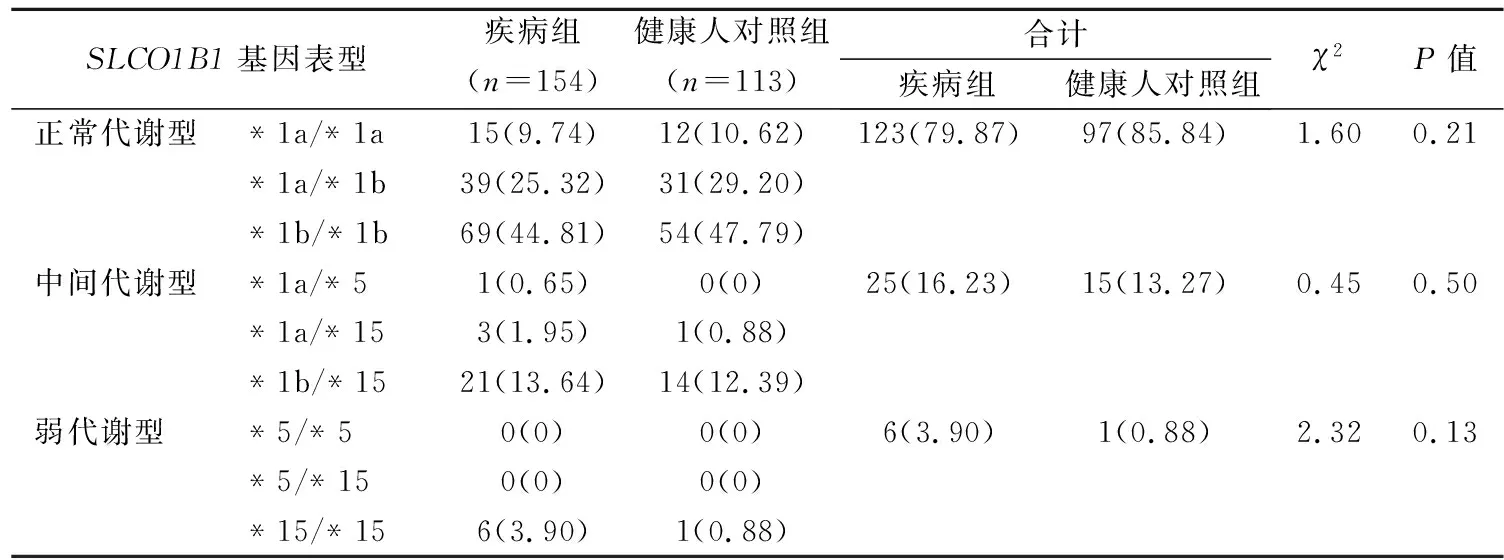
表1 疾病组与健康人对照组SLCO1B1基因多态性分布比较[n(%)]
2.2APOE等位基因表型和等位基因频率分布情况 疾病组和健康人对照组APOE基因表型E3占比均为最高,分别为66.88%和78.76%;疾病组E3基因表型明显低于健康人对照组,疾病组E4基因表型明显高于健康人对照组,差异均具有统计学意义(P<0.05)。疾病组APOE基因各等位基因频率分布以E3型占比最高,为76.62%,E2型占12.01%,E4型占11.37%。见表2。
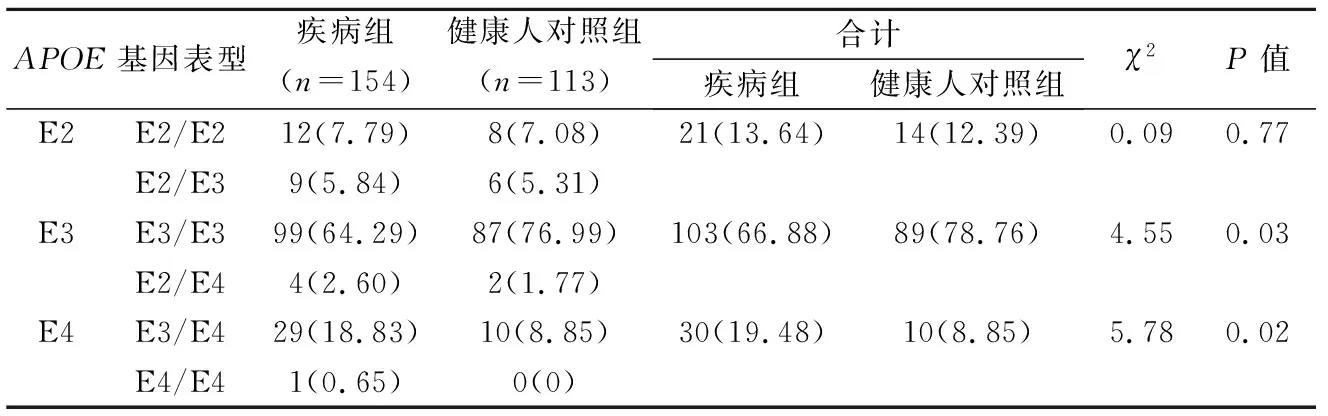
表2 疾病组与健康人对照组APOE基因多态性分布比较[n(%)]
2.3SLCO1B1和APOE基因各表型间血脂水平比较 高脂血症患者的SLCO1B1基因表型正常代谢型组TG、TC和HDL-C的浓度均高于其余两组基因表型,LDL-C浓度低于其余两组基因表型;SLCO1B1基因各表型间的TG、TC、LDL-C、HDL-C水平比较差异无统计学意义(P>0.05)。高脂血症患者APOE基因表型E4组TC水平显著高于E2组和E3组,差异具有统计学意义(P<0.05);E2、E3和E4组TG、LDL-C和HDL-C水平比较差异均无统计学意义(P>0.05)。见表3。
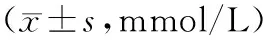
表3 SLCO1B1和APOE基因各表型与血脂的关系
3 讨论
近年来,随着分子生物学的发展,药物治疗处于传统经验用药向个性化用药转变的阶段。他汀类降脂药物为临床上首选,可快速降低TC及LDL-C水平,还可降低TG水平并使HDL-C水平升高,是一种较为全面的降脂药物[5]。根据基因检测结果对患者实施个体化用药治疗,能够有效提高药物的临床效果,并降低不良反应的发生,以实现精准医疗。
本研究选择了154例脂代谢异常患者和113例健康志愿者,并对其进行SLCO1B1和APOE基因表型的检测,结果发现脂代谢异常患者和健康人对照组的SLCO1B1基因均以*1a/*1a、*1a/*1b及*1b/*1b正常代谢基因型为主,APOE基因主要以E3/E3和E2/E4表型为主,疾病组E3基因表型明显低于健康人对照组,疾病组E4基因表型明显高于健康人对照组,差异均具有统计学意义(P<0.05)。而E4基因表型属于脑梗死、冠心病及老年痴呆发病风险较高的类型,临床需要重点关注此类患者,同时需密切监测可能出现的药物不良反应。本研究结果表明,SLCO1B1基因各表型与TG、TC、LDL-C、HDL-C等血脂水平比较差异无统计学意义;APOE基因各表型除TC水平存在明显差异外(P<0.05),其余基因表型与TG、LDL-C、HDL-C等血脂水平比较差异无统计学意义。研究显示[6-7],SLCO1B1在人群中以4号外显子的388A>G位点和5号外显子521T>C位点突变率最高,其中521T>C突变位点与他汀类药物的疗效有一定的相关性,521T>C突变导致的OATP1B1转运蛋白活性降低已被公认,并证实与其严重不良反应肌病相关,但388A>G突变对他汀类药物影响尚未明确,还需进一步研究。另有研究表明[8],APOE基因编码的蛋白质为血浆蛋白,能与LDL受体和VLDL受体结合,参与脂质代谢及胆固醇、TG的转运。APOE基因E4表型携带者发生老年性痴呆、动脑粥样硬化、冠心病、脑梗死等疾病的风险增高,且临床上他汀类药物降脂效果差,E3/E4杂合基因型提示存在风险,而E4/E4纯合基因型则提示高危风险,对此类高血脂患者应使用小剂量他汀类药物联合其他降脂药物才能达到更好的降脂效果[9-10]。
综上所述,SLCO1B1基因频率分布存在种族、地域差异性,高脂血症患者的SLCO1B1基因多态性与血脂水平不相关,而APOE基因多态性与各项血脂水平有一定的相关性趋势;检测SLCO1B1和APOE基因分型可提示高脂血症患者使用他汀类药物降脂的合理用药剂量,以降低药物不良反应发生的风险。对考虑使用他汀类药物进行治疗的脂代谢异常患者进行SLCO1B1和APOE基因多态性检测,可实现个体化用药和安全用药指导。
本研究的不足之处在于收集的血脂异常患者例数较少,结果可能存在偶然性;此外,部分研究对象血脂存在明显异常的数据,并不能完全排除饮食干扰,这一部分的血脂数据会对SLCO1B1和APOE基因血脂水平相关性的结果造成影响;第三,本研究中纳入的154例患者中有很多人并无明显临床症状,病因尚不明确,目前尚不能对其病因进行分组,后续笔者会继续追踪,进而完善研究内容。

