通过冠状动脉造影微循环阻力指数预测急性心肌梗死患者1年的心脏功能
王芳 陶凌 张剑桥 高超 刘建正 杨旺伟 牟方俊 张亮 王欢 张亚敏 郭春棉 杨华 贺媛
快速恢复冠状动脉心肌梗死溶栓治疗试验(thrombolysis in myocardial inf arction,T I M I)血流分级Ⅲ级是ST 段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)治疗的根本目的,可以挽救心肌细胞、提高心肌存活率并限制心肌梗死面积,改善STEMI患者的长期预后[1]。研究显示,直接经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)可以使95%的心外膜血管快速恢复血流[2],但仍有40%的患者出现心肌再灌注不足[3],这可能与STEMI患者冠状动脉微血管功能障碍(coronary microvascular dysfunction,CMD)或微循环功能损伤有关[4-6]。CMD导致心肌细胞不能有效地恢复功能性供血,致使STEMI患者梗死面积扩大,死亡率及心力衰竭再住院率增加约2倍[7-8]。因此,CMD是急性心肌梗死后左心室功能不良[9-10]和长期预后不佳的决定因素,及时发现并有效治疗CMD是改善STEMI患者长期预后的关键因素。
临床上通过心脏磁共振成像(cardiac magnetic resonance,CMR)或微循环阻力指数(index of microcirculatory resistance,IMR)来评估CMD,是无创或有创检测CMD的金标准[11-13]。但是由于安全性问题CMR需要在STEMI发病2 d后进行,限制了CMR在STEMI初期的临床应用[14]。而IMR检测时需要腺苷使心肌处于最大充血状态,通过压力导丝获得微循环阻力的数值,耗时较长且昂贵[15]。除此之外,腺苷可能会使患者出现胸闷、气短以及低血压、心律失常等症状。因此,IMR在STEMI患者行直接PCI期间的使用受到了一定的限制。冠状动脉造影微循环阻力指数(coronary angiography-derived index of microcirculatory resistance,caIMR)是一种不需要压力导丝介导的非侵入性评估冠状动脉微血管功能的方法,基于主动脉压力波及两个不同角度投照的冠状动脉造影影像,利用流体力学公式计算出冠状动脉微循环阻力的生理参数。研究证实,caIMR在冠心病患者微循环功能测量中与传统IMR具有很好的相关性,在STEMI患者中采用截断值>40 U作为诊断CMD的标准[16]。因此,本研究通过以caIMR评估TARGET STEMI OCT China研究[17]中纳入的STEMI患者直接PCI术后即刻与6个月随访时的冠状动脉微循环功能,来评估微循环功能的变化是否对STEMI患者术后1年的心脏功能具有预测价值。
1 对象与方法
1.1 研究对象
TARGET STEMI OCT China研究[17]是一项前瞻性、多中心、随机对照、非劣效性研究,纳入该研究中症状发作12 h内的STEMI患者44例,6个月后通过光学相干断层成像(optical coherence tomography,OCT)来评估支架新生内膜厚度。纳入标准:可以测量caIMR;靶血管对比剂充盈良好;靶血管满足2个不同体位的投照,且2个体位的角度≥30°。排除标准:单体位造影投照或2个体位的角度<30°;靶病变近端或远端存在心肌桥;靶病变距离主动脉开口≤3 mm;对比剂不清晰、严重血管重叠、重度血管迂曲或者对比剂图像质量不清晰导致FLASH软件对血管轮廓测量不准确;靶血管未完整地展示在视野内;造影期间床位移动。最终本研究纳入符合标准的STEMI患者30例。本研究已通过伦理委员会审查,患者及家属均签署知情同意书。
1.2 研究方法
1.2.1 试验流程 所有纳入本研究的患者完成直接PCI后,通过FlashAngio软件(苏州润迈德)测量术后即刻的caIMR值(caIMR0)。术后6个月冠状动脉造影随访后再次测量caIMR值(caIMR6)。通过caIMR6与caIMR0的差值△caIMR评估STEMI患者微循环功能的变化对术后1年心脏功能的预测。
1.2.2 caIMR的测量方法 caIMR是基于主动脉压力波及X线下冠状动脉造影图像的全自动caIMR计算方法获得,计算公式如下[18]:L为一个常量,模拟血流从设定的入口到远端位置的长度(如L=75,指在冠状动脉树入口下游的75 mm处);(Pd)hyp代表最大充血时远端位置的平均压力(单位:mmHg;1 mmHg=0.133 kPa);Vdiastole指舒张期远端的平均流速(单位:mm/s);K是常量(K=2.1);Vhyp=K.Vdiastole,是指最大充血时远端位置的平均流速(单位:mm/s)。此处的caIMR代表了L位置远端的心肌单位体积的微血管阻力。具体操作如下:(1)至少需要2个不同角度的冠状动脉血管造影投照,避免血管重叠,2个体位需要间隔≥30°,且在造影过程中没有体位的移动;(2)X线下TIMI帧数为每秒15或30帧;(3)提取冠状动脉造影图像:将DICOM格式的冠状动脉造影序列号导入FlashAngio测量软件中,选取2个不同体位的图像,并充分展开靶病变,通过X线下冠状动脉造影不同TIMI帧数,去除动静态噪声,提高靶病变部位图像对比度;(4)记录主动脉内的压力,输入平均动脉压到FlashAngio操控台;(5)选定测量的靶血管,沿着血管路径从入口到最远端的位置,三维网状重建冠状动脉;(6)通过CFD(流体力学)公式来计算最大充血时远端位置的平均压力(Pd)hyp;(7)舒张期血流速度(Vdiastole)由FlashAngio软件自动计算,获得caIMR值。
1.2.3 TIMI血流分级与血栓分级 TIMI血流分级:0级,无灌注,即在闭塞部位及远端无前向血流;Ⅰ级,微灌注,对比剂通过闭塞部位,但不能使远端冠状动脉充分显影;Ⅱ级,部分灌注,经过3个心动周期后,前向对比剂才使冠状动脉完全显影;Ⅲ级,完全灌注,前向对比剂在3个心动周期内使冠状动脉完全显影。根据冠状动脉造影将血栓分为6级[19]:0级,造影影像中没有血栓特征性变化,没有血栓;Ⅰ级,可能存在血栓,造影下对比剂的密度降低、病变轮廓不规则、显影不清晰,或闭塞处可见“半月板”型光滑凸出,提示可能存在血栓,但不能明确诊断为血栓;Ⅱ级,造影下存在明确的血栓影,最大血栓≤1/2血管直径;Ⅲ级,造影下有明确的血栓影存在,最大的线性影像>1/2血管直径,但是<2倍血管直径;Ⅳ级,造影下存在明确的血栓影,最大的血栓影像≥2倍的血管直径;Ⅴ级,完全闭塞。
1.3 统计学分析
采用SPSS 25.0软件对数据进行统计分析处理。正态连续资料以均数±标准差表示,组间比较采用t检验;非正态资料以中位数(四分位数间距)表示,组间比较采用Wilcoxon秩和检验。分类变量以频数(百分比)表示,组间比较采用χ2检验或Fisher精确概率法检验。采用线性回归分析caIMR与直接PCI术后1年心脏功能的关系。采用协方差分析caIMR6的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 患者基线特征
入组患者基线资料见表1。受试者以中年男性患者为主(93.3%),靶血管以左前降支(43.3%)及右冠状动脉(43.3%)为主。术后所有靶血管血流均达到TIMI血流分级Ⅲ级,无手术并发症发生,手术成功率为100%。

表1 30 例患者基线资料Table 1 Baseline patient characteristics
2.2 患者caIMR值的变化
30例患者caIMR0(41.70±12.22)U,caIMR6(28.74±10.05)U,△caIMR(-12.96±13.08)U。
2.3 患者左心室射血分数(left ventricular ejection fraction,LVEF)的变化
30例患者直接PCI术后即刻LVEF(54.13±6.74)%,术后6个月随访LVEF(55.37±5.44)%,术后1年随访LVEF(56.76±5.59)%。术后1年LVEF与直接PCI术后即刻LVEF的差值为(2.53±5.67)%。
2.4 △caIMR对STEMI患者直接PCI术后1年心脏功能的预测
纳入30例患者的caIMR0、caIMR6和△caIMR,与患者术后1年的LVEF进行线性回归分析。结果显示,所有纳入的STEMI患者 △caIMR与术后1年的LVEF呈负相关(P=0.023,r=-0.414;图1~2)。

图1 30 例患者直接PCI 术后即刻与6 个月随访时caIMR 及1 年随访时LVEF 的变化Figure 1 Changes of caIMR and LVEF immediately after primary PCI and at 6-month follow-up
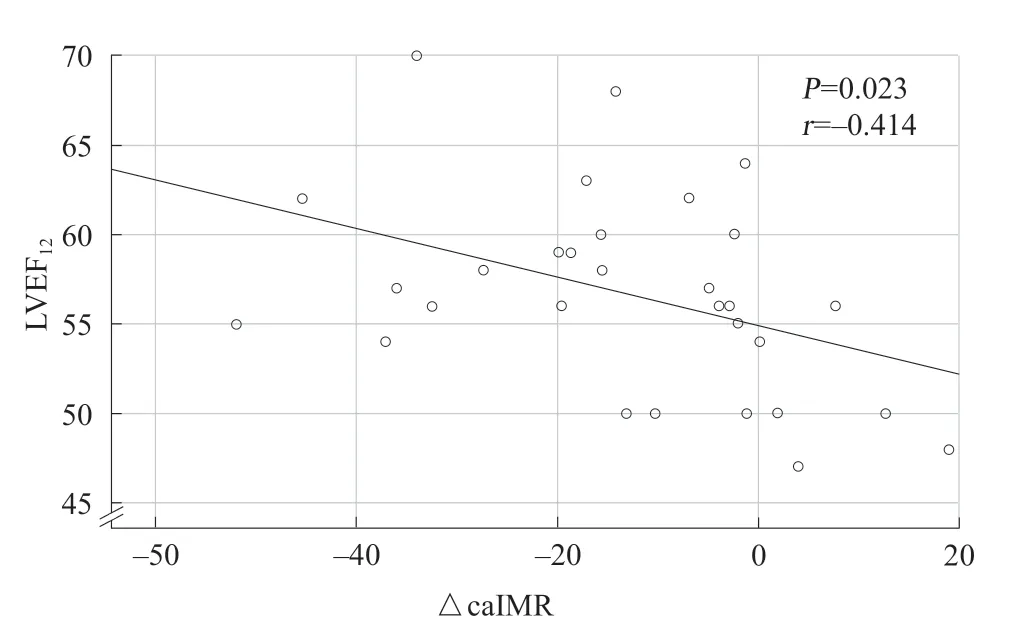
图2 30 例患者△caIMR 与术后1 年LVEF 的相关性分析Figure 2 Correlation analysis between △caIMR and 1 year LVEF
模型公式:LVEF12= -0.12△caIMR+0.47LVEF0+29.61。LVEF12为患者术后1年随访时的LVEF,LVEF0为直接PCI时的LVEF。模型总体检验F=12.09,P<0.001,模型有统计学意义。
2.5 caIMR6的相关性分析
纳入糖尿病、高血压病、高脂血症、正在吸烟、后扩张压力、靶病变血管、血栓分级、新生内膜厚度等参数。在校正了基线caIMR的情况下,与caIMR6进行协方差分析,结果发现校正基线caIMR后,靶病变血管为左前降支(left anterior descending,LAD)时的caIMR6较右冠状动脉(right coronary artery,RCA)更高,差异有统计学意义(β=10.18,P=0.016)。另外,新生内膜厚度每增厚1 µm,caIMR6增加0.11(β=0.11,P=0.039)。上述数据提示靶病变血管为LAD、新生内膜厚度与caIMR6成正相关(表2)。

表2 直接PCI 术后6 个月caIMR 的相关性分析Table 2 Correlation analysis of caIMR at 6 months after primary PCI
3 讨论
本研究通过△caIMR来预测STEMI患者的长期预后,长期预后设定为1年的心脏功能变化。既往有文献通过直接PCI术后即刻冠脉微循环功能来预测长期预后[19],故此,本研究设计具有合理性,并且具有一定的临床意义。
本研究得出的结论有:(1)S T E M I 患者△caIMR对术后1年的LVEF具有预测价值,二者呈负相关,△caIMR越小,术后1年的LVEF恢复越好;(2)caIMR6的相关性分析发现,靶血管病变为LAD、新生内膜厚度与caIMR6呈正相关。以上数据提示,随访时患者的冠状动脉微血管功能恢复越好,可能预示着患者远期的心脏功能恢复越好。
本研究中,梗死相关血管的c a I M R0为(41.70±12.22)U,caIMR6降为(28.74±10.05)U,说明STEMI导致心肌微循环功能障碍,但及时有效的再灌注可以改善6个月的心肌微循环功能。同时,线性回归分析发现△caIMR与术后1年的LVEF呈负相关,该结果提示冠状动脉微循环功能恢复有助于患者长期心功能的改善。既往研究认为STEMI患者CMD会在心肌梗死后的3~6 d内恢复[21-22],且直接PCI术后微循环的尽早恢复与6个月的LVEF提高及心肌挽救相关[23]。但因本研究未在直接PCI术后7 d内进行冠状动脉微循环功能检测,因此,STEMI患者冠状动脉微循环功能恢复的具体时间节点不明确,未来需要在直接PCI术后7 d内进行caIMR检测,明确微循环功能的恢复时间,并进行心功能预测的相关性研究。
本研究中,靶病变血管为LAD与caIMR6值呈正相关,这可能与LAD的解剖及供血范围相关。根据美国心脏协会心脏断层成像的心肌分割与命名标准[24],将心肌分为17个节段,LAD供血的节段包括第1、2、7、8、13、14及17节段,左回旋支(left circumflex artery,LCX)的供血节段包括5、6、11、12及16节段,RCA的供血节段包括3、4、9、10及15节段,LAD的供血范围约占整个心脏的50%。因此,当LAD发生心肌梗死时,更广泛的心肌及微循环受累。既往一项动物实验显示,当LAD发生心肌梗死时,其微循环障碍会延伸到周围区域,梗死动脉供血区域及周围未梗死区域均会出现微循环功能障碍[25],使心脏功能严重受损。在本研究中,靶病变血管为LAD的患者较LCX及RCA的caIMR6增高,可能与LAD供血面积大,影响到周围未梗死区域的微循环相关。但是,因本研究未行心肌的CMR或正电子发射计算机断层扫描(psitron emission computed tomography,PET)检查,未梗死区域的微循环功能未进行caIMR检测,因此无法确定此结论。未来需要更大样本量的研究,通过IMR或caIMR结合CMR及PET进一步明确LAD 的caIMR较高的机制。
综上所述,S T E M I 患者直接P C I 术后△caIMR对术后1年的LVEF有一定的预测价值。研究结果提示,在未来的临床工作中,STEMI患者行直接PCI术后应该常规进行caIMR检测,评价冠状动脉微循环功能,并及时给予干预,以预防STEMI患者心功能下降,改善长期预后。相关性分析显示,对于梗死相关血管为LAD的患者,冠状动脉微循环功能的恢复对长期预后可能更重要。
利益冲突所有作者均声明不存在利益冲突

