经导管主动脉瓣置换术后发生瓣周漏患者的临床特征及危险因素分析
陈思毅 刘健迪 刘航宇 魏海霞 李垚 张诗渊 龚韧 吴延庆
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)的适应证已经扩大到外科手术风险低危的重度主动脉瓣狭窄(aortic stenosis,AS)治疗[1-2],并逐渐成为外科主动脉瓣置换术(surgical aortic valve replacement,SAVR)的替代方案。尽管随着瓣膜设计和临床操作的发展,TAVR术后疗效有所改善,但瓣周漏(perivalvular leakage,PVL)仍是术后最常见的并发症之一,其发生率高于SAVR术后PVL[3]。在长期随访中,中度以上的PVL与全因死亡率增加有关[4-7]。
基于西方人群的经验,TAVR术后发生PVL的一些危险因素被确定,例如瓣环直径过大、主动脉瓣严重钙化、瓣膜置入过深等[8-10]。然而,中国人群的瓣膜病特征存在明显差异,如二叶式主动脉瓣(bicuspid aortic valve,BAV)比例较高、主动脉根部钙化更严重[11-12]。此外,在我国自膨胀式瓣膜(简称“自膨瓣”)使用较广泛,其中的代表产品为Venus-A(杭州启明医疗器械)、VitaFlow(上海微创心通)瓣膜。与球囊扩张式瓣膜(简称“球扩瓣”)相比,由于人工瓣膜设计的不同,自膨瓣置入术后更易出现PVL[13]。然而,目前还没有较为全面的研究报道TAVR术后出现PVL的风险因素。因此,本研究旨在探讨自膨瓣置入术后发生中度以上PVL患者的临床特征和危险因素,总结预测PVL风险的单中心经验。
1 对象与方法
1.1 研究对象
本研究为单中心回顾性研究,纳入2018年1月至2022年11月在南昌大学第二附属医院心血管内科接受TAVR治疗的113例重度AS患者。其中,3例SAPIEN 3(爱德华,美国)球扩瓣置入者,3例CT资料缺失者。因此,最终纳入了107例患者。所有入选患者均在TAVR术前完善了多排计算机断层扫描(multislices computed tomography,MSCT)和经胸超声心动图(transthoracic echocardiography,TTE)检查,以评估人工瓣膜尺寸、手术路径及术前心功能,并计算了美国胸外科医师学会(Society of Thoracic Surgeons,STS)手术风险评分。本研究遵守《赫尔辛基宣言》中的伦理准则,已通过伦理委员会审查(2022研第07),患者及家属均签署知情同意书。
1.2 研究方法
1.2.1 超声心动图参数测量 经胸超声心动图于胸骨旁左心室流出道长轴切面测量以下参数:左心房内径(left atrium diameter,LAD),室间隔厚度(interventricular septal thickness,IVST),左心室后壁厚度(posterior wall thickness,PWT),左心室舒张末期内径(left ventricular end diastolic dimension,LVEDd),左心室收缩末期内径(left ventricular end systolic dimension,LVESD),左心室射血分数(left ventricular ejection fraction,LVEF)。同时计算相对室壁厚度(relative wall thickness,RWT)=PWT×2/LVEDd。左心室质量(left ventricle mass,LVM)=0.8 ×1.04×[(IVST+LVEDd+PWT)3-LVEDd3]+0.6 g,以及左心室质量指数(left ventricle mass index,LVMI)=LVM/体表面积(body surface area,BSA)。
1.2.2 MSCT参数测量 术前常规行冠状动脉CT血管造影(CT angiography,CTA)和胸腹主动脉CTA评估。心脏团队使用3mensio Structural Heart软件分析主动脉根部及胸腹主动脉影像。测定瓣环长短径、周长,升主动脉及左心室流出道平均径。测量主动脉成角。根据Blanke等[14]所描述的方法,利用软件算法测量主动脉瓣钙化体积。按Sievers分型标准[15]鉴定瓣叶类型。计算瓣环椭圆率=(1-瓣环短径/瓣环长径)×100%。人工瓣膜的Oversize率=(人工瓣膜直径/CT所得瓣环直径-1)×100%。
1.2.3 TAVR手术过程 所有患者均在心内科导管室诱导麻醉后气管插管,使用经食管超声心动图(transesophageal echocardiograph,TEE)进行监测,在没有严重外周动脉疾病的情况下,首选经股动脉路径进行瓣膜置入,有7例患者选择经腋动脉或颈动脉路径作为替代方式。瓣膜型号的选择由心脏瓣膜介入团队根据术中球囊预扩张形态和反流程度来决定。所有置入的瓣膜都是Venus-A自膨瓣。瓣膜置入前后,用猪尾导管分别测量左心室与升主动脉压力。瓣膜置入后,立即进行TEE及主动脉根部血管造影,以评估PVL程度,操作者根据PVL程度、跨瓣压差、瓣膜形态、冠状动脉开口高度,决定是否需要球囊后扩张或置入第二个瓣膜(瓣中瓣)。
1.2.4 PVL的评估及分组 人工瓣膜置入后,使用TEE对PVL进行半定量分级,并根据国际瓣膜学术研究联盟(Valve Academic Research Consortium,VARC)2021年发布的VARC-3标准进行分级[16],通过评估其反流束长度与主动脉瓣环周长的比值来确定PVL 的程度,并分为4个等级:无/微量(1/4)、<10%为轻度(2/4)、10%~30%为中度(3/4)、≥30%为重度(4/4)。根据研究目的,将患者分为两组:PVL<3/4组与PVL≥3/4组。严重PVL定义为中度以上的PVL。
1.3 统计学分析
所有数据均采用SPSS 26.0软件进行统计分析。计量资料以(±s)表示,计数资料用[例(%)]表示。计量资料采用独立样本t检验或Mann-WhitneyU检验比较两组差异,计数资料使用χ2检验或Fisher确切概率法进行比较。采用多因素Logistic回归分析,纳入单因素Logistic分析中P<0.10的变量,以确定中度以上PVL的独立危险因素。使用受试者工作特征(receiver operating characteristic,ROC)曲线评估各危险因素对PVL的预测价值,并计算ROC曲线下面积(area under c u r ve,A UC)。所有结果均采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的基线特征及手术情况比较
本研究共纳入107例患者,平均年龄(71.7±7.0)岁,其中男63例(58.9%)。STS评分(16.31±11.85)%。纽约心脏病协会(New York Heart Assdciation,NYHA)心功能分级Ⅰ~Ⅱ级11例(10.3%),Ⅲ级71例(66.4%),Ⅳ级25例(23.4%)。置入的第1枚瓣膜直径≤26 mm者76例(71.0%),直径>26 mm者31例(29.0%)。植入永久起搏器9例(8.4%)。术后院内死亡3例(2.8%),死亡原因:心脏穿孔造成心脏压塞。
PVL≥3/4组的37例患者中,共23例患者在首枚瓣膜置入后出现重度PVL,经心脏瓣膜团队评估后决定采用瓣中瓣方案,即以首枚瓣膜为锚定位置入第2枚瓣膜,其中20例的PVL水平下降至轻度或无,2例仍为中度PVL,1例因冠状动脉阻塞高风险转外科行开胸手术;剩下的14例患者经球囊后扩张,只有2例仍为中度PVL。故最终术后PVL<3/4者102例(95.3%),中度PVL 4例(3.7%)。PVL≥3/4组男性患者比例高于PVL<3/4组患者(P=0.031)。但两组患者的其他基线特征或手术指标比较,差异均无统计学意义(均P>0.05,表1)。
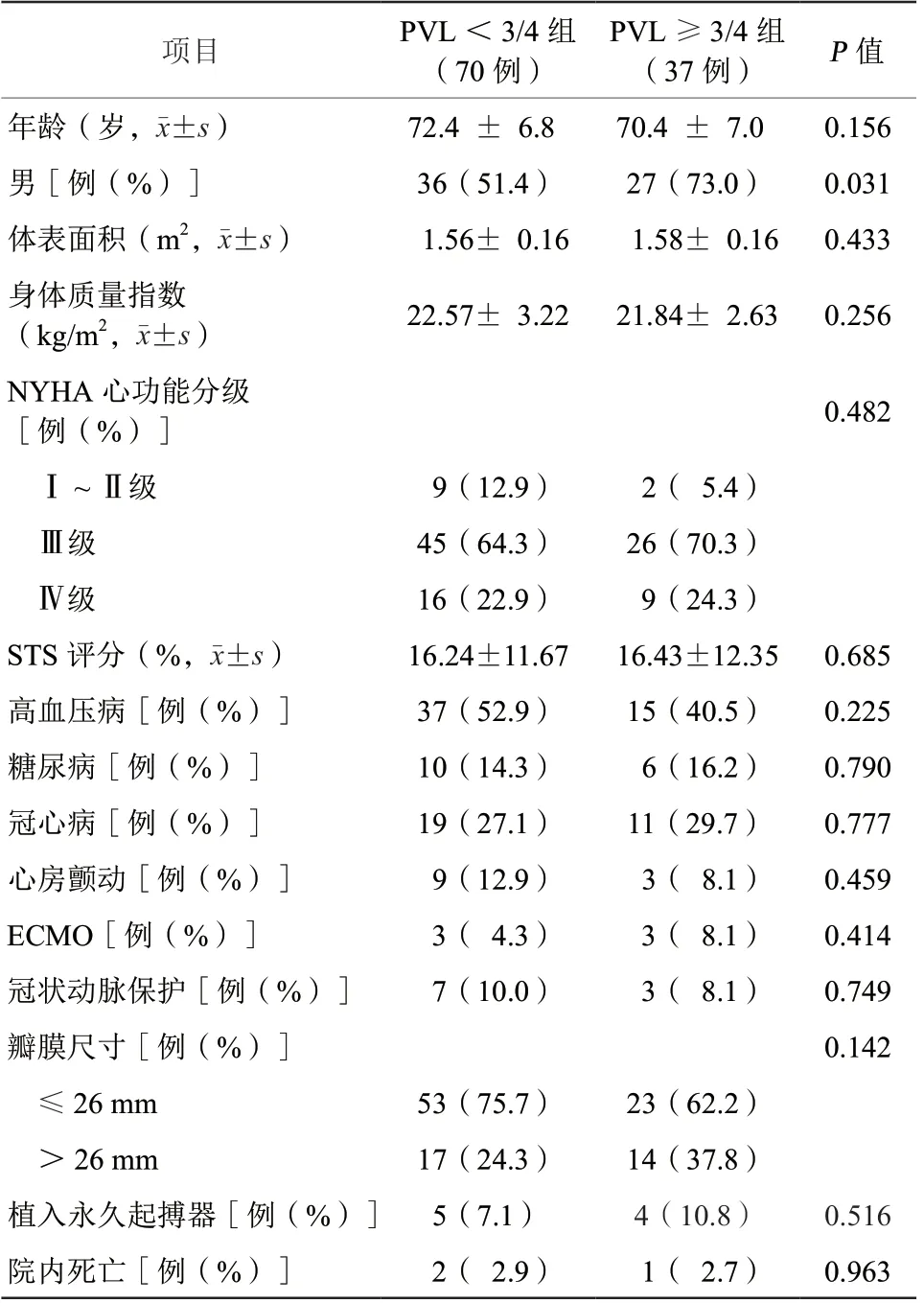
表1 两组患者基线资料及手术前后情况比较Table 1 Comparison of baseline data and pre- and post-operative conditions between the two groups
2.2 两组患者术前超声心动图结果比较
PVL≥3/4组患者LVEDd[(54.5±9.6)mm比(4 9.8±8.2)m m,P=0.0 1 7]、L V E S d[(40.1±10.5)mm比(35.4±9.0)mm,P=0.018]均显著大于PVL<3/4组患者,而RWT[(0.43±0.09)比(0.49±0.11),P=0.007]显著小于PVL<3/4组患者,差异均有统计学意义。两组患者其他超声心动图指标比较,差异均无统计学意义(均P>0.05,表2)。

表2 两组患者术前超声心动图结果比较Table 2 Comparison of preoperative echocardiographic results between the two groups
2.3 两组患者主动脉根部CT扫描与分析结果比较
55例(51.4%)患者为二叶式主动脉瓣,三叶式主动脉瓣52例(48.6%)。PV L ≥3/4组瓣环直径[(25.4±2.4)mm 比(24.3±2.6)mm,P=0.033]、瓣环钙化体积[(763.89±462.15)mm3比(545.22±437.81)mm3,P=0.008]均显著大于PVL<3/4组患者,差异均有统计学意义。PVL≥3/4组的左心室流出道平均径有大于PVL<3/4组的趋势,但差异无统计学意义(P=0.058)。两组患者瓣膜类型构成、瓣环椭圆率、升主动脉平均径、主动脉成角比较,差异均无统计学意义(均P>0.05,表3)。
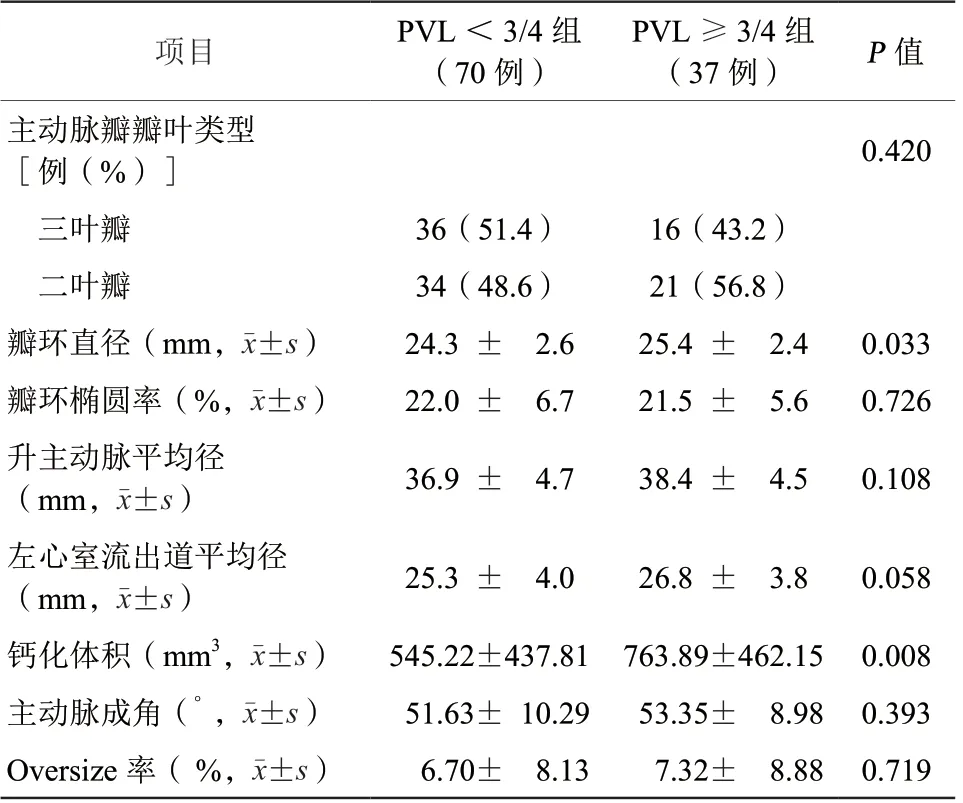
表3 两组患者主动脉根部及全主动脉CT 扫描与分析结果比较Table 3 Comparison of aortic root and whole aorta CT scans and analysis results between two groups
2.4 多因素Logistic回归分析及预测价值
对RWT进行变量转换,将RWTd定义为RWT的倒数。经单因素Logistic回归分析后将P<0.1的变量(男性、LVEDd、LVESd、RWTd、瓣环直径、左心室流出道平均径、钙化体积)纳入多因素Logistic回归分析,结果显示RWTd以及钙化体积是行TAVR置入Venus-A瓣膜术后发生中度以上PVL的独立危险因素(均P<0.05,表4)。使用ROC曲线进一步评估RWTd和钙化体积对PVL的预测价值,结果显示这两个变量都有预测价值:RWTd(AUC=0.658,95%CI0.554~0.763,P=0.007)、钙化体积(AUC=0.657,95%CI0.554~0.759,P=0.008;图1)。

图1 各危险因素预测重度主动脉瓣狭窄行TAVR 术后发生中度以上PVL 的ROC 曲线Figure 1 ROC curve for each risk factor predicting the occurrence of moderate or higher PVL after TAVR for severe aortic stenosis
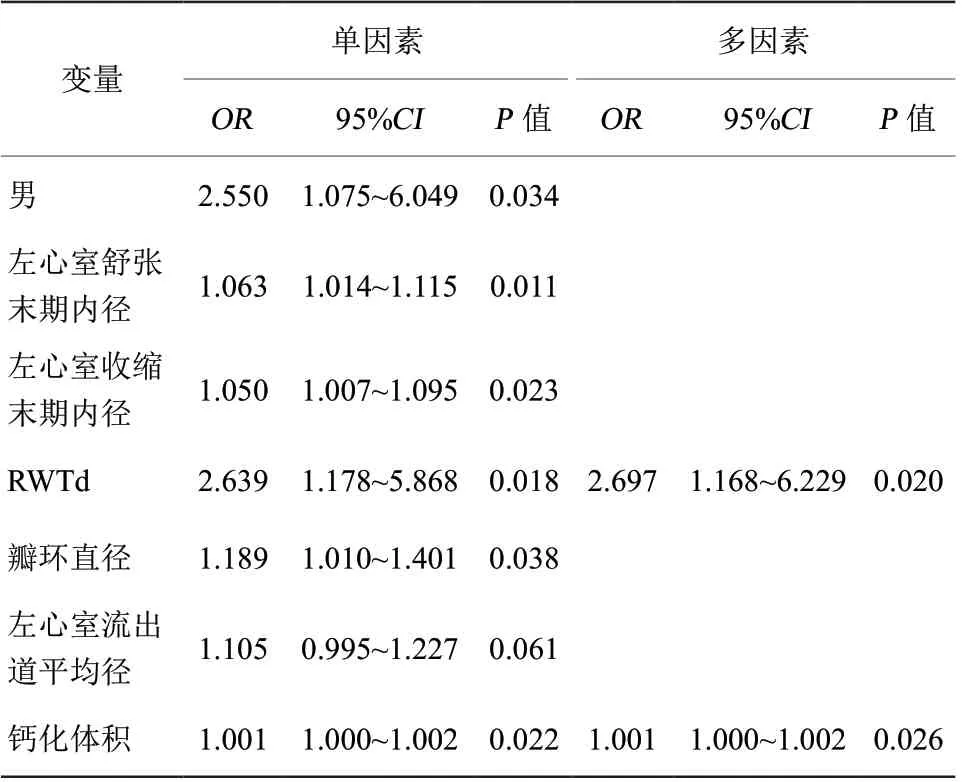
表4 TAVR 术后发生中度以上PVL 的危险因素的多因素Logistic回归分析结果Table 4 Results of multifactorial Logistic regression analysis of risk factors for the development of moderate or higher PVL after TAVR
3 讨论
本研究分析了单中心自膨瓣TAVR术后PVL的发生情况与影响因素,发现:(1)在TAVR术后,中度以上PVL的发生率高达34.6%(37/107),需要引起注意;(2)中度以上PVL患者术前左心室重构较严重,且LVEF在正常范围低值;(3)RWTd以及主动脉瓣钙化体积是TAVR术后发生中度以上PVL的独立危险因素,两者对预测术后严重PVL具有一定价值。
尽管TAVR技术不断进步,但PVL仍是术后常见的并发症之一[3]。瓣 环直径过大、主动脉瓣严重钙化、瓣膜置入过深是已证实的严重PVL的决定因素[8-10]。瓣环直径过大容易导致人工瓣膜金属支架与瓣环贴合不良,因此术后中度以上PVL发生率增加。相反,较小的瓣环直径可以减少PVL的发生率。正如Détaint等[17]在其研究中指出,瓣环直径<22 mm的患者中,没有观察到中度以上的PVL。本研究发现,PVL≥3/4组瓣环直径明显大于PVL<3/4组,这与之前的结果相符。然而,多因素Logistic回归分析结果表明,较大瓣环直径并非中度以上PVL独立预测因素。由于主动脉瓣环通常代表主动脉根部最狭窄的部分,因此主动脉瓣环直径成为瓣膜大小选择的“金标准”[18]。目前MSCT是TAVR术前测量主动脉瓣环的标准策略[19]。在实际操作中,术者根据主动脉根部解剖,选择瓣膜尺寸的策略是“Oversize”,即选择的瓣膜直径大于瓣环直径15%~20%。而在我国二叶式主动脉瓣较为常见,其“环上结构”(从瓣环到窦管交界处)的形态特征相当复杂,尤其是伴有重度钙化的瓣叶。由于瓣叶结构的畸形,基于MSCT的瓣环测量在这种情况下可能不准确,因此出现了“Downsize”策略[20],即实际选择的瓣膜尺寸比依据瓣环选择的尺寸小。与既往国内研究[21]结果不同,本研究未发现不同程度PVL组间的二叶式主动脉瓣占比及Oversize率有差异,事实上这些策略很大程度上降低了瓣环大小与类型对术后PVL的影响。
既往研究报道主动脉瓣钙化程度及其分布与瓣膜扩张不足和瓣膜功能障碍有关[22]。在Delgado等[23]的研究中,发现与轻度以下PVL患者相比,中度以上PVL患者瓣叶存在明显的钙化[(4 174±1 604)HU 比(2 444±1 237)HU,P=0.005]。此外,中度以上PVL患者的瓣叶粘连钙化发生率较高(100%比59%,P=0.07)。Marwan等[24]在使用Edwards Sapien球扩瓣人群中发现,中度以上PVL发生率为33%,主动脉瓣钙化与术后PVL的程度存在显著相关性。与这些结果一致,本研究还显示,与PVL<3/4组相比,PVL≥3/4组的主动脉瓣钙化体积明显增大,且37例PVL≥3/4的患者中,有14例在球囊后扩张之后,PVL的严重程度至少降低了一个等级,其中2例球囊后扩张之后为中度PVL,原先是重度PVL,经后扩张PVL确实降低一个等级,这表明一些严重PVL的病例与人工瓣膜的不完全扩张有关。多因素Logistic回归分析显示,主动脉瓣钙化体积是TAVR术后严重PVL的独立预测因素。关于主动脉瓣钙化的分布对PVL影响的研究较为不明确。Ewe等[25]发现,TAVR术后行TEE检查可以根据钙化的分布来确定PVL的位置。例如:瓣叶壁上有大量的钙化时,PVL发生的可能性更大,而如果钙化位于瓣叶游离边缘,此时PVL的风险较小。在瓣叶交界处发生PVL的情况与之类似,常与瓣叶交界处的钙化有关,但在瓣叶游离边缘的钙化对PVL的影响较小。
AS病理生理学表现为瓣膜开口进行性变窄,造成左心室压力负荷过大,可导致心肌增厚和左心室几何形状改变,作为代偿机制以降低室壁应力和维持心输出量,并逐渐出现心排血量不足、运动能力下降、心力衰竭,最终造成心原性死亡[26]。Ganau等[27]提出的根据LVMI与RWT之间的关系,将左心室肥厚分为向心性和离心性两种类型。从本研究结果看出,两组患者在术前均出现心脏显著重构,且倾向于向心性肥厚。PVL≥3/4组的左心室重构程度更明显,提示PVL≥3/4组患者心功能可能会更加恶化。尽管在本研究中,PVL≥3/4组的LVEF相对PVL<3/4组略低,但差异无统计学意义(P=0.137)。以上研究的发现可以用起病时间的长短加以解释,可以看出,PVL≥3/4组患者病程也许更长,导致心脏重构更加明显,但这在本研究中难以佐证。RWT是由PWT与LVEDd的比值得出的,反映了心肌肥厚的程度以及在长期压力负荷状态下,心脏结构的变化情况。本研究发现PVL≥3/4组患者RWT明显小于PVL<3/4组,同样反映了PVL≥3/4组患者心脏重构较为显著。而且多因素Logistic回归分析结果表明,RWTd是术后PVL的独立预测因素,这一结果在以往的研究中尚未发现。尽管目前不能对这一发现提供明确的解释,但可以推测,随着左心室的重构,在某种程度上改变了左心室流出道的解剖结构,如:左心室流出道钙化分布[28]、瓣环与左心室流出道直径不匹配[29]、左心室流出道管型[30]、升主动脉与左心室流出道成角[31]等。上述研究同样发现,这些相关因素可能会导致人工瓣膜在展开后难以与瓣叶紧密贴合,最终导致严重的PVL。
瓣膜置入过深也是造成PVL的危险因素之一[32]。由于自膨瓣具有较长的支架结构,置入过深使得部分瓣膜支架游离于左心室流出道或左心室,增加PVL的发生风险[33]。《经导管主动脉瓣置换术中国专家共识(2020更新版)》[34]建议,以无冠状动脉窦的最低点为参考,瓣膜置入的合适深度为0~6 mm。此外,置入深度还受各中心和操作者的经验影响。研究已经证实,学习曲线会影响PVL的发生率,而随着术者完成手术数量的增加,其发生率会降低[35]。与国内既往研究[36]相比,虽然本研究分析中缺少瓣膜置入深度的详细数据,但是发现RWTd和瓣膜钙化体积与严重PVL发生风险相关,具有一定的临床意义。本研究还有一些局限性:首先,这是一项单中心回顾性研究,所有患者均使用Venus-A自膨瓣,在将本研究结果外推到其他队列时,需要谨慎解释;其次,术前超声心动图是由不同超声医师进行的,各测量指标具有一定主观性;最后,本研究未对其他可能导致PVL的因素进行分析,如瓣膜置入深度、瓣膜类型、左心室流出道钙化分布、升主动脉与左心室流出道成角等。因此,希望将来能进行多中心、多瓣膜类型、更全面临床及实验室资料的长期随访研究,以更好地预测TAVR术后PVL的发生,尽可能降低术后并发症的发生率。
利益冲突所有作者均声明不存在利益冲突

