冠状动脉旋磨术联合血管内碎石术治疗超高龄严重钙化病变1例
何攀 邓安平 杨俊杰 陈海威 张慧 郭军 陈韵岱 汪奇
1 临床资料
患者 女,87岁。因“发作性胸痛4年,再发半个月”于2022年11月9日入住中国人民解放军总医院第六医学中心心血管病医学部。患者于2019年4月无明显诱因出现心前区胀痛,伴后背部疼痛,持续2~3 min缓解,当地医院诊断为冠心病,给予冠心病二级预防治疗,自觉症状发作次数减少。2022年10月胸痛症状发作频繁,时间延长,性质同前,平地行走20 m即可诱发;2022年10月25日中国人民解放军总医院第一医学中心冠状动脉CT示:三支严重弥漫性钙化,管腔严重狭窄(图1A)。既往陈旧性脑梗死、阵发性心房颤动(房颤)、高血压病、高脂血症病史。入院查体:体温36.4℃,脉搏65次/分,呼吸18次/分,血压130/80 mmHg(1 mmHg=0.133 kPa),身高156 cm,体重45 kg,身体质量指数18.49 kg/m2。心肺查体未见明显异常。心电图示:窦性心律,Ⅱ、Ⅲ、aVF导联T波低平,V1~V6导联T波倒置(图2A)。超声心动图示:左心室射血分数(left ventricular ejection fraction,LVEF)为51%。实验室检查示心肌酶、血肌酐在正常值范围内。入院诊断:冠心病,不稳定型心绞痛。给予阿司匹林100 mg、每日1次,替格瑞洛90 mg、每日2次抗血小板治疗;单硝酸异山梨酯40 mg、每日1次扩张冠状动脉;琥珀酸美托洛尔47.5 mg、每日1次控制心率,盐酸曲美他嗪35 mg、每日2次改善心肌代谢治疗后,仍有反复发作活动后心绞痛。遂行冠状动脉造影示:左前降支(left anterior descending branch,LAD)近、中段弥漫性钙化病变,最严重狭窄90%(图1B);钝缘支狭窄90%,右冠状动脉弥漫性钙化,最严重狭窄80%。建议首选外科冠状动脉旁路移植术,与患者家属充分沟通,因患者高龄,坚决拒绝外科手术,尝试应用Shockwave冲击波球囊对LAD重度钙化进行预处理和介入治疗。
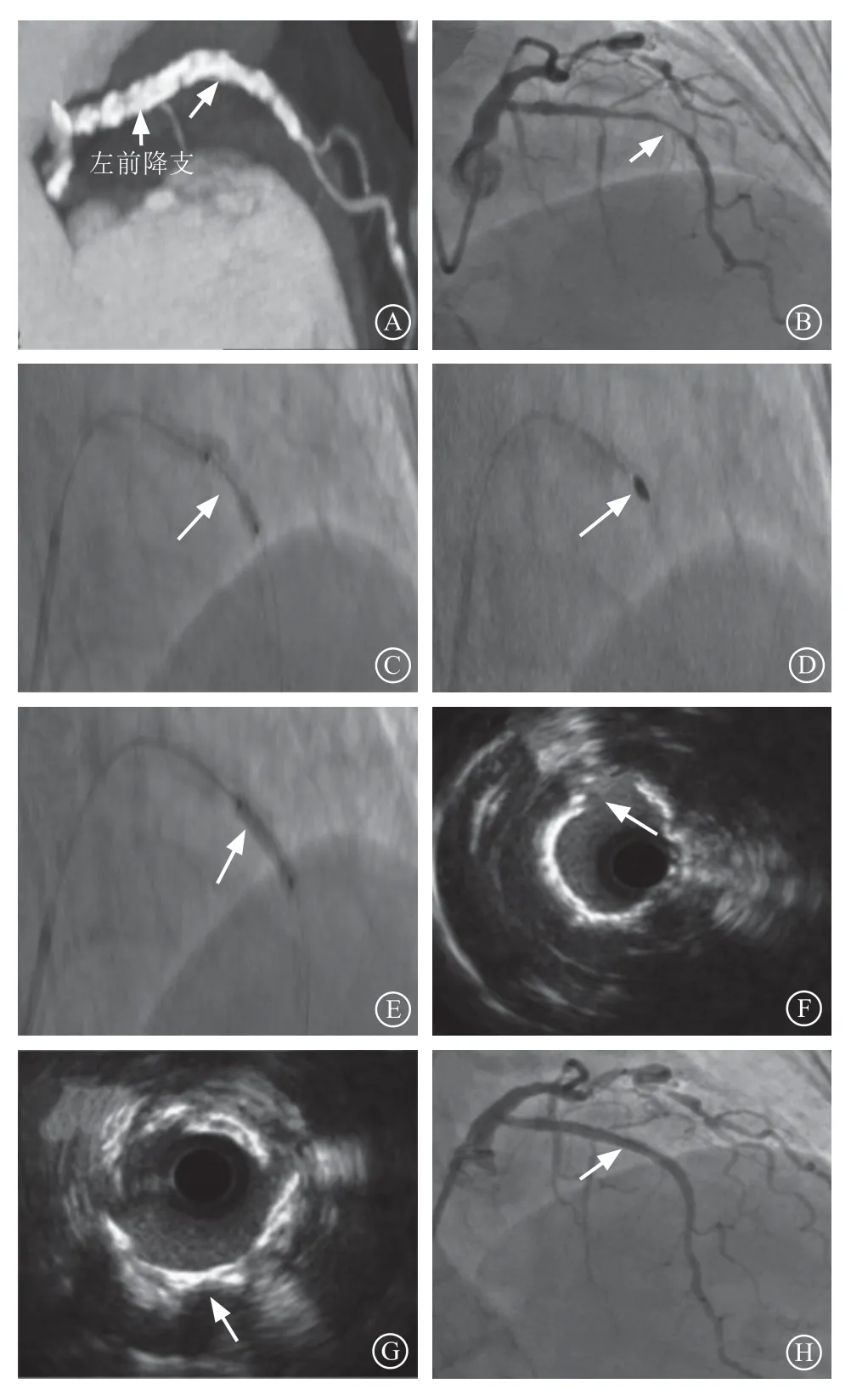
图1 左前降支造影及介入过程 A.冠状动脉CT 造影提 示左前降支严重弥漫性钙化(箭头所示);B.患者左侧冠状动脉右头位造影提示左前降支严重钙化狭窄处(箭头所示);C.用2.5 mm×15 mm 后扩张球囊以18 atm 扩张左前降支呈“哑铃样”形态;D.以1.5 mm 旋磨头高速打磨左前降支病变;E.以2.5 mm×12 mm Shockwave 冲击波球囊预处理病变;F.术中血管内超声示钙化环出现明显裂隙;G.复查血管内超声示支架膨胀良好;H.左前降支支架术后冠状动脉造影图像Figure 1 Left anterior descending angiography and interventional process
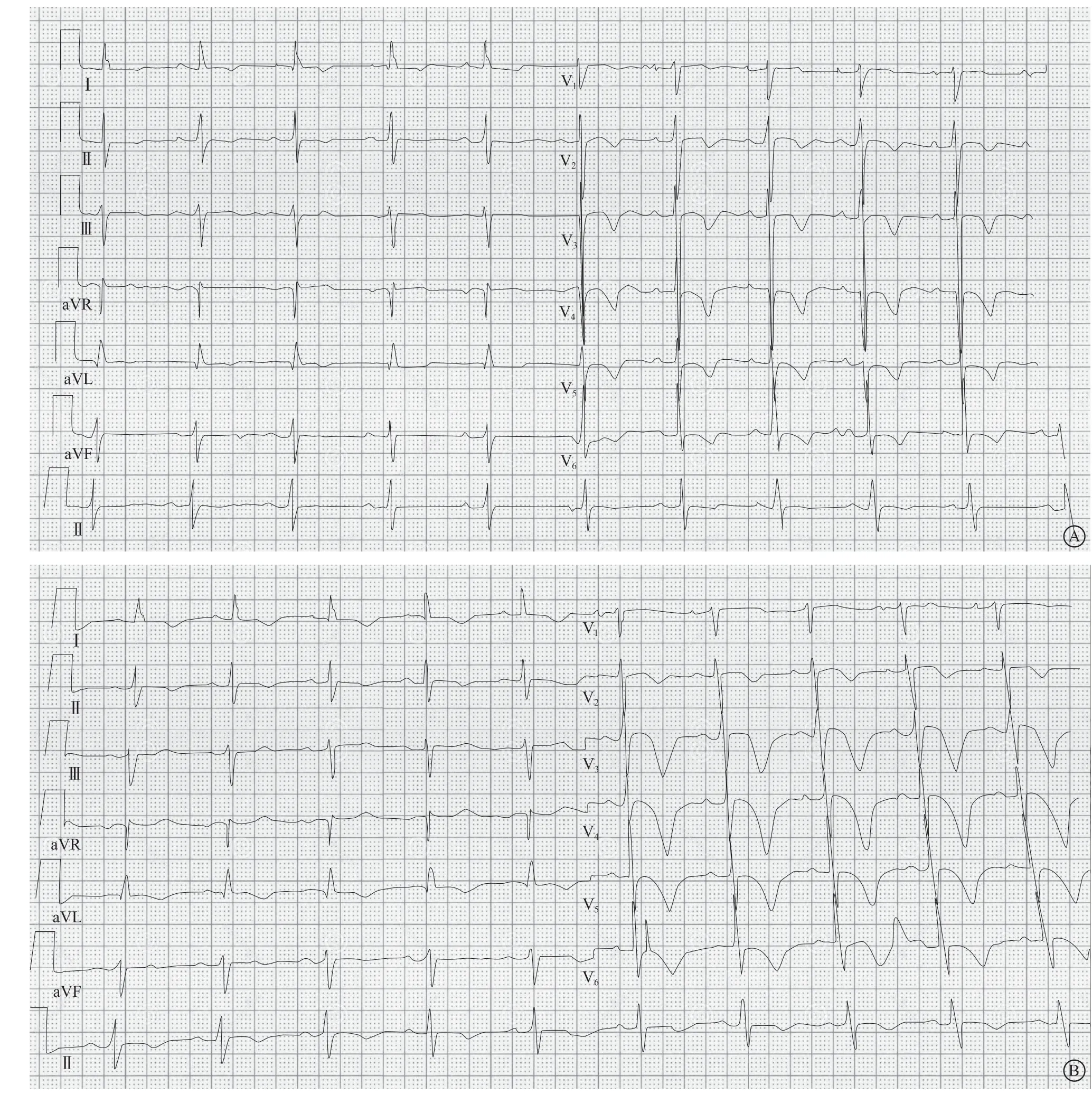
图2 心电图 A.入院心电图;B.术后心电图Figure 2 Eectrocardiogram
治疗过程:双侧股动脉及主动脉内球囊反搏备用。应用右侧桡动脉6 F EBU 3.5指引导管到达左冠状动脉开口,工作导丝顺利通过LAD病变达到血管远段,拟行血管内超声(intravascular ultrasound,IVUS)对病变进行评估。但IVUS导管不能通过最严重病变,自最远处回撤,LAD中段近360°钙化,长度>15 mm,最小管腔面积(minimum lumen area,MLA)2.6 mm2。遂送入2.0 mm×20 mm预扩张球囊(Medtronic,美国)以12 atm(1 atm=101.325 kPa)不能扩张,退出预扩张球囊,送入2.5 mm ×15 mm NC Sprinter后扩张球囊(Medtronic,美国),以18 atm对病变进行扩张,呈典型的哑铃样改变(图1C)。决定行冠状动脉血管内碎石术(intravscular lithotripsy,IVL)治疗,选择2.5 mm×12 mm Shockwave冲击波球囊(Shockwave Medical,美国),连接主机并排气准备,反复尝试无法到达病变,考虑存在钙化结节的可能。遂先行冠状动脉内旋磨术(rotational atherectomy,R A),打通输送隧道,选择1.5 mm旋磨头,以1.5×105r/min的速度对LAD进行旋磨(图1D),啄木鸟式前进,共旋磨2次,每次持续15 s,后再打磨1次,维持15 s。术中心电监护示前壁V1~V6导联ST段明显抬高。患者诉不能坚持,迅速撤出旋磨头,给予硝酸甘油注射液2 mg鞘管内注射后,症状稍缓解。再次尝试在双导丝支撑下,艰难将2.5 mm×12 mm Shockwave冲击波球囊送到位(图1E),以4 atm扩张,同时给予10次冲击波对钙化病变进行预处理,停止发射冲击波后以6 a t m扩张球囊,维持10 s,球囊扩张充分,然后稍改变位置后,再重复上述操作3次,共使用30次冲击波。患者再次出现严重胸痛及胸部V1~V6导联ST段改变,迅速撤出冲击波球囊,待症状缓解后,行IVUS检查,发现钙化环有1处明显断裂(图1F),送入2.5 mm×15 mm NC Sprinter后扩张球囊(Medtronic,美国)以16 atm扩张,膨胀充分,随后送入FIREBIRD2 3.0 mm×33 mm药物洗脱支架(微创,上海)以12 atm释放,后送入3.0 mm×12 mm GRIP后扩张球囊(Acrostak,瑞士)以14~18 atm进行后扩张。冠状动脉造影提示无明显残余狭窄,心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级Ⅲ级(图1H)。复查IVUS示:支架膨胀贴壁良好,无明显夹层,MLA为6.6 mm2(图1G)。
术后患者仍有胸部胀痛症状,较术中明显减轻,心电图示:胸前V1~V6导联T波较前倒置加深(图2B)。实验室检查示心肌酶轻度升高。术后给予氯吡格雷75 mg、每日1次联合达比加群酯110 mg、每日2次双联抗栓治疗。患者症状明显好转,平时活动不受限,观察3 d,复查心电图示T波倒置较前好转,肌酸激酶、肌酸激酶同工酶迅速降至正常,安全出院。1个月后随访患者无再发心绞痛,日常活动不受限。
2 讨论
冠状动脉严重弥漫性钙化是介入医师的大敌,常导致器械通过失败、损伤支架涂层、影响支架膨胀与贴壁[1]。对于重度钙化病变,特别是弥漫性的环形钙化病变,常规的高压球囊、切割球囊、棘突球囊扩张成功率低,并发症发生率高,显著增加了介入手术的难度和风险[2]。
RA通过其高转速的旋磨头与钙化斑块接触,将其研磨成5~10 μm微小颗粒[3],最终被下游的网状系统所清除,从而修饰钙化结节、减轻斑块负荷、碎裂钙化组织、改善血管顺应性。但作为最广泛的处理钙化病变的技术之一,RA主要作用于贴近内膜的浅表钙化病变,对血管深层钙化却无能为力[4]。
IVL基于Shockwave冲击波球囊导管治疗冠状动脉钙化病变的技术。主要通过局部电动液压驱动的声压冲击波和在球囊低压扩张时向病变提供机械能对钙化病变进行预处理,不仅对浅表钙化病变起作用,而且对深层钙化有松解作用[5],最终明显改善血管顺应性,促进球囊扩张,改善支架置入效果,其安全性也已获得国内外研究的证实[6-7]。但IVL也存在不足,冲击波球囊通过性有限[8],对于严重狭窄的重度钙化病变,可能无法通过甚至会损伤球囊,导致不能发挥其作用。
本例患者为超高龄低体重女性患者,是目前国内外报道的最年长的应用Rota-lithotripsy策略治疗重度钙化病变的病例。Rota-lithotripsy策略即冠状动脉RA联合IVL,由Jurado-Román等[9]在2019年8月首次用于治疗冠状动脉严重钙化病变并获得手术成功。针对极端的严重钙化病例,该策略结合了IVL和RA两种手术的特点,扬长避短,优势互补[10]。首先对钙化病变进行旋磨,开通隧道,修饰钙化结节与表浅钙化,增加冲击波球囊通过性,后冲击波球囊到位裂解深层钙化,进一步改善血管顺应性,最终促进支架置入,改善支架膨胀。该策略用于旋磨术后未获得满意效果和Shockwave冲击波球囊不能通过的严重狭窄重度钙化病变。本例患者2.5 mm×15 mm NC Sprinter后扩张球囊能到位,但2.5 mm×12 mm Shockwave冲击波球囊无法到位,考虑可能与冲击波球囊内的发射装置有关,也可能与病变内的钙化结节有关,采用旋磨开路后,修饰好冲击波球囊前进的隧道,顺利完成手术。此外,既往单纯旋磨术后置入支架,往往存在支架膨胀不佳情况[10-11],IVUS或光学相干断层成像检查经常发现支架局部呈不规则形状(钙化结节状、“D”字形等),反复超高压后扩张也无法改善,而本例采用Rota-lithotripsy策略治疗后,IVUS示支架横断面全程呈圆形,膨胀率达到93%以上,效果满意。
作为一种全新的治疗方法,Rota-lithotripsy策略有望成为应对冠状动脉重度狭窄伴严重钙化的“新招式”,造福更多患者。但是该策略的安全性和有效性亟待更多研究来验证。
利益冲突所有作者均声明不存在利益冲突

