越南槐根的抗HIV活性成分研究
魏鑫, 张卫, 杨欣, 王菊, 张丽艳, 危英, 周英
越南槐根的抗HIV活性成分研究
魏鑫, 张卫, 杨欣, 王菊, 张丽艳, 危英, 周英*
(贵州中医药大学,贵阳 550025)
为研究越南槐()根的抗HIV蛋白酶活性成分及其分子对接机制,采用硅胶、MCI、Sephadex LH-20等多种色谱分离方法,对越南槐根的化学成分进行分离,采用HIV蛋白酶对化合物进行体外抗HIV活性筛选,运用分子对接手段初步探究活性化合物与HIV-1蛋白酶的结合机制。结果表明,从越南槐中共分离得到8个化合物,根据波谱数据分别鉴定为三叶豆紫檀苷 (1)、苦参碱 (2)、-acetylnicotinamide (3)、2′--甲基腺苷 (4)、毛蕊异黄酮苷 (5)、玫瑰花苷 (6)、环广豆根素 (7)、芒柄花苷 (8),此外还分离得到塑化剂衍生物邻苯二甲酸二(2-乙基)己酯(9)和邻苯二甲酸二异丁酯(10)。抗HIV蛋白酶活性测试显示化合物1和2的IC50分别为13.2和38.6g/mL,分子对接表明其与HIV蛋白酶有一定的结合作用。化合物3~5为首次从该植物中分离得到,化合物1和2显示中等的抗HIV蛋白酶活性。
越南槐;化学成分;分离鉴定;抗HIV活性;分子对接
获得性免疫缺陷综合征(AIDS)是由人类免疫缺陷病毒(HIV)引起的重大疾病[1]。HIV病毒主要有2种亚型,分别为1型和2型,HIV-1型为当前主要流行毒株[1–2]。HIV-1蛋白酶(HIV-1 protease, HIV PR)是天冬氨酸属蛋白水解酶,可以剪切多聚蛋白,形成病毒粒子从而感染细胞,现已经成为抗艾滋病药物开发的关键靶点之一[1]。越南槐()为豆科植物,其干燥根和根茎又名山豆根,为传统抗感染苗药,性味苦寒,有毒,归肺、胃经,主要在广西、贵州、云南、江西等地分布, 具有清热解毒,消肿利咽等功效,用于乳蛾喉痹,咽喉肿痛,齿龈肿痛等症[3]。现代药学研究已报道从越南槐植物中分离出多种类型化学成分,以黄酮类和生物碱类结构为主,此外还包括三萜类、多糖及其他成分,具有抗病毒、抗菌、抗炎等药理活性[4–6],然而目前对于越南槐根的抗病毒成分研究大多集中在总提取物上,抗病毒活性单体物质基础还不够明确。为深入研究越南槐根的抗HIV化学成分, 本研究对越南槐根的乙酸乙酯部位和正丁醇部位进行了化学成分的分离和鉴定,并对分离得到的单体化合物进行体外抗HIV蛋白酶的活性筛选,为该植物的开发利用提供了科学依据和理论基础。
1 材料和方法
1.1 仪器和材料
核磁共振谱1H、13C和DEPT谱图测试采用Bruker Avance NEO 600 MHz核磁共振波谱仪(瑞士布鲁克公司);半制备液相系统LC52购自Separation (北京)科技公司;RE-5210A/ER-3000旋转蒸发仪(上海亚荣生化仪器厂);SHZ-DⅢ循环水式多用真空泵(郑州长城科工贸有限公司);薄层色谱(TLC)硅胶板和柱层析硅胶(青岛海洋化有限公司);Sephadex LH-20凝胶(GE Healthcare Bio-Sciences, Uppsala, Sweden); MCI GEL-CHP 20P (Mitsubishi Chemical Co., Ltd. Japan);二氯甲烷、石油醚、乙酸乙酯、甲醇、乙醇购自天津市富宇精细化工有限公司, Senso Lyte 520 HIV-PR蛋白酶试剂盒购自Anapec公司(美国)。
山豆根药材于2019年9月购自贵州三力制药有限公司,经贵州中医药大学魏升华教授鉴定为豆科植物越南槐()的干燥块根,标本(WX_20190901)保存于贵州中医药大学。
1.2 提取和分离
山豆根药材20 kg干燥后粉碎,用工业甲醇50 L于70 ℃加热回流提取3次,每次2 h,合并3次提取液,减压回收浓缩至浸膏649.1 g,将浸膏充分混悬于蒸馏水1.5 L中,分别用石油醚、乙酸乙酯和正丁醇进行萃取,然后将萃取液减压浓缩得各部位萃取物浸膏。
取乙酸乙酯部位萃取浸膏(200 g)硅胶拌样,使用不同梯度的二氯甲烷:甲醇[1:0→0:1,(下同)]进行洗脱,经TLC检测合并极性相同的部分。获得9个极性段位(RJ~RS),保存。取RK部分(9.0 g)过硅胶柱,用石油醚-乙酸乙酯(20:1→0:1)进行梯度洗脱,TLC检测合并后浓缩,得到5个组分(RK1~RK5),其中,RK4 (2.0g)上凝胶柱等度洗脱,得到4个组分(RK4.1~RK4.4),组分RK4.1 (900 mg)经Sephadex LH-20甲醇等度洗脱,得3个组分(RK4.1.1~RK4.1.3),RK4.1.3 (246.5 mg)经过半制备HPLC梯度洗脱(流动相为甲醇-水), 得到化合物7 (5.4 mg);RK4.4 (235.0 mg)经Sephadex LH-20 (甲醇)洗脱,得到化合物2 (87.1 mg)。取RM部分(978.7 mg)经Sephadex LH-20 (甲醇)洗脱,得到4个组分(RM1~RM4),其中,RM2部分(633.6 mg)过MCI GEL-CHP 20P (甲醇-水,3:7→1:0)梯度洗脱,得到化合物3 (10.5 mg);RM3部分(70.2 mg)经过制备薄层板得到化合物1 (16.4 mg);RM4部分(25.5 mg)过半制备HPLC梯度洗脱(流动相为甲醇-水),得到化合物4 (4.1 mg)。取RO部分(2.26 g)经过硅胶柱,使用不同梯度的二氯甲烷:甲醇(1:0→0:1)梯度洗脱,分离得到5个组分(RO1~RO5),其中,RO2部分(634.6 mg)过Sephadex LH-20 (甲醇)洗脱,分离得到4个组分(RO2.1~ RO2.4), RO2.2 (366.9 mg)经过MCI GEL-CHP 20P (甲醇-水,3:7→1:0)和半制备HPLC (流动相为甲醇-水)梯度洗脱,得到化合物8 (4.4 mg)。另外从RQ (646 mg)中经Sephadex LH-20 (甲醇)等度洗脱、MCI GEL-CHP 20P (甲醇-水,3:7→1:0)梯度洗脱,最后运用制备薄层板得到塑化剂衍生物化合物9 (19.4 mg)和10 (47.8 mg)。
取正丁醇部位萃取物400.0 g,经硅胶柱层析,二氯甲烷-甲醇(1:0→0:1)梯度洗脱,TLC合并相近极性流分,获得8个极性段位(RS~RZ),保存。取RU (8.40 g)经过ODS柱,使用甲醇-水(1:9→1:0)梯度洗脱,分离得到6个组分(RU1~RU 6),其中, RU3 (194.9 mg)经过半制备HPLC (流动相为甲醇-水)梯度洗脱,得到化合物5 (6.8 mg);RU5 (31.5 mg)经过半制备HPLC梯度洗脱(流动相为甲醇-水),得到化合物6 (15.6 mg)。
1.3 结构鉴定

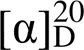
化合物3 C8H8N2O2, 白色粉末;1H NMR (600 MHz, CD3OD):9.02 (1H, d,=2.0 Hz, H-2), 8.69 (1H, dd,= 4.9, 1.6 Hz, H-6), 8.29 (1H, dt,= 8.0, 2.0 Hz, H-4), 7.55 (1H, dd,= 5.0, 7.9 Hz, H-5), 1.94 (3H, s, CH3);13C NMR (150 MHz, CD3OD):175.1 (C-2′), 168.5 (C-1′), 151.5 (C-2), 148.1 (C-6), 136.0 (C-4), 130.0 (C-3), 123.8 (C-5), 20.8 (-CH3)。以上波谱数据与文献[9~11]基本一致,故鉴定为- acetylnicotinamide。
化合物4 C11H15N5O4, 白色粉末; ESI-MS: 304.1 [M + Na]+;1H NMR (600 MHz, CD3OD):8.34 (1H, s, H-2), 8.19 (1H, s, H-8), 6.06 (1H, d,= 6.0 Hz, H-1′), 4.49 (1H, dd,= 3.0 Hz, 4.9 Hz, H-3′), 4.43 (1H, dd,= 5.0 Hz, H-2′), 4.16 (1H, q,= 2.8 Hz, H-4′), 3.89 (1H, dd,= 2.5 Hz, 12.6 Hz, H-5′a), 3.75 (1H, dd,= 2.5 Hz, 12.6 Hz, H-5′b), 3.42 (3H, s, -OCH3);13C NMR (150 MHz, CD3OD):156.2 (C-6), 152.2 (C-8), 148.6 (C-4), 140.5 (C-2), 119.6 (C-5), 87.9 (C-4′), 87.0 (C-2′), 83.2 (C-1′), 69.4 (C-3′), 61.8 (C-5′), 57.3 (C-OCH3)。以上波谱数据与文献[12]一致,故鉴定为2′--甲基腺苷。
化合物5 C22H22O10, 黄色油状; ESI-MS: 469.0 [M + Na]+;1H NMR (600 MHz, CD3OD):8.24 (1H, s, H-2), 8.15 (1H, d,= 8.9 Hz, H-5), 7.25 (1H, d,= 2.3 Hz, H-8), 7.22 (1H, dd,= 8.9, 2.3 Hz, H-6), 7.18 (1H, d,= 2.0 Hz, H-2′), 6.98 (1H, dd,= 8.1, 2.0 Hz, H-6′), 6.86 (1H, d,= 8.1 Hz, H-5′), 5.11 (1H, d,= 7.3 Hz, H-1″), 3.90 (3H, s, -OCH3);13C NMR (150 MHz, CD3OD):178.1 (C-4), 163.5 (C-7), 159.2 (C-9), 155.3 (C-2), 148.8 (C-4′), 148.0 (C-3′), 128.3 (C-5), 126.2 (C-3), 124.6 (C-1′), 122.9 (C-6′), 120.2 (C-10), 117.1 (C-6), 116.2 (C-2′), 114.0 (C-5′), 105.0 (C-8), 101.8 (C-1″), 78.4 (C-5″), 77.9 (C-3″), 74.7 (C-2″), 71.3 (C-4″), 62.5 (C-6″), 56.5 (4′-OCH3)。以上波谱数据与文献[13]一致,故鉴定为毛蕊异黄酮苷 。
化合物6 C19H30O8, 黄色油状; ESI-MS: 409.1 [M + Na]+;1H NMR (400 MHz, CD3OD):5.97 (1H, d,= 15.6 Hz, H-7), 5.87 (1H, q,= 1.4 Hz, H-4), 5.73 (1H, dd,= 15.6, 7.2 Hz, H-8), 4.52 (1H, dd,= 14.4, 7.1 Hz, H-9), 4.27 (1H, d,= 7.8 Hz, H-1′), 3.85 (1H, dd,= 11.9, 2.2 Hz, H-6′), 2.61 (1H, d,= 17.0 Hz, H-2a), 2.17 (1H, d,= 17.1 Hz, H-2b), 1.94(1H, d,= 1.3 Hz, H-13), 1.29 (3H, d,= 6.4 Hz, H-10), 1.04 (3H, s, H-11), 1.02 (3H, s, H-12);13C NMR (150 MHz,CD3OD):200.0 (C-3), 132.4 (C-7), 132.4 (C-8), 125.8 (C-4), 99.9 (C-1′), 77.0 (C-3′), 76.8 (C-5′), 73.6 (C-9), 73.3 (C-2′), 70.3 (C-4′), 61.5 (C-6′), 49.4 (C-2), 41.1 (C-1), 23.3 (C-13), 22.1 (C-12), 20.9 (C-11), 18.2 (C-10)。以上波谱数据与文献[14]一致,故鉴定为玫瑰花苷。
化合物7 C30H34O4, 黄色粉末; [α]D20-25.9° (0.06, MeOH); ESI-MS: 481.2 [M + Na]+;1H NMR (600 MHz, CD3OD):7.60 (1H, d,= 8.7 Hz, H-5), 7.12 (1H, d,= 2.0 Hz, H-6′), 6.99 (1H, d,= 2.0 Hz, H-2′), 6.52 (1H, d,= 8.7 Hz, H-6), 6.37 (1H, d,= 9.7 Hz, H-6″), 5.71 (1H, d,= 9.7 Hz, H-7″), 5.33 (1H, dd,= 12.7, 3.0 Hz, H-2), 5.18~5.28 (2H, m, H-2″, 12″), 3.28 (4H, m, H-1″, 11″), 3.00 (1H, dd,= 12.8, 16.9 Hz, H-3a), 2.73 (1H, dd,= 3.0, 16.9 Hz, H-3b), 1.73 (3H, s, H-15″), 1.72 (3H, s, H-14″), 1.61 (3H, s, H-4″), 1.60 (3H, s, H-5″), 1.42 (6H, s, H-9″, 10″);13C NMR (150 MHz, CD3OD):192.7 (C-4), 162.6 (C-7), 161.6 (C-9), 150.5 (C-4′), 131.5 (C-1′), 131.2 (C-7″), 130.7 (C-13″), 130.8 (C-3″), 129.0 (C- 5′), 127.2 (C-6′), 125.3 (C-5), 122.5 (C-2′), 121.9 (C- 2″, 12″), 122.1 (C-6″), 121.1 (C-3′), 115.7 (C-8), 113.7 (C-10), 109.4 (C-6), 79.3 (C-2), 76.0 (C-8″), 43.4 (C-3), 27.9 (C-11″), 26.8 (C-9″, 10″), 24.6 (C-5″, 15″), 21.6 (C-1″), 16.7 (C-4″, 14″)。以上波谱数据与文献[15]一致,故鉴定为环广豆根素 。
化合物8 C22H22O9, 白色粉末; ESI-MS: 453.0 [M + Na]+;1H NMR (600 MHz, CD3OD):8.23 (1H, s, H-2), 8.15 (1H, d,= 8.9 Hz, H-5), 7.49 (2H, d,= 8.8 Hz, H-2′, 6′), 7.26 (1H, d,= 2.3 Hz, H-8), 7.22 (1H, dd,= 8.9, 2.3 Hz, H-6), 6.99 (2H, d,= 8.8 Hz, H-3′, 5′), 5.11 (1H, d,= 6.7 Hz, H-1″), 3.83 (3H, s, -OCH3);13C NMR (150 MHz, CD3OD):176.6 (C-4), 162.5 (C-7), 159.8 (C-4′), 158.1 (C-9), 153.9 (C-2), 130.0 (C-2′, 6′), 126.8 (C-5), 124.7 (C-1′), 123.7 (C-3), 118.8 (C-10), 115.7 (C-6), 113.5 (C-3′, 5′), 103.6 (C-8), 100.4 (C-1″), 77.0 (C-3″), 76.5 (C- 5″), 73.4 (C-2″), 69.9 (C-4″), 61.1 (C-6″), 54.3 (-OCH3)。以上波谱数据与文献[16]一致,故鉴定为芒柄花苷 。
化合物9 C24H38O4, 黄色油状; ESI-MS: 413.4 [M + Na]+;1H NMR (600 MHz, CDCl3):7.73 (2H, m, H-2, 5), 7.55 (2H, m, H-3, 4), 4.24 (4H, qd,= 10.9, 6.0 Hz, H-1′, 1″), 1.71 (2H, dt,= 12.3, 6.1 Hz, H-2′, 2″), 1.47~1.31 (16H, m, H-3′, 4′, 5′, 7′, 3″, 4″, 5″, 7″), 0.97~0.90 (12H, m, H-6′, 8′, 6″, 8″);13C NMR (150 MHz, CDCl3):68.1 (C-1″), 38.8 (C-2′, 2″), 30.4 (C-3′, 3″), 28.9 (C-4′, 4″), 23.0 (C-5′, 5″), 14.0 (C-6′, 6″), 23.8 (C-7′, 7″), 11.0 (C-8′, 8″), 68.1 (C-1′), 130.9 (C-3, 4), 128.8 (C-2, 5), 132.5 (C-1, 6), 167.7 (C-7, 8)。以上波谱数据与文献[17]一致,故鉴定为邻苯二甲酸二(2-乙基)己酯。
化合物10 C16H22O4, 黄色油状;1H NMR (600 MHz, CDCl3):7.74 (2H, dd,= 5.7, 3.3 Hz, H- 2, 5), 7.55 (2H, dd,= 5.7, 3.3 Hz, H-3, 4), 4.11 (4H, d,= 6.7 Hz, H-1′, 1″), 2.07~2.04 (2H, m, H-2′, 2″), 1.01 (12H, d,= 6.7 Hz, H-3′, 4′, 3″, 4″);13C NMR (150 MHz, CDCl3):71.8 (C-1′, 1″), 27.7 (C-2′), 27.8 (C-2″), 19.2 (C-3′, 4′, 3″, 4″), 130.9 (C-3, 4), 128.8 (C- 2, 5), 132.4 (C-1, 6), 167.7 (C-7, 8)。以上波谱数据与文献[18]一致,故鉴定为邻苯二甲酸二异丁酯。
1.4 体外抗HIV活性测定和分子对接
使用SensoLyte 520 HIV PR检测试剂盒,测定单体化合物对HIV-1蛋白酶的抑制活性[19];选择HIV蛋白酶的晶体结构(PDB ID:1QBS:1.80 Å)作为分子对接的研究对象[20]。采用药物分子设计模拟SYBYL 2.1.1 软件的Surflex-Dock和模块完成分子对接研究。初始筛选采用标准模式进行对接,修饰后的小分子与靶标蛋白进行半柔性对接,对接过程中阈值参数为0.5,其他参数为系统缺省值。选用Gasteriger-Huckel 电荷进行分子优化;基于Ligand模式产生活性口袋,优化完毕后保存为 SFXC 文件作为对接文件。
体外抗HIV-1蛋白酶(稀释100倍)活性测定结果表明,化合物1和2均表现出不同程度的抑制作用,在0.1 mg/mL (DMSO)的给药浓度下,抑制率分别为(100.0±4.22)%和(58.9±2.86)%,化合物1的IC50值为13.2g/mL,化合物2为38.6g/mL (表1)。
为了进一步探讨化合物1和2与HIV-1蛋白酶的结合机理,将化合物1和2以及HIV-1蛋白酶结构添加到SYBYL-x 2.1.1程序中进行分子对接验证, Total Score用作分子对接结果的评估指标,其>5.0表示活性分子与HIV-1蛋白酶具有一定的结合活性,总分>7.0表明活性分子与HIV-1蛋白酶有强烈的结合活性。
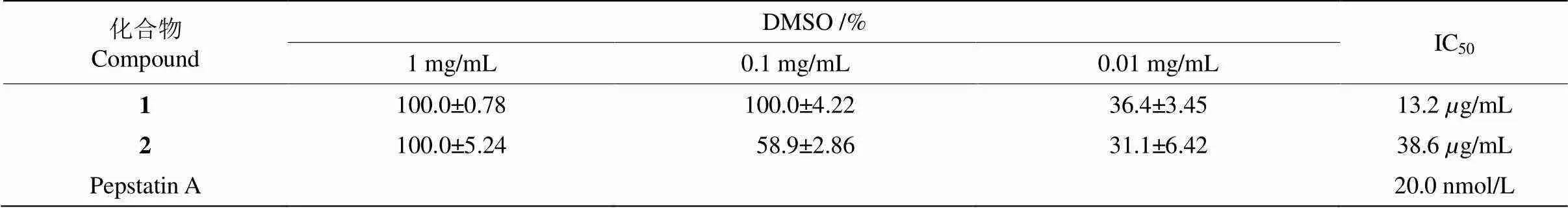
表1 化合物对HIV-1蛋白酶的抑制活性(n=3)
分子对接结果表明,化合物1和2均位于HIV-1蛋白酶的结合口袋中(图1),化合物1的吡喃葡萄糖基分别与蛋白酶的Asp25(B)、Gly27(A)以及Ala28(A)之间存在3个氢键,化合物1和2与HIV-1蛋白酶的疏水作用见表2和图2。

图1 化合物1 (A)和2 (B)与HIV-1蛋白酶的分子对接图

表2 化合物与HIV-1蛋白酶的相互结合作用
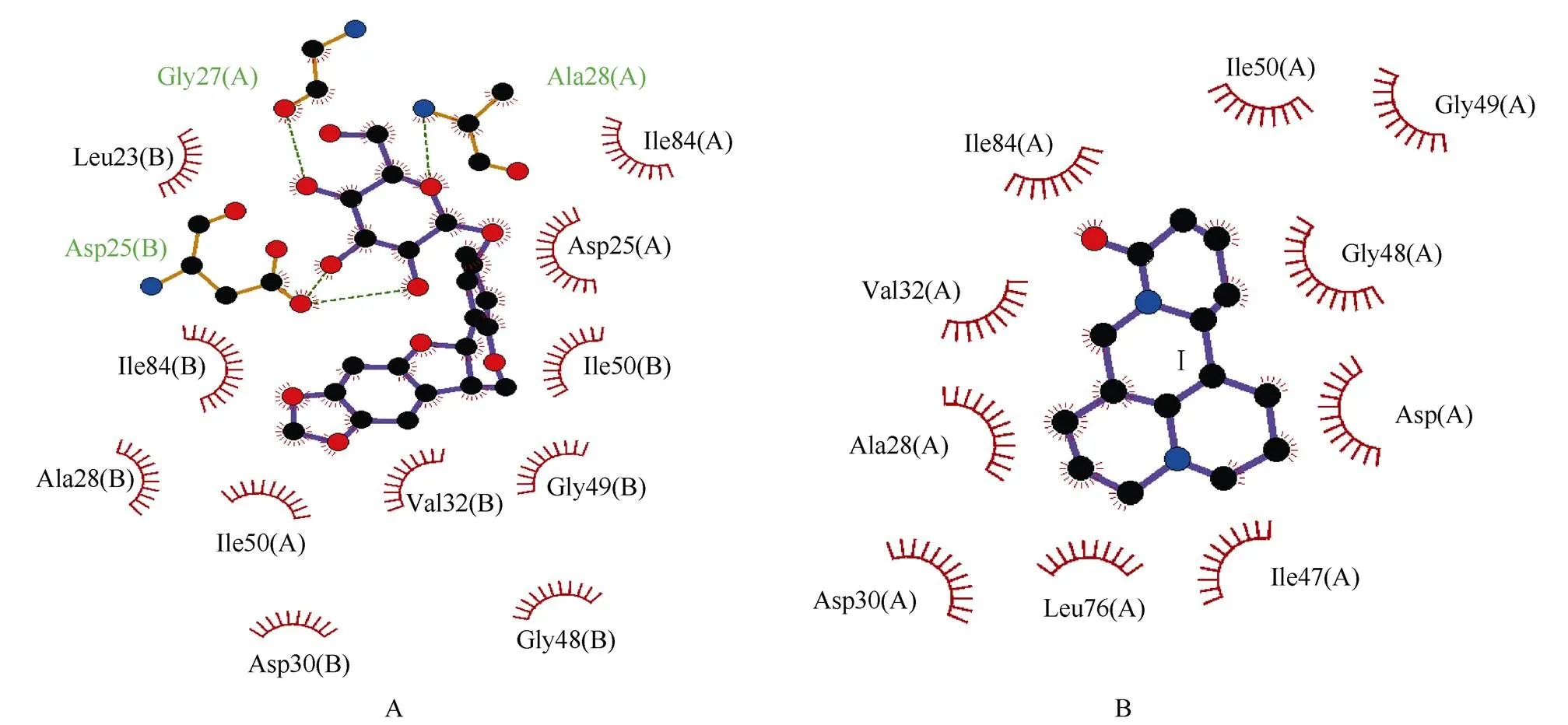
图2 化合物1 (A)和2 (B)与HIV-1蛋白酶的相互结合作用
2 结果和讨论
越南槐根又名山豆根,作为苗药组方“开吼剑喷雾剂”的主要原料药材,常用于治疗上呼吸道感染性疾病[3],前期大量研究已经从该植物各部位报道了多种类型化学成分,其中以黄酮类和生物碱类结构为主,此外还有三萜类、多糖及其他成分[21],山豆根中黄酮衍生物成分含量丰富,包括二氢黄酮类、异黄酮类和紫檀素类等[22–23],生物碱成分是山豆根的主要毒性成分,其分离得到的生物碱大部分具有相似的喹诺里西啶类基本骨架[23]。在药理活性研究方面,山豆根中已报道的药理作用包括抗炎、抗菌、抗肿瘤、抗氧化等,其中抗炎和抗菌作用研究尤为多见,然而针对其抗病毒活性报道较少[24]。本研究从越南槐根中共分离鉴定了8个单体化合物,分别为三叶豆紫檀苷 (1)、苦参碱(2)、-acetyl- nicotinamide (3)、2′--甲基腺苷 (4)、毛蕊异黄酮苷 (5)、玫瑰花苷 (6)、环广豆根素 (7)和芒柄花苷 (8),其中4个黄酮类成分,3个生物碱类成分,1个倍半萜糖苷类成分,化合物3~5为首次从该植物中分离得到。此外还分离得到2个塑化剂衍生物,鉴定为邻苯二甲酸二(2-乙基)己酯 (9)和邻苯二甲酸二异丁酯 (10)。运用HIV-1蛋白酶试剂盒对单体成分体外抗HIV病毒活性进行筛选,研究表明化合物三叶豆紫檀苷(1)和苦参碱(2)均表现出一定的抗HIV-1蛋白酶活性,IC50值分别为13.2和38.6g/mL,进一步运用分子对接技术初步探讨了化合物1和2与HIV-1蛋白酶的结合机制。这项研究从山豆根中分离鉴定了多个单体结构,丰富了山豆根的化学物质基础,所得化合物类型大部分为黄酮类以及生物碱类,这与前期所报道结构类型一致,说明了本实验研究方法的可靠性,也侧面证明了山豆根的主要结构类型。体外抗病毒测试显示部分化合物具有较好的抗HIV-1蛋白酶的活性,初步揭示了山豆根在抗HIV病毒方面的作用潜力,为山豆根的传统药用提供了必要的科学依据,最后通过分子对接技术进一步探讨了活性分子的作用机制, 为抗HIV先导结构的发现提供了有益探索,为后续体内外药效验证研究奠定了理论基础。
[1] SHEN P B, HAN X Z. Research progress in novel HIV-1 protease inhibitors [J]. Chem Life, 2019, 39(6): 1175–1187. [申培博, 韩秀珍. 新型HIV-1蛋白酶抑制剂的研究进展[J]. 生命的化学, 2019, 39(6): 1175–1187. doi: 10.13488/j.smhx.20190077.]
[2] ZHOU H Y, ZHU M, ZHANG G N, et al. Research progress in the development of HIV-1 protease inhibitors (2015—2019) [J]. Chin J Med Chem, 2020, 30(7): 428–443. [周慧宇, 朱梅, 张国宁, 等. 新型HIV-1蛋白酶抑制剂的研究进展(2015—2019年) [J]. 中国药物化学杂志, 2020, 30(7): 428–4432. doi: 10.14142/j.cnki.cn21-1313/r.2020. 07.008.]
[3] Chinese Pharmacopoeia Committee. Pharmacopoeia of the People’s Republic of China [M]. Beijing: China Medical Science and Techno- logy Press, 2015: 1749. [国家药典委员会. 中华人民共和国药典 [M]. 北京: 中国医药科技出版社, 2015:1749.]
[4] NIE A Z, ZHAO X R, GAO M M, et al. Discussion and consideration on safety ofRadix et Rhizoma and its rational use [J]. Chin Trad Herb Drugs, 2018, 49(17): 4152–4161. [聂安政, 赵雪睿, 高梅梅, 等. 山豆根安全问题探讨与合理用药思考[J]. 中草药, 2018, 49(17): 4152–4161. doi: 10.7501/j.issn.0253-2670.2018.17. 029.]
[5] WEI X, YANG J, DAI Z, et al. Antitumor pyridine alkaloids hybrid with diverse units from[J]. Tetrahed Lett, 2020, 61(7): 151502. doi: 10.1016/j.tetlet.2019.151502.
[6] WEI X, ZHANG W, DING C F, et al. Chemical constituents from the-butanol extract ofand their antibacterial acti- vities [J]. Guihaia, 2021, 41(7): 1054–1060. [魏鑫, 张卫, 丁彩凤, 等. 山豆根正丁醇部位化学成分及其抗菌活性研究[J]. 广西植物, 2021, 41(7): 1054–1060. doi: 10.11931/guihaia.gxzw202101025.]
[7] STEVENSON P C, VEITCH N C. Isoflavenes from the roots of[J]. Phytochemistry, 1996, 43(3): 695–700. doi: 10.1016/ 0031-9422(96)00346-9.
[8] SHAKIROV R, TELEZHENETSKAYA M V, BESSONOVA I A, et al. Alkaloids, plants, structures, properties [J]. Chem Nat Compd, 1996, 32(6): 932–1028. doi: 10.1007/BF01374041.
[9] NAGANO H, NAWATA Y, HAMANA M. The mechanism of the reaction of nicotinic acid 1-oxide with acetic anhydride [J]. Chem Pharm Bull, 1987, 35(10): 4068–4077. doi: 10.1248/cpb.35.4068.
[10] CHAN T H, WONG L T L. Silicon tetrachloride as a coupling reagent for amide formation [J]. J Org Chem, 1969, 34(9): 2766–2767. doi: 10.1021/jo01261a064.
[11] ROY S, PAUL S, ROY M, et al. Pyridinium boranephosphonate modified DNA oligonucleotides [J]. J Org Chem, 2017, 82(3): 1420– 1427. doi: 10.1021/acs.joc.6b02599.
[12] MARTÍNEZ-MONTERO S, FERNÁNDEZ S, RODRÍGUEZ-PÉREZ T, et al. Improved synthesis and isolation of 2′--methyladenosine: Effective and scalable enzymatic separation of 2′/3′--methylade- nosine regioisomers [J]. Eur J Org Chem, 2009, 2009(19): 3265–3271. doi: 10.1002/ejoc.200900348.
[13] TIAN H, DENG Y R, ZHOU K, et al. Chemical constituents ofvar.[J]. Chin Exp Trad Med Form, 2016, 22(7): 70–73. [田华, 邓雁如, 周坤, 等. 蒙古黄芪的化学成分研究[J]. 中国实验方剂学杂志, 2016, 22(7): 70–73. doi: 10. 13422/j.cnki.syfjx.2016070070.]
[14] CHO H K, SUH W S, KIM K H, et al. Phytochemical constituents ofand their effects on NGF induction [J]. Nat Prod Sci, 2014, 20(2): 95–101.
[15] KOMATSU M, TOMIMORI T, HATAYAMA K, et alStudies on the constituents ofspecies, II. Constituents ofCHUN et T. CHEN: (2). Isolation and structure of new flavor- noids, sophoradochromene and sophoranochromene [J]. Chem Pharm Bull, 1970, 18(4): 741–745. doi: 10.1248/cpb.18.741.
[16] CUI B L, NAKAMURA M, KINJO J, et al. Chemical constituents of[J]. Chem Pharm Bull, 1993, 41(1): 178–182. doi: 10. 1248/cpb.41.178.
[17] DU G S, CAI X H, SHANG J H, et al. Non-alkaline constituents from the leaf of[J]. Chin J Nat Med, 2007, 5(4): 259–262. [杜国顺, 蔡祥海, 尚建华, 等. 灯台叶中的非碱性成分[J]. 中国天然药物, 2007, 5(4): 259–262. doi: 10.4268/cjcmm20140116.]
[18] NIU Y, WANG S F. A new phthalide fromRadix [J].China J Chin Mat Med, 2014, 39(1): 80–82. [牛研, 王书芳. 当归中一个新苯酞类化合物[J]. 中国中药杂志, 2014, 39(1): 80–82.]
[19] WANG X, WEI Y, TIAN W Y, et al. Characterization of nine compounds isolated from the acid hydrolysate ofHsu et S. C. Cheng and evaluation of theiractivity towards HIV protease [J]. Molecules, 2019, 24(24): 4526. doi: 10. 3390/molecules24244526.
[20] YANG X, LI Y H, LV R L, et al. Study on the multitarget mechanism and key active ingredients of herba siegesbeckiae and volatile oil against rheumatoid arthritis based on network pharmacology [J]. Evid Based Compl Alternat Med, 2019, 2019: 8957245. doi: 10.1155/ 2019/8957245.
[21] DING P L. Comparative studies on the chemical constituents ofroots and[D]. Shanghai: Fudan University, 2004. [丁佩兰. 山豆根和苦参化学成分的比较研究 [D]. 上海: 复旦大学, 2004.]
[22] PAN Q M, ZHANG G J, HUANG R Z, et al. Cytisine-type alkaloids and flavonoids from the rhizomes of[J]. J Asian Nat Prod Res, 2016, 18(5): 429–435. doi: 10.1080/10286020.2015. 1131680.
[23] LI Q P, MIAO J H, SONG Z J, et al. Research on non-alkaloids of[J]. Mod Chin Med, 2018, 20(9): 1169–1178. [李秋萍, 缪剑华, 宋志军, 等. 山豆根非生物碱化学成分研究进展 [J]. 中国现代中药, 2018, 20(9): 1169–1178. doi: 10.13313/j.issn.1673- 4890.20180502001.]
[24] LAN Y S, YANG R Y, LI Y, et al. The progress of research on chemical composition and pharmacological activity in[J]. J Chuzhou Univ, 2010, 12(2): 48–51. [兰艳素, 杨瑞云, 李远, 等. 山豆根的化学成分和药理活性研究进展 [J]. 滁州学院学报, 2010, 12(2): 48–51. doi: 10.3969/j.issn.1673-1794.2010.02.017.]
Chemical Constituents with Anti-HIV Activities from the Roots of
WEI Xin, ZHANG Wei, YANG Xin, WANG Ju, ZHANG Liyan, WEI Ying, ZHOU Ying*
(Guizhou University of Traditional Chinese Medicine,Guiyang 550025, China)
In order to study the anti-HIV protease activity and molecular docking mechanism ofroots, the chemical constituents from roots were isolated by silica gel, MCI and Sephadex LH-20. HIV protease was used to screen the compounds against HIV, and molecular docking was used to preliminarily explore the binding mechanism between the active compounds and HIV-1 protease. The results showed that eight compounds were isolated fromroots. Based on spectral data, their structures were identified as trifolirhizin (1), matrine (2),-acetylnicotinamide (3), 2′--methyladenosine (4), calycosin-7---d-glucoside (5), roseoside (6), sophoranochromene (7), and ononin (8). Besides,two plasticizer derivatives were also obtained as(2-ethylhexyl)benzene-1,2-dicarboxylate (9) and disobutyl phthalate (10). The IC50values of compounds 1 and 2 are 13.2 and 38.6g/mL, respectively. Molecular docking showed that it had certain binding effect with HIV protease. Compounds 3-5 were isolated from this plant for the first time, while compounds 1 and 2 exhibited moderate anti-HIV activities
; Chemical constituents; Isolation and identification; Anti-HIV-1 protease activity; Molecular docking
10.11926/jtsb.4599
2021-12-23
2022-03-30
国家重点研发计划项目(2018YFC1708100);贵州省教育厅创新群体项目(KY[2021]018);贵州中医药大学科研创新和探索专项(2018YFC170810208);贵州省科技计划项目(ZK[2023]430)资助
This work was supported by Program for National Key Research and Development of China (Grant No. 2018YFC1708100), the Project for Innovation Group in Department of Education of Guizhou (Grant No. KY[2021]018), the Project for Scientific Research Innovation and Exploration of Guizhou University of Traditional Chinese Medicine (Grant No. 2018YFC170810208), and the Project for Science and Technology Plan in Guizhou (Grant No. ZK[2023]430).
魏鑫(1988年生),男,博士,主要从事植物活性成分研究。E-mail: sfweixin@163.com
. E-mail: yingzhou71@sina.com

