养殖池塘底泥中恩诺沙星对氮转化的影响
刘立早,张玉平,张玲玲
(上海市水产研究所,上海市水产技术推广站,上海 200433)
氮作为水生生态系统的重要营养元素,是其中新陈代谢的关键元素之一[1]。由于底泥是水生生态系统中氮的重要源和汇[2],所以现有的氮素在底泥-间隙水-上覆水之间的迁移转化研究中,多以大湖、海湾作为研究对象,较少涉及水产养殖池塘这种浅水塘的底泥氮转化研究。水产养殖池塘底泥中氮含量过高,会引起池塘水中氨氮含量升高,从而可能对养殖生物的生长构成威胁[3]。微生物在氮转化过程中起到重要作用,如厌氧氨氧化细菌、硝化细菌和反硝化细菌等,微生物的硝化、反硝化作用已被证实是池塘底泥中氮转化的主要机制[4]。
为减少水产养殖生物生病,提高养殖经济效益,抗生素在养殖过程中被大量甚至过度使用[5],过量使用的抗生素最终会沉降并吸附在底泥中。恩诺沙星(ENR)属于最常用的氟喹诺酮类抗生素,在水产养殖过程中被广泛使用。对珠江口水产养殖区的调查显示,在4大类抗生素中,氟喹诺酮类抗生素的残留浓度和检出率最高,在底泥检出率高于80%,其中又以ENR占比最高[6]。残留于水产养殖池塘底泥中的ENR可能会抑制氮转化功能微生物的生长,从而影响水产养殖环境中的氮转化过程。研究表明,在用木屑生物反应器处理污水时,ENR 会对污水中的反硝化作用产生阶段性抑制作用[7]。在用厌氧氨氧化工艺处理养猪废水时,废水里的 ENR 短期和长期作用均会对厌氧氨氧化细菌产生抑制作用,且抑制作用的强弱与其浓度有关[8]。目前,ENR影响氮转化微生物方面的研究主要集中在可调控的污水处理装置中,而在有机质含量高且厌氧的养殖池塘底泥中,ENR影响氮形态转化方面的研究还比较缺乏。因此,残留于池塘底泥中的 ENR 引起研究者高度重视,可能对底泥中的氮转化过程及功能微生物产生影响。
本研究采用室内静态模拟的方法,在池塘底泥中添加不同含量的ENR,通过分析池塘底泥和间隙水中的氮形态变化,及底泥中氮转化基因的绝对含量变化,探讨水产养殖池塘底泥中不同含量ENR残留对氮转化过程的影响。
1 材料与方法
1.1 研究方法
试验设置1 个对照组和3 个处理组,每个试验组3个平行,编号为对照组、T1、T2和T3,3 个处理组分别添加恩诺沙星(ENR),检测含量分别为(1.29±0.15)、(2.06±0.27)、(4.13±0.64)mg/kg,在每个柱子底泥中间高度位置水平放置间隙水采样器,水箱加水至水深60 cm,如图1所示。试验在温室大棚中进行,透光性良好,避免降雨对试验造成的影响,试验周期为2021年4月27日至6月30日,水温为19.9 ℃~32.3 ℃。

①液面;②间隙水采样器;③底泥
1.2 样品分析


底泥样品中氮转化功能基因含量通过荧光定量PCR分析,由上海美吉生物医药科技有限公司(上海,中国)检测完成。称取0.5 g底泥样品,提取底泥氮转化DNA。用Nano-Drop核酸蛋白仪(NanoDropOne,Thermo,美国)和10 g/L的琼脂电泳测定DNA质量,将通过质量检测的DNA样品于-20 ℃冰箱保存,备用。测定的16S rRNA功能基因片段包括Bacterial、Archaeal、anammox、amoA、nxrA、narG、nirK、nirS、nosZ。所用仪器为荧光定量PCR仪(ABI 7300,Applied Biosystems,美国),扩增效率为89%~110%,且R2>0.99时默认数据合格,氮转化功基因引物序列信息见表1。

表1 氮转化功能基因引物序列信息Table 1 Primers for nitrogen transformation genes
1.3 数据统计分析
试验数据均使用Excel 2016处理,采用SPSS statistics 19.0对数据进行统计分析和方差分析(LSD,P<0.05),图表使用origin 8.0制作。
2 结果与分析
2.1 底泥中不同形态氮含量变化
处理前底泥中4 种形态氮分布特征如图2所示,含量大小表现为SAEF-N(39.57%)>IEF-N(35.35%)>SOEF-N(18.30%)>WAEF-N (7.13%)。处理前IEF-N含量为(164.42± 21.52)mg/kg,占TF-N比例为34.84%,处理后降至(49.24±4.51)~(62.21±8.04)mg/kg,占比降为14.78~21.48%。IEF-N属于不稳定氮,很容易进入水体中[11]。试验中底泥完全被上覆水覆盖,在处理过程中较易与上覆水发生交换,这可能是导致IEF-N明显降低的原因[12]。
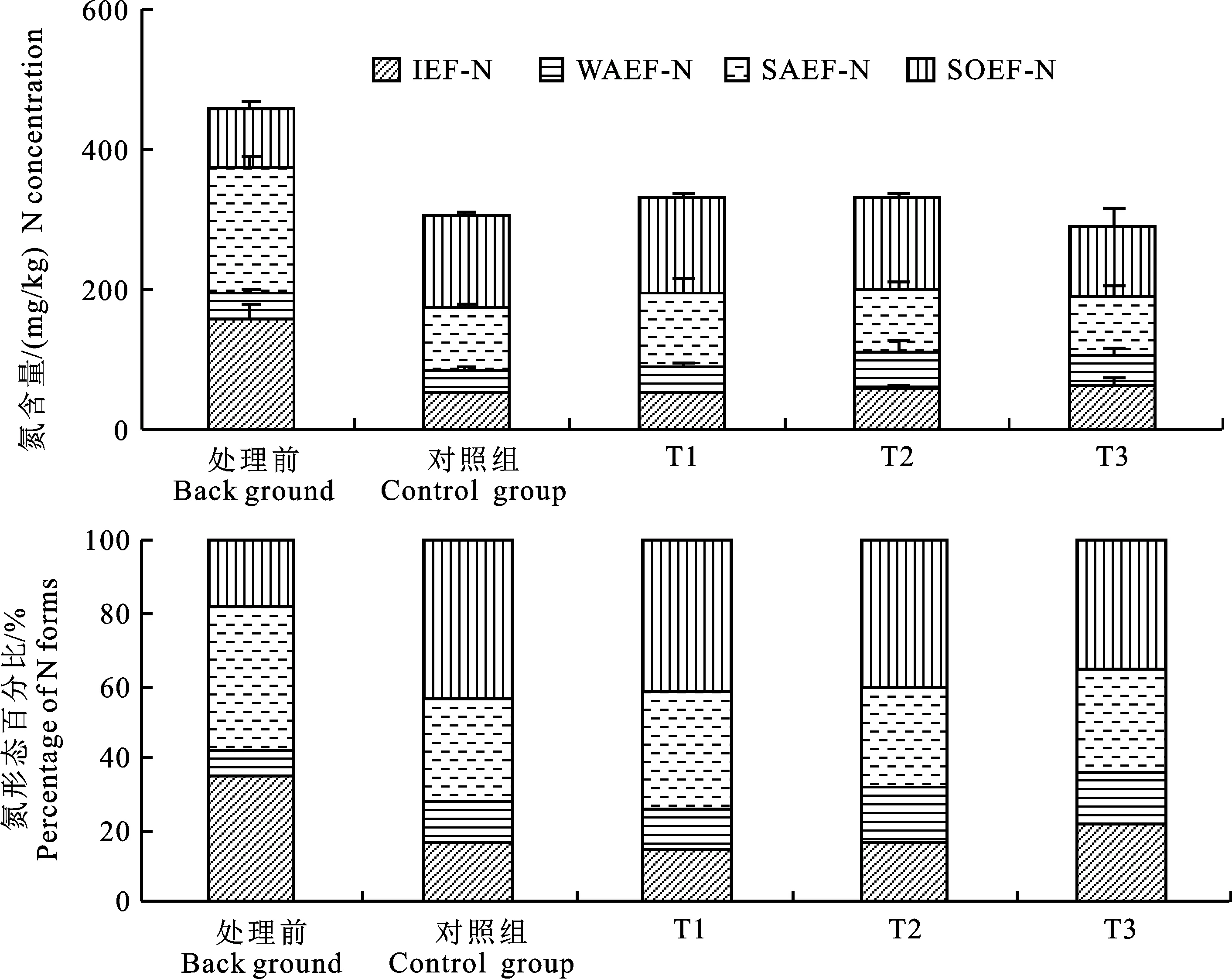
图2 底泥中4 种提取态氮含量Fig.2 Four forms of extractable nitrogen in sediment

图3 不同浓度恩诺沙星下底泥中三态氮含量Fig.3 Content of three forms of nitrogen in sediment under different ENR concentrations

图4 恩诺沙星影响底泥中硝化功能基因含量Fig.4 Absolute abundance of nitrification functional genes in sediment under effects of ENR
WAEF-N是TF-N中含量最低的氮形态。处理前WAEF-N含量为(33.25±8.80)mg/kg,占TF-N比例为7.27%,处理后的WAEF-N含量为(34.82±8.37)~(54.33±16.70)mg/kg,占TF-N比例上升到11.26~15.51%。WAEF-N含量主要与底泥中的碳酸盐环境有关。本试验中除了对间隙水采样以外,基本没有对底泥扰动,碳酸盐环境较为稳定。
SAEF-N易从还原态底泥中释放[13]。由图2可知,处理前的SAEF-N含量均值为(182.07±14.58)mg/kg,是TF-N中最主要的赋存形态,占比达39.80%。经过处理之后,各组SAEF-N含量下降为(83.82±13.21)~(108.42±22.25)mg/kg,占TF-N的比例下降为26.93%~ 32.59%,其中T2、T3处理组的下降最为明显。SAEF-N的形成和分布主要由底泥的氧化还原环境控制[14],一般认为还原环境则会促进SAEF-N释放活动。由于本研究中底泥均处于较强的还原环境,有利于SAEF-N向水体释放。而T2、T3处理组中SAEF-N下降较多可能是因为更为强烈的反硝化作用,反映在反硝化基因中T2和T3的反硝化基因丰度更高(图5)。
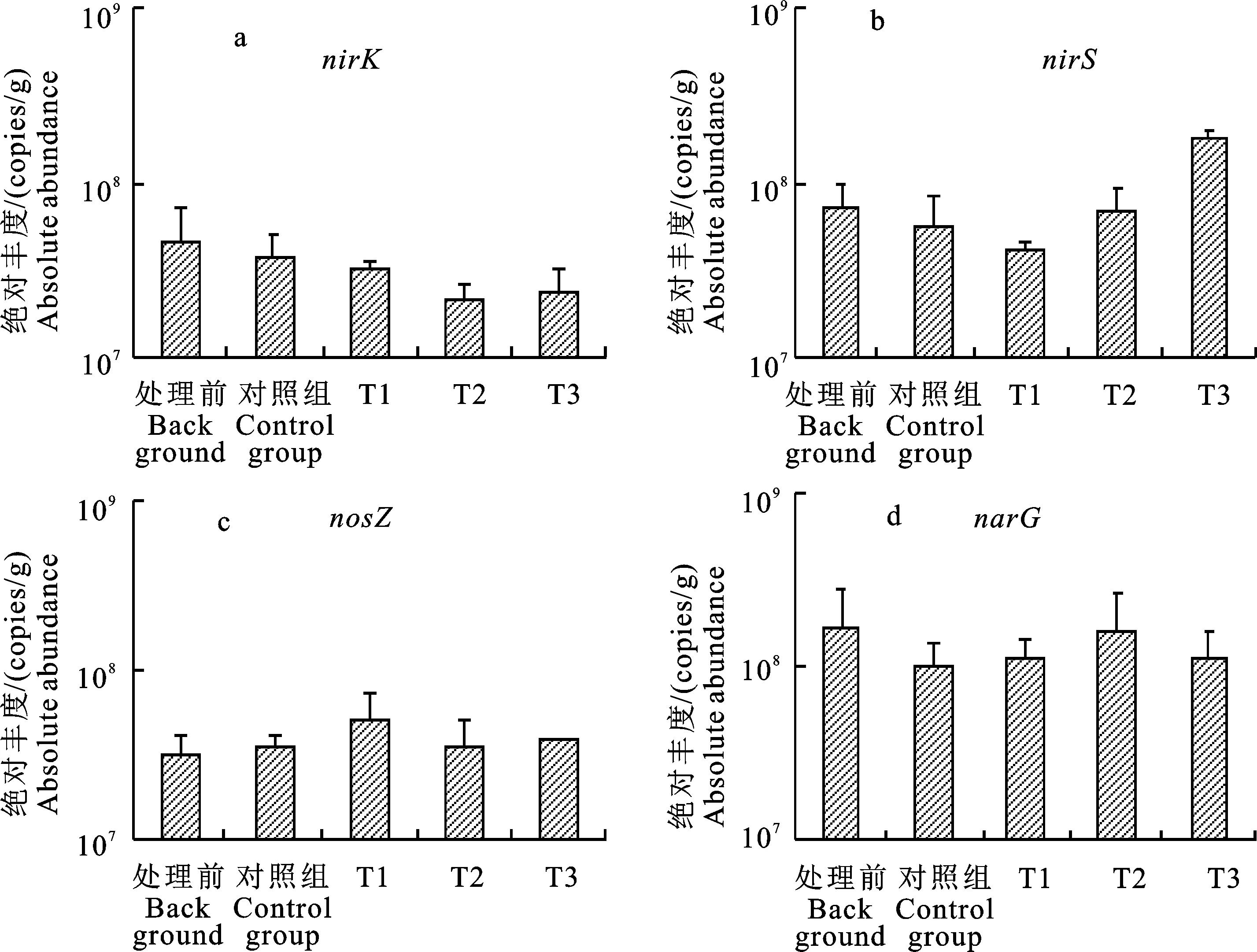
图5 底泥中反硝化功能基因绝对丰度Fig.5 Absolute abundance of denitrification functional genes in sediment
SOEF-N处理前含量为(84.20±7.77) mg/kg,占TF-N的比例为18.30%。处理后SOEF-N含量为(101.77±23.48)~(137.83± 4.46)mg/kg,SOEF-N变为占比最高的氮形态,上升为34.85%~43.43%。SOEF-N是有机形态氮,释放能力最弱,一般只有在氧气和好氧微生物存在的情况下才会释放,是最难参与氮循环的形态[15]。
2.2 恩诺沙星对底泥中氮转化功能微生物的影响
2.2.1 细菌及古菌丰度 底泥中细菌(bacterial)绝对丰度从处理前(7.07×109)copies/g减少为处理后(3.68×109~6.95×109)copies/g,各处理组均有所下降,但差异并不显著(P>0.05)。而底泥中古菌(archaeal)的绝对丰度则比bacterial低两个数量级,从处理前(7.21×107)copies/g变为处理后(4.36×107~7.54×107)copies/g,其中T3明显低于其余各处理组(P<0.05),可能较高的ENR含量对古菌(archaeal)有抑制作用。有研究表明,尽管古菌在微生物群落中的丰度不高,但是在氮的转化过程中起着重要作用[17]。
2.2.2 底泥中氨氧化细菌及硝化细菌 7种氮转化功能基因在底泥中的背景丰度为1.05×109copies/g,ENR处理后对照组、T1、T2和T3底泥中氮转化相关功能基因的绝对丰度分别为 8.71×108、6.14×108、9.66×108和7.65×108copies/g,各处理组间未见明显差异(P>0.05)。其中anammox基因是相对丰度最高的,占比达 60.0%~78.4%。可见厌氧氨氧化作用是底泥中微生物转化氮的主要途径。


2.2.3 底泥中反硝化细菌 微生物反硝化作用由多种厌氧或兼性厌氧微生物参与的系列酶催化反应组成,包括亚硝酸还原酶(Nir)、氧化亚氮还原酶(Nos)和硝酸还原酶(Nar)等,相应的编码基因分别为nirK或nirS、nosZ、narG[23]。



2.3 间隙水中三态氮变化趋势


图6 底泥间隙水中的氮含量Fig.6 Nitrogen concentrations in pore water of sediment

