西澳菲斯特农场赤桉蜂蜜对大肠埃希菌腹泻小鼠模型的影响
张雷雷 林韦康
摘 要:目的:为了探讨西澳菲斯特农场赤桉蜂蜜(Fewsters Farm Jarrah Honey,FFJH)改善大肠埃希菌腹泻小鼠肠道的作用效果。方法:采用大肠埃希菌注射塑造相关性腹泻小鼠模型,分为正常组、模型组、诺氟沙星组、市售蜂蜜组、FFJH组,成功建模后测定各组小鼠腹泻率、腹泻指数、体质量、小肠推进率和血清胃肠激素含量。结果:相对于正常组,模型组小鼠腹泻指数明显增加(P<0.01);相对于模型组,诺氟沙星组、市售蜂蜜高剂量组、FFJH低中高剂量组小鼠腹泻指数均有所减少,有显著性差异(P<0.01);相比模型组,FFJH低中高剂量组体质量有显著性差异(P<0.01);FFJH中高剂量组MTL含量明显升高(P<0.01);FFJH中高剂量组显著降低了小鼠血清VIP含量(P<0.01)。结论:FFJH对大肠埃希菌腹泻有显著效果,可通过调节小鼠肠道环境和修复肠道微生态,改善小鼠腹泻的临床症状。
关键词:西澳菲斯特农场赤桉蜂蜜;大肠埃希菌;小鼠腹泻模型
Abstract: Objective: In order to explore the effect of Fewsters Farm jarrah honey on improving the intestinal tract of mouse with Escherichia coli diarrhea. Method: The model of diarrhea related mouse was established by injection of Escherichia coli, which was divided into normal group, model group, norfloxacin capsule group, commercially available honey group, and FFJH group. After successful modeling, the diarrhea mouse, diarrhea index, body mass, small intestine propulsion mouse and serum gastrointestinal hormone content of mouse in each group were determined. Result: Compared with the normal group, the diarrhea index of the model group was significantly increased (P < 0.01) , while compared with the model group, the diarrhea index of the Norfloxacin group, the high dose honey group and the low, middle and high dose FFJH group were decreased, compared with the model group, the body weight of FFJH low, middle and high dose group had significant difference (P < 0.01) . The content of MTL in high dose FFJH group was significantly increased (P < 0.01) , and the content of VIP in serum was significantly decreased in high dose FFJH group (P < 0.01) . Conclusion: FFJH has significant effect on diarrhea caused by Escherichia coli. It may improve the clinical symptoms of diarrhea in mouse by regulating the intestinal environment and repairing intestinal microecology.
Keywords: Fewsters Farm jarrah honey; Escherichia coli; mouse diarrhea model
腹瀉是全球范围内的公共卫生问题,人群患病范围广,发病率较高,同时在我国卫生疾控方面被列为重点防治的疾病之一[1]。长期研究表明,肠道微生态平衡环境对机体的健康有着重要的影响[2],机体的肠道疾病也可能与其肠道微生态平衡紊乱有着密切联系[3]。抗生素能够杀死敏感病原菌,但也会破坏机体肠道中菌群环境平衡,甚至影响正常的新陈代谢[4],进而引发肠道的正常消化功能紊乱和机体免疫力下降,并伴有腹泻等症状[5]。
蜂蜜的使用范围较广。蜂蜜可以通过抗菌性能缓解炎症,还可以修复肠道黏膜,改善肠道微生态,使其达到平衡状态[6-7]。桉树蜜呈深琥珀色,新鲜蜜桉醇味较浓,对跌打损伤、痈肿疮疡及抗感染等有较高的药用价值[8]。
1 材料与方法
1.1 实验药品及试剂
西澳菲斯特农场赤桉蜂蜜(Fewsters Farm Jarrah Honey,FFJH);致病性大肠埃希菌;小鼠血管活性肠肽(VIP)ELISA试剂盒;小鼠胃动素(MTL)ELISA试剂盒;诺氟沙星。
1.2 实验仪器
XPR电子分析天平;BX63-CellSens型全电动智能显微镜;BIO-RAD680型酶标仪;Wellwash Versa双排全自动洗板机。
1.3 实验动物
C57BL/6小鼠,雄性,SPF级,个体质量(20±2) g,6~8周龄,动物在(23±1)℃的环境中,在相对湿度55%±15%、12 h的光/暗循环条件下,可以自由取食和饮水。
1.4 实验方法及检测指标
1.4.1 FFJH对小鼠体重、腹泻率、腹泻指数的影响
实验将C57BL/6 雄性小鼠随机分为9组,每组15只,分别为正常组,造模组,诺氟沙星组,市售蜂蜜低剂量组、中剂量组、高剂量组,FFJH低剂量组、中剂量组、高剂量组。除正常小鼠,其余各组均于腹腔注射0.4 mL 5×108 CFU·mL-1的大肠埃希菌溶液,连续给药3 d。造模小鼠出現精神萎靡、活动减少、肛周污秽、便溏,即可视为造模成功。
造模成功后开始给药,正常组市售蜂蜜和模型组市售蜂蜜小鼠给予相同体积的生理盐水,其他各组小鼠可根据实验分组设计给予不同药物,每日给药1次,给药体积0.4 mL,连续15 d。实验分组情况为诺氟沙星组(0.56 mg·kg-1)、市售蜂蜜低(20%)、中(40%)、高(80%)剂量组和FFJH低(20%)、中(40%)、高(80%)剂量组。给药15 d后,记录小鼠体重。
依照《药理实验方法学》(第4版)[9],分别测定实验第0 d、1 d、3 d、5 d、7 d、9 d小鼠腹泻率。观察各组小鼠注射大肠埃希菌后4 h内的排便情况并记录[10],并根据实验分组计算腹泻指数,计算公式如下。
腹泻率=腹泻动物数/该组动物总数×100%;腹泻指数=稀便率×平均稀便级。
1.4.2 FFJH对小鼠小肠推进率的影响
通过注射大肠埃希菌溶液,建立小鼠腹泻模型,计算给定时间内小肠内部的碳末的推进率,以此评判模型小鼠的胃肠蠕动功能水平[11]。小鼠同1.4.1方法处理,除正常组,在其他小鼠最后一次给药0.5 h后,灌胃0.2 mL 5%碳末悬液。灌胃结束1 h后,脱颈处死小鼠,打开腹腔,取自幽门至回盲部的肠管部分,放置于托盘上,轻拉成一条直线,小肠总长度通过测量肠管长度得出,计算小肠碳末推进率。
1.4.3 FFJH对小鼠血清胃肠激素的影响
给药周期结束后,小鼠在禁食12 h,通过摘去眼球取血,静置1.5 h,以3 000 r·min-1 离心10 min,分离血清于-20 ℃冰箱留存。根据ELISA试剂盒的相关说明书测定胃动素(Motilin,MTL)、血管活性肠肽(Vasoactine Intrestinal Peptide,VIP)含量。
2 结果与分析
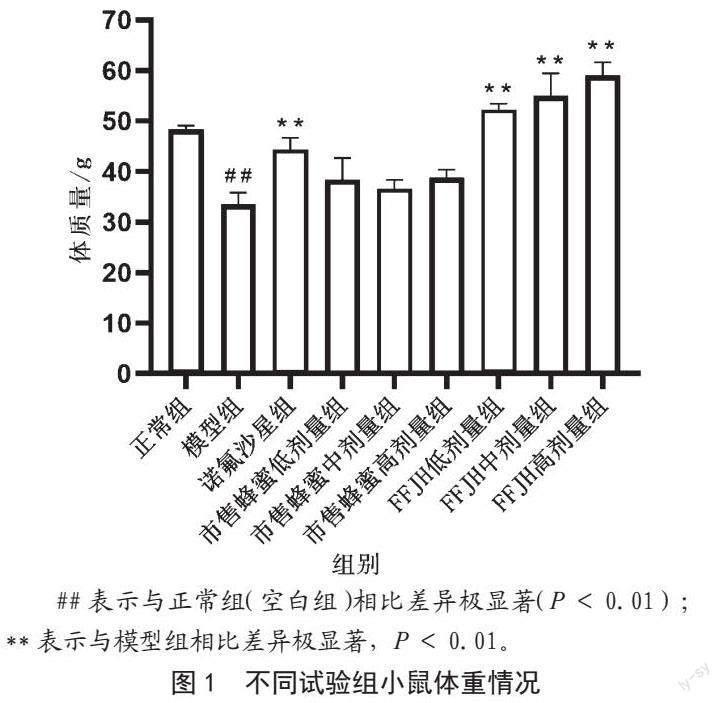
2.1 FFJH对大肠埃希菌腹泻小鼠模型小鼠体重的影响
FFJH对大肠埃希菌腹泻小鼠模型小鼠体重的影响如图1所示。模型组小鼠注射大肠埃希菌之后,进食量、饮水量均减少,精神萎靡,被毛散乱无光泽,肛周毛发被稀便污染,实验结束后小鼠体重较正常组显著降低(P<0.01),出现了明显的腹泻现象。相比模型组,FFJH低、中、高剂量组小鼠饮食及活动显著增加(P<0.01),精神状态好转,肛周毛发较干净,腹泻症状减轻。这些结果表明FFJH对大肠埃希菌腹泻小鼠具有一定的修复作用。
##表示与正常组(空白组)相比差异极显著(P<0.01);**表示与模型组相比差异极显著,P<0.01。
2.2 FFJH对小鼠腹泻率和腹泻指数的影响
2.2.1 FFJH对小鼠腹泻率的影响
造模小鼠3 d后开始出现活动减少、精神萎靡、肛周污秽、便溏的现象。模型组,诺氟沙星组,市售蜂蜜中、高剂量组,FFJH低、中、高剂量组腹泻率均为100%,市售蜂蜜低剂量组腹泻率为90%,认为塑造大肠杆菌腹泻小鼠模型成功。实验第5 d,模型组小鼠腹泻率为80%,市售蜂蜜低、中、高剂量组小鼠腹泻率为80%,FFJH低剂量组小鼠腹泻率均为80%,FFJH中、高剂量组小鼠腹泻率为70%。实验第9 d,各给药组小鼠情况逐渐好转,仅有市售蜂蜜低剂量组和模型组小鼠存在腹泻现象,其精神仍旧萎靡,活动较少。
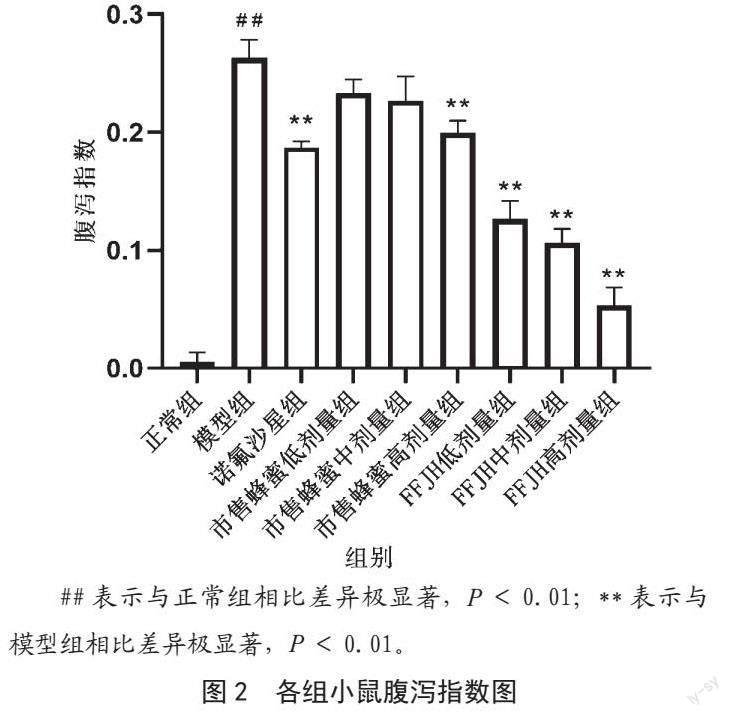
2.2.2 FFJH对小鼠腹泻指数的影响
由图2可知,相对于正常组,模型组小鼠的腹泻指数显著增加(P<0.01),说明造模成功。相对于模型组,诺氟沙星组,市售蜂蜜高剂量组,FFJH低、中、高剂量组小鼠的腹泻指数均有显著减少(P<0.01)。
##表示与正常组相比差异极显著,P<0.01;**表示与模型组相比差异极显著,P<0.01。
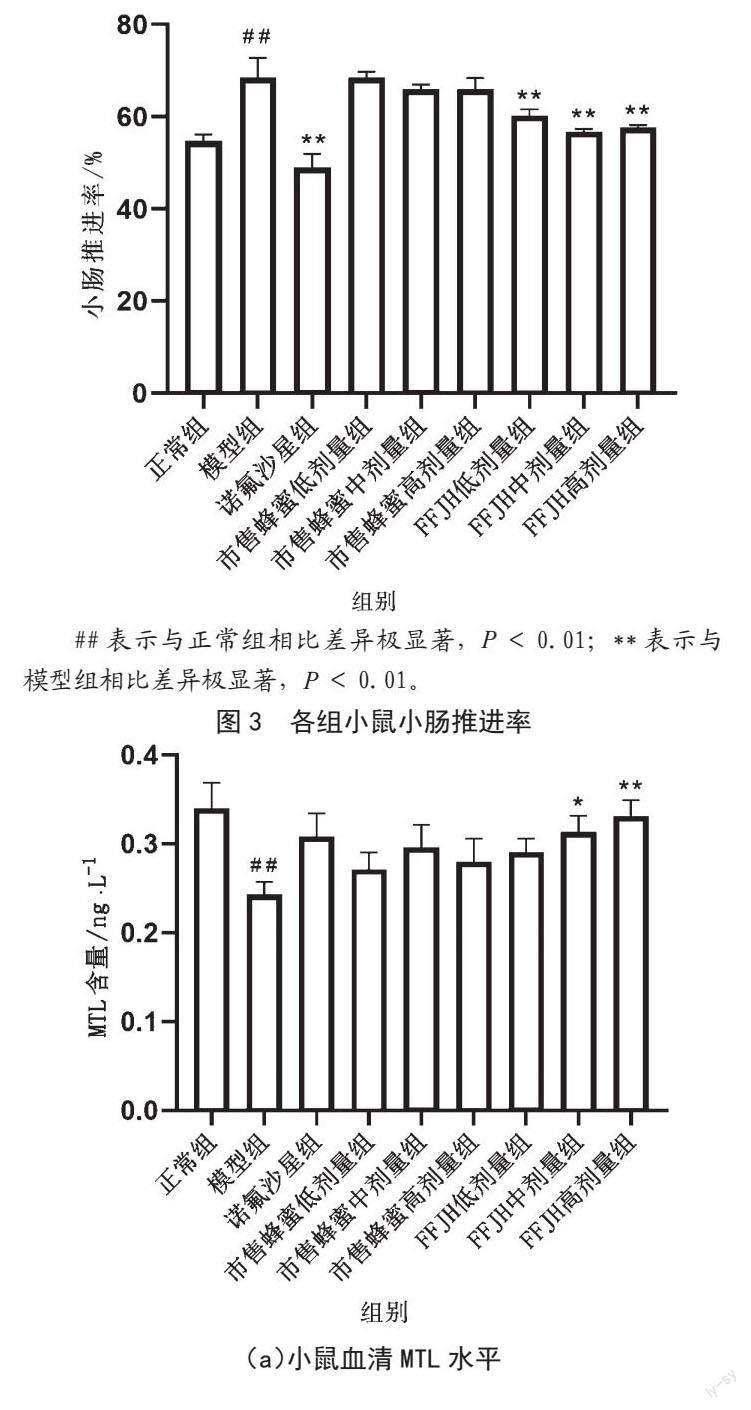
2.3 FFJH对小鼠小肠推进率的影响
由图3可知,与正常组相比,模型组碳末推进率显著增高(P<0.01),说明腹泻模型制备成功。与模型组相比,诺氟沙星组,FFJH低、中、高剂量可显著降低模型小鼠的小肠推进率(P<0.01),说明FFJH在腹泻条件下能显著改善鼠肠道环境。
##表示与正常组相比差异极显著,P<0.01;**表示与模型组相比差异极显著,P<0.01。
2.4 FFJH对小鼠血清胃肠激素的影响
由图4可知,与正常组相比,模型组小鼠的血清MTL含量出现显著降低,VIP含量显著升高(P<0.01);与模型组相比,FFJH中剂量组MTL含量明显升高(P<0.05),FFJH高剂量组MTL含量显著升高(P<0.01);与模型组相比,诺氟沙星组、FFJH中剂量组和FFJH高剂量组显著降低了小鼠血清VIP含量(P<0.01),市售蜂蜜低、中、高剂量组和FFJH低剂量组可明显降低小鼠血清VIP含量(P<0.05),提示FFJH具有一定改善消化道环境的作用。
3 结论与讨论
综上所述,本试验采用注射大肠埃希菌溶液,采用大肠埃希菌注射塑造相关性腹泻小鼠模型,通过测定各组小鼠体质量、腹泻率和腹泻指数、小肠推进率和血清胃肠激素含量,发现FFJH可以改善大肠杆菌所致腹泻小鼠的体重、腹泻率及血清胃肠激素等相关指标,对机体有一定的修复作用。本研究也存在一定不足之处,实验虽然证明了FFJH可以通过其专用特性及改善肠道微生态能够改善腹泻,却并未对肠道微生态调节相关的具体的发生机制进一步探究。
参考文献
[1]张强,林菲菲,罗顺斌,等.2015—2019年丽水地区细菌性腹泻病原分布及耐药性分析[J].上海预防医学,2022,34(9):879-883.
[2]单子鸿,李情情,王舒颖,等.粪便钙卫蛋白联合血清降钙素原对儿童细菌感染性腹泻和病毒感染性腹泻的鉴别诊断价值[J].国际检验医学杂志,2021,42(24):3018-3021.
[3]王柳,李淑芳.炎调方对脓毒症大鼠肠道微生态环境的影响研究[J].中国中医急症,2021,30(11):1916-1919.
[4]刘芬,谢思玲,刘振云,等.六堡茶水提物对小鼠腹泻及肠道菌群的影响[J].食品安全质量检测学报,2021,12(23):9165-9170.
[5]高健梅.呼吸系统危重症患者抗生素相关腹泻的临床观察[J].中国医药指南,2017,15(3):52-53.
[6]傅骏青,于艳艳,田洪芸,等.我国蜂蜜抽检中真实性检验标准现状[J].食品工业,2022,43(11):242-246.
[7]刘相坤.养蜂须知:蜂蜜的作用[J].中国蜂业,2020,71(2):23.
[8]欧阳军.不同蜜源蜂蜜的医疗保健功效[J].中国蜂业,2018,69(12):50-52.
[9]WEI W,WU X M,LI Y.Experimental methodology of pharmacology[M].Beijing: Peoples Medical Publishing House,2010.
[10]曹玲芝,马利芹,王丽叶,等.建立动物腹泻模型的研究进展[J].安徽农业科学,2008,36(26):11383-11385.
[11]姜雪萍,谷仿丽,刘枫,等.水苏多糖对小鼠胃肠道调节作用研究[J].皖西学院学报,2016,32(2):16-18.

