双能量CT 定量参数联合形态学特征在乳腺癌腋窝淋巴结转移诊断中的应用价值
吴天斌,林桂涵,陈炜越,陈春妙,应海峰,纪建松
1.温州医科大学第五医院/浙江省丽水市中心医院/浙江大学丽水医院放射科,浙江 丽水323000 2.浙江省影像诊断与介入微创研究重点实验室,浙江 丽水323000
乳腺癌是全球最常见的恶性肿瘤,也是女性癌症死亡的首要原因[1]。腋窝淋巴结转移(axillary lymph node metastasis,ALNM)是乳腺癌转移的主要途径,术前识别ALNM 状态对乳腺癌预后评估、分期和治疗方案制订具有重要的参考价值[2]。常规影像学检查主要通过形态学特征来评估ALNM 状态,但受观察者经验等影响,存在敏感度较低、易漏诊等不足[3]。双能量CT 是一种新兴的功能成像技术,其既能显示常规CT 特征的改变,还可量化反映组织在能量学范畴的差异,提供诸多反映生物学特性的定量参数[4]。本研究旨在探讨双能量CT 定量参数联合形态学特征鉴别乳腺癌ALNM 的价值,以期为临床诊疗工作提供依据。
1 资料与方法
1.1 一般资料
回顾性收集2019 年10 月至2022 年8 月在我院经术后病理证实为乳腺癌的135 例患者。纳入标准:①行腋窝淋巴结清扫术并获得病理结果;②术前2 周内行双能量CT 检查;③未接受放疗、化疗及内分泌治疗等。排除标准:①合并其他恶性肿瘤病史;②临床及病理资料不全;③淋巴结在CT 图像上不可见或较小(短径<3 mm),难以准确评估和测量。最终纳入227 枚腋窝淋巴结,根据病理结果,分为转移性淋巴结组(92 枚)和非转移性淋巴结组(135 枚)。本研究已通过医院医学伦理委员会审核。
1.2 仪器与方法
使用Siemens Somatom Force 第3 代双源CT 扫描仪。扫描范围:锁骨上缘至肺底。先行常规平扫,扫描参数:120 kV,75 mAs,层厚5.0 mm,层距5.0 mm,开启管电流调制(Care Dose 4D)。增强扫描采用高压注射器(Ulrich Missouri 公司,型号XD2001)注射对比剂碘克沙醇(碘浓度320 mg/mL,江苏恒瑞医药股份有限公司),流率2.5~3.0 mL/s,剂量1.5 mL/kg 体质量;于延迟25、55 s 行动脉期和静脉期扫描。扫描参数:管电压分别为90、Sn150 kV,管电流分别为156、92 mAs,准直器128×0.6 mm,螺距1.2,转速0.5 s/r,层厚1.5 mm,层距1.5 mm。CT 增强扫描后每个期相分别获得90 kV、Sn150 kV 和平均加权120 kV(融合系数0.5)图像。
1.3 形态学特征分析
由2 名具有10 年以上胸部影像诊断经验的主治医师采用盲法对淋巴结形态学特征进行分析,意见不一致时,由另1 名副主任医师确定最终意见。在CT 图像上观察淋巴结最大短径(≥5 mm 或<5 mm)、长短径比值(≤2 或>2)、形状(规则或不规则)、边缘(清楚或模糊)、强化程度(轻中度或明显)及淋巴门结构(消失或存在)。
1.4 双能量CT 定量参数测量
由上述2 名主治医师在后处理工作站(版本Syngo VA10B,Siemens Healthcare)上分别测量双能量CT 定量参数,取两者的平均值为最终结果。分别在“Liver VNC”和“Rho/Z”模式下测量肿瘤的碘浓度(iodine concentration,IC)和有效原子序数(effective atomic number,Zeff),并将ROI 放置于相同层面的颈动脉内。为减少患者间的差异,通过计算获得标准化碘浓度(normalized iodine concentration,NIC)和标准化有效原子序数(normalized effective atomic number,nZeff),公式如下:NIC=IC淋巴结/IC主动脉,nZeff=Zeff淋巴结/Zeff主动脉。在“Monoenergetic Plus”模式下获得肿瘤的能谱衰减曲线,并计算能谱曲线斜率(the slope of the spectral Hounsfield unit curve,λHU),公式:λHU=(CT 值40keV-CT 值100keV)/60。
为确保ROI 测量的准确性,ROI 应置于显示淋巴结的最大横截面,尽量避开钙化、坏死、囊变及病灶边缘等;肿瘤内ROI 应控制在0.5~1.0 cm2,主动脉内ROI 应包含约2/3 区域;不同模式、期相ROI 的大小、形状和位置应保持一致;所有数据均测量3 次,取平均值。
1.5 统计学分析
采用SPSS 26.0 和Medcalc 19.0 软件进行数据分析。符合正态分布的计量资料以表示,组间比较行独立样本t 检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较行非参数检验。计数资料以例表示,组间比较行χ2检验。单因素分析差异有统计学意义的指标行多因素logistic 回归分析,并构建形态学特征模型、双能量CT 定量参数模型及联合模型。采用ROC 曲线评估各模型的诊断效能,计算AUC、敏感度、特异度。各模型诊断效能的差异比较采用DeLong 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 2 组间形态学特征比较(表1)
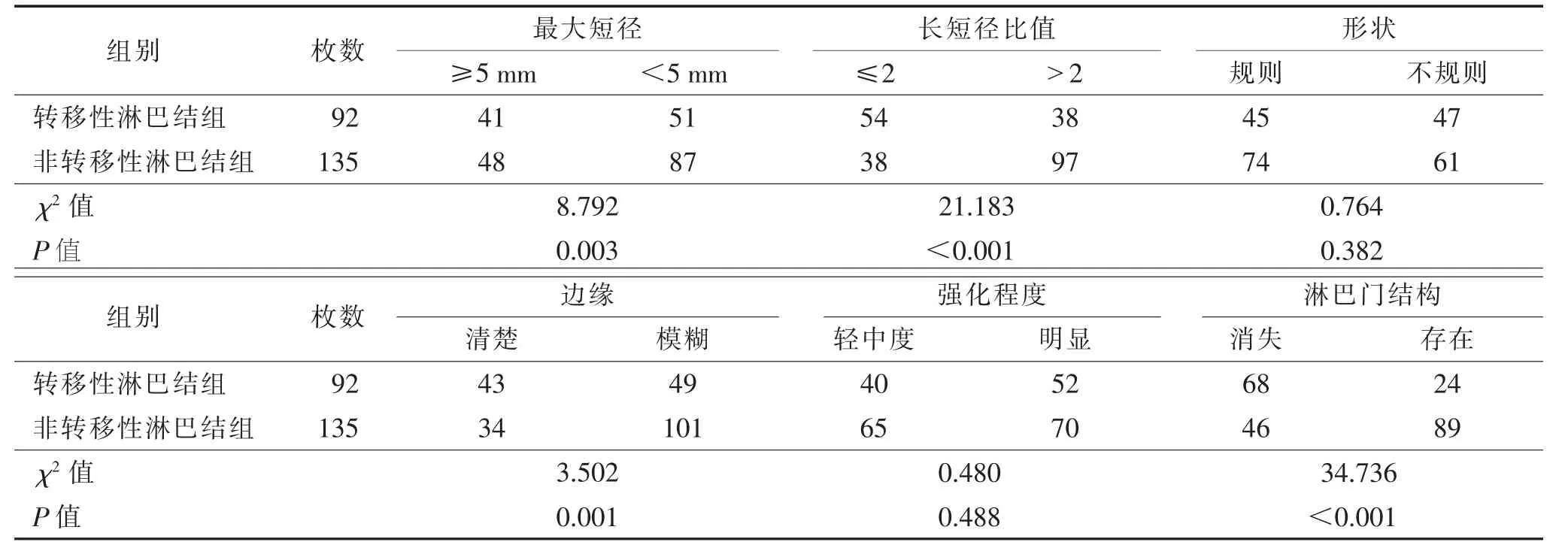
表1 转移性淋巴结组与非转移性淋巴结组形态学特征比较 枚
2 组最大短径、长短径比值、边缘及淋巴门结构差异均有统计学意义(均P<0.05);而形状和强化程度差异均无统计学意义(均P>0.05)。
2.2 2 组间双能量CT 定量参数比较(表2)
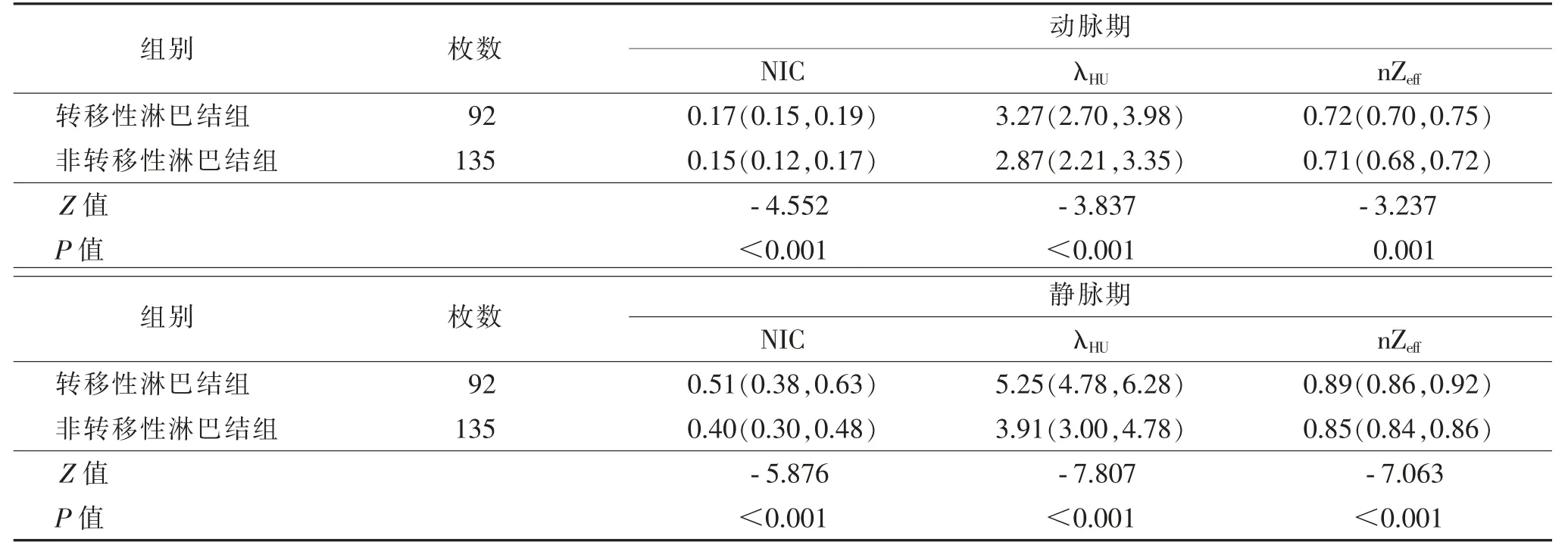
表2 转移性淋巴结组与非转移性淋巴结组双能量CT 定量参数比较[M(Q1,Q3)]
转移性淋巴结组的动、静脉期NIC、λHU及nZeff均显著高于非转移性淋巴结组(均P<0.05)。2 组的典型病例见图1,2。
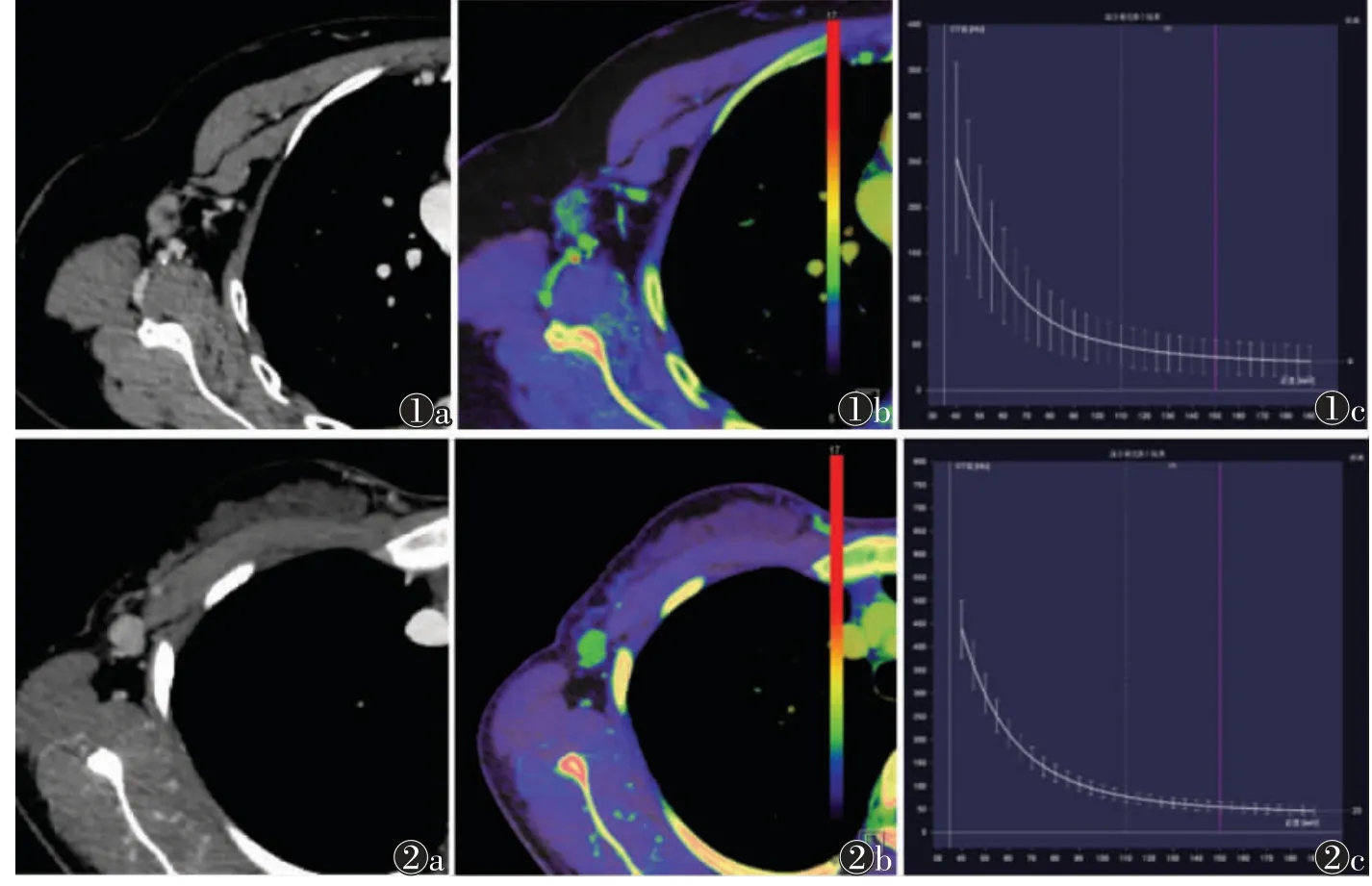
图1 非转移性淋巴结组的常规CT 及双能量CT 图像 注:患者,女,46 岁。图1a 为常规CT 图像,可见淋巴结边缘清楚,淋巴门结构存在,最大短径为11.64 mm,长短径比值为1.58;图1b 为有效原子序数(Zeff)图,测得静脉期标准化有效原子序数(nZeff)为0.84;图1c为能谱曲线图,测得静脉期能谱曲线斜率(λHU)为3.36 图2 转移性淋巴结组的常规CT 及双能量CT 图像注:患者,女,30 岁。图2a 为常规CT图像,可见淋巴结边缘清楚,淋巴门结构消失,最大短径为11.04 mm,长短径比值为1.21;图2b 为Zeff 图,测得静脉期nZeff 为0.90;图2c 为能谱曲线图,测得静脉期λHU 为5.45
2.3 各模型的构建(表3,4)

表3 多因素logistic 回归分析中变量特征赋值表
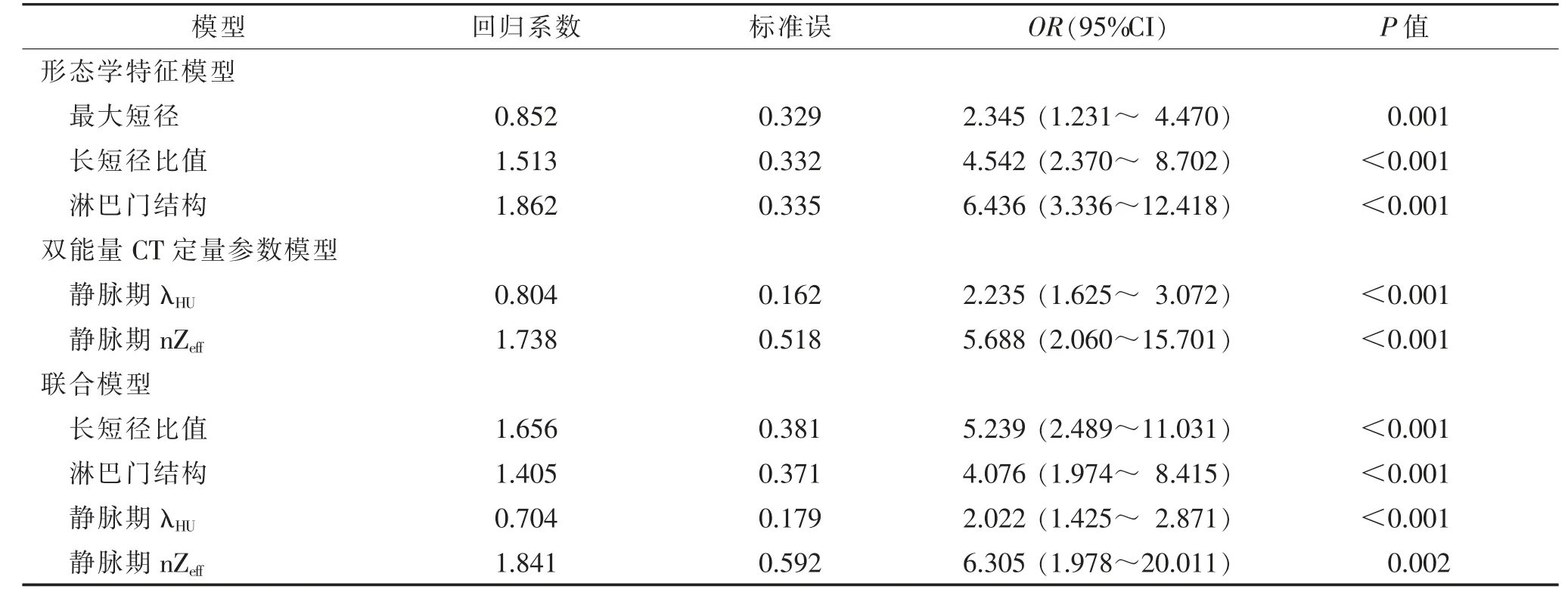
表4 基于形态学特征和/或双能量CT 定量参数诊断乳腺癌腋窝淋巴结转移的多因素logistic 回归分析结果
对2 组间差异有统计学意义的形态学特征和双能量CT 定量参数分别行多因素logistic 分析,结果显示最大短径≥5 mm、长短径比值≤2、淋巴门结构消失,以及静脉期λHU和nZeff升高是乳腺癌患者ALNM的独立预测因素。分别构建形态学特征模型、双能量CT 定量参数模型和联合模型,联合模型中独立预测因素包括长短径比值、淋巴门结构、静脉期λHU和nZeff。
2.4 各模型的诊断效能比较
采用ROC 曲线分析各模型对乳腺癌患者ALNM情况的诊断效能,结果显示形态学特征模型的AUC为0.796(95%CI 0.738~0.846),敏感度、特异度分别为59.78%、89.63%;双能量CT 定量参数模型的AUC为0.819(95%CI 0.763~0.867),敏感度、特异度分别为80.43%、71.85%;而联合模型的AUC 可达0.884(95%CI 0.834~0.922),敏感度、特异度分别为82.61%、80.00%。DeLong 检验结果显示,联合模型的诊断效能显著优于形态学特征模型和双能量CT 定量参数模型(Z=3.852,3.291;均P<0.05),而形态学特征模型和双能量CT 定量参数模型诊断效能差异无统计学意义(Z=0.732,P=0.536)(图3)。

图3 形态学特征模型、双能量CT 定量参数模型及联合模型评估乳腺癌腋窝淋巴结转移的ROC 曲线
3 讨论
腋窝淋巴结状态是影响乳腺癌患者预后的重要指标,也是决定临床治疗策略的关键因素[5]。临床评估为ALNM 阴性的乳腺癌患者,仅需行前哨淋巴结活检;阳性患者,则需行腋窝淋巴结清扫术;若患者存在多枚淋巴结转移,则推荐行新辅助治疗[6-7]。因此,目前诊断的关键在于术前评估乳腺癌患者ALNM状态,以指导治疗决策。本研究联合双能量CT 定量参数和常规形态学特征构建模型术前无创评估乳腺癌患者ALNM 状态,AUC 可达0.884,显著优于单独形态学特征和双能量CT 定量参数模型,具有较高的诊断效能和临床价值。
目前,临床上常采用传统CT 图像的淋巴结形态学特征,如最大短径、长短径比值、形状、边缘、强化程度、淋巴门结构等评估乳腺癌腋窝淋巴结状态[8-9]。本研究中最大短径、长短径比值、边缘及淋巴门结构在转移性和非转移性淋巴结组中差异均有统计学意义(均P<0.05),与既往研究报道基本一致。其中淋巴结最大短径≥5 mm 和长短径比值≤2 是临床上评估ALNM 最常用的判断标准[10]。Yang 等[11]认为,当淋巴结发生转移时,其短径延长、长短径比值缩小,整体形态趋于圆形,这在本研究中得到证实。此外,本研究显示,转移性淋巴结组中淋巴门结构消失的比例[73.9%(68/92)]显著多于非转移性淋巴结组[34.1%(46/135)],推测可能是肿瘤细胞入侵淋巴门后,CT 图像上淋巴门低密度区消失所致[12]。本研究多因素回归分析显示,淋巴结最大短径≥5 mm、长短径比值≤2 及淋巴门结构消失是预测乳腺癌患者ALNM 的独立危险因素,构建的形态学特征模型尽管诊断特异度较高(89.63%),但敏感度表现欠佳(59.78%);原因在于仅利用形态学特征来评估淋巴结状态的主观性强,且不同观察者的经验也存在差异,使得诊断准确率欠佳。因此,仅依靠形态学特征难以准确识别乳腺癌的ALNM 状态。
双能量CT 的快速发展为精准、量化评估乳腺癌ALNM 提供了一种崭新的视角。在本研究中,转移性淋巴结组动、静脉期的NIC、λHU和nZeff值均明显高于非转移性淋巴结组(均P<0.05),这与之前的研究[13-15]相似。NIC 反映了病灶对碘的摄取情况,碘浓度可用于评估淋巴结内的血供情况,因此NIC 升高可能是由于转移性淋巴结内血管生成、血容量及血管通透性增加所致[16]。不同的组织具有不同的能谱衰减曲线,从该曲线得到的λHU可作为组织表征的重要指标,有助于直接反映组织间的差异[17]。在本研究中,转移性和非转移性淋巴结组的λHU存在显著差异,这在一定程度上反映了2 种淋巴结性质的不同。此外,nZeff是双能量CT 参数中用于表征组织密度的重要指标[18]。本研究转移性淋巴结组中nZeff较高,表明转移性淋巴结内细胞结构更紧凑。最近一项研究表明,转移性淋巴结的平均ADC 值明显低于非转移性淋巴结[19],而ADC 值与组织细胞密度呈负相关,说明转移性淋巴结的组织密度更高,与本研究结果相似。本研究中多因素分析显示,静脉期λHU和静脉期nZeff升高是乳腺癌ALNM 的独立预测因素,构建的双能量CT 定量参数模型的诊断效能较高,AUC 为0.819。而进一步结合有差异的形态学特征(长短径比值和淋巴门结构)构建的联合模型相较双能量CT 定量参数模型和形态学特征模型可明显提高诊断效能,AUC 达0.884,敏感度和特异度分别为82.61%、80.00%,说明联合模型能为术前无创评估乳腺癌患者ALNM 状态提供参考依据。
本研究仍存在的局限性:为单中心、回顾性研究,可能存在选择偏倚;仅在显示淋巴结最大层面勾画ROI,可能无法反映整体淋巴结特征;尽管已详细记录术中切除淋巴结的位置、大小及其与肿瘤的距离等,但少部分淋巴结在CT 图像上的评估结果与病理仍结果不匹配。
综上所述,双能量CT 定量参数在术前无创鉴别乳腺癌患者ALNM 中表现出较好的应用价值,联合形态学特征可明显提升诊断效能,这为术前选择合适的治疗方式及预后评估提供了重要的参考依据。

