基于MRS 的列线图模型在脑胶质瘤分级诊断中的应用研究
冯文杰,李道伟
辽宁省人民医院放射科,辽宁 沈阳110000
胶质瘤是最常见的颅内原发性肿瘤。WHO 根据肿瘤细胞的细胞密度、有丝分裂活性、核异型性、血管内皮增生和坏死等病理生理改变将胶质瘤分为1~4 级,其中,1~2 级为低级别胶质瘤(low-grade glioma,LGG),3~4级为高级别胶质瘤(high-grade glioma,HGG)[1-3]。HGG 预后不良,几乎所有患者术后均会复发[4],而LGG 患者往往在数年内无或少有进展[5]。对胶质瘤患者进行有效的分级评估有助于制订正确的治疗方案[6-8]。
目前,胶质瘤的分级诊断主要依靠病理活检,但其为有创检查,且HGG 异质性高,取样误差有时难以避免[9-12]。MRS 能无创检测生物体内代谢物的含量,为胶质瘤的术前分级诊断提供重要的信息[13-16]。然而目前尚无用MRS 综合分析代谢物指标鉴别胶质瘤级别的相关文献报道。列线图模型具有测量简单、结果易读等优点,是解决这类多变量求值问题的方法之一[17-18]。本研究首次将MRS 与列线图模型相结合应用于胶质瘤分级诊断中,目的是通过列线图量化反映胶质瘤的代谢物指标,使胶质瘤的术前分级诊断更简便易行。
1 资料与方法
1.1 一般资料
回顾性分析我院2020 年1 月至2022 年1 月收治的68 例胶质瘤患者。根据病理结果,分为HGG组33 例(48.5%)和LGG 组35 例(51.5%)。纳入标准:①经大体病理诊断为脑胶质瘤,并明确肿瘤级别;②术前1 个月内行MRS 检查。排除标准:①病理诊断分级不明确;②复发及多发胶质瘤;③肿瘤直径<2 cm;④MRI 增强扫描几乎无强化。本研究经医院伦理委员会批准(批准文号:2022KS008),免除受试者知情同意。
1.2 仪器与方法
使用GE MR750 3.0 T 超导型MRI 成像仪与头部正交线圈行脑部MRS 及MRI 增强扫描。患者取仰卧位,配戴耳塞,固定头部以减少运动伪影。先行横断位及矢状位T2WI 定位像扫描:TR 6 240 ms,TE 94 ms。后使用二维多体素点分辨波谱成像序列(PRESS)行多体素1H-MRS 扫描,扫描参数:TR 1 000 ms,TE 144 ms,视野240 mm×240 mm,矩阵512×512,扫描时间约5 min,体素大小1.0 cm×1.0 cm×1.5 cm。增强扫描序列为T1WI,TR 1 850 ms,TE 20 ms。对比剂为钆特酸葡胺注射液(江苏恒瑞医药股份有限公司),经肘前静脉注射,流率2.0 mL/s,剂量0.1 mmol/kg体质量,后以2.0 mL/s 流率注射生理盐水20 mL。
1.3 MRS 图像后处理及列线图模型建立
图像采集完毕后上传至后处理工作站ADW 4.6 及PACS。ROI 置于T1WI 增强扫描图像中肿瘤强化最明显部位(图1),MRS 频谱图像由后处理软件自动计算并获取。记录患者胆碱/肌酸(Cho/Cr)、胆碱/N-乙酰天门冬氨酸(Cho/NAA)、NAA/Cr、性别及年龄等。
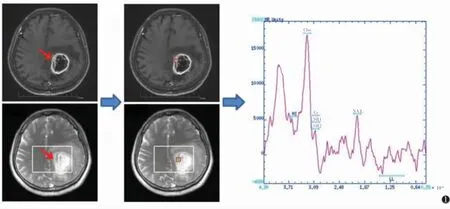
图1 体素选择示意图 注:患者,女,64 岁,病理为间变性少突胶质细胞瘤。在T1WI 增强扫描图像上确定肿瘤强化最明显处(红箭),将该处作为目标体素(红框),并计算该体素内波谱图像
使用R 语言(X64 4.1.2)构建列线图。将患者按照3∶1 的比例(参考Si 等[19]的分组方法)随机分为训练集51 例和验证集17 例。训练集中HGG 患者25 例,LGG 患者26 例;验证集中HGG 患者8 例,LGG 患者9 例。通过单因素logistic 回归分析筛选预测变量,将结果中P<0.2 的自变量作为预测变量用于构建列线图。运行R 语言并安装“car(3.0-12)”“rms(6.2-0)”“pROC(1.18.0)”及“DecisionCurve(1.3)”程序包,其中,“car”程序包用于logistics 回归分析,“rms”程序包用于构建列线图模型,“pROC”程序包用于ROC 曲线分析,“DecisionCurve”程序包用于绘制决策曲线分析(decision curve analysis,DCA)。
1.4 统计学分析
使用SPSS 25.0 软件进行数据分析。采用Kolmogorov-Smirnov 检验对连续分布的计量资料行正态性检验,符合正态分布者以表示,2 组间比较行独立样本t 检验;不符合正态分布者以M(Q1,Q3)表示,2 组间比较行Mann-Whitney U 检验。计数资料以例(%)表示,2 组间比较行χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2 组间Cho/NAA 比较,差异有统计学意义(P<0.05,表1)。
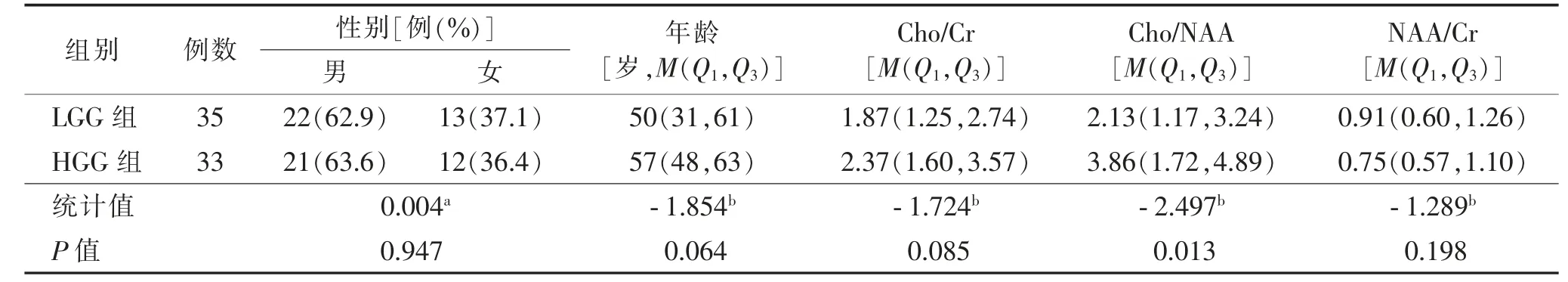
表1 LGG、HGG 组患者一般资料比较
根据单因素logistic 回归分析结果(表2),选择P<0.2 的变量作为列线图模型预测变量,即年龄、Cho/Cr、Cho/NAA、NAA/Cr,以此构建列线图预测模型(图2)。通过绘制ROC 曲线(图3)评价模型诊断效能,模型中训练集AUC 为0.777(特异度0.769,敏感度0.760),验证集AUC 为0.806(特异度0.556,敏感度1.000),表明模型准确性良好。校准曲线(图4)显示,训练集预测值与实际值较接近,而验证集较训练集偏差增大。预测模型中训练集与验证集的DCA(图5)均显示模型曲线(红线)具有偏离2 条极端曲线(灰线)的趋势,表明将模型应用于胶质瘤分级诊断,能指导临床采取干预措施。
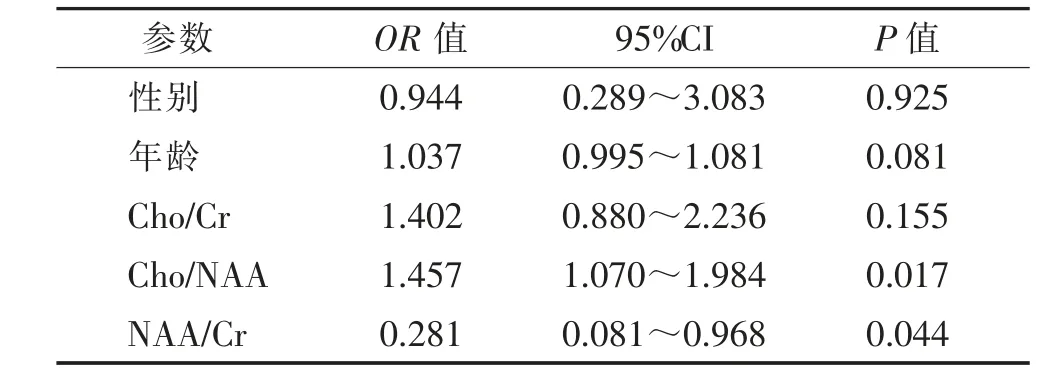
表2 单因素logistic 回归分析筛选预测变量

图2 预测高级别胶质瘤(HGG)患病风险的列线图模型 注:Cho 为胆碱,Cr 为肌酸,NAA 为N-乙酰天门冬氨酸 图3 列线图模型的ROC 曲线 注:图3a 为训练集ROC 曲线,AUC=0.777(特异度0.769,敏感度0.760);图3b 为验证集ROC 曲线,AUC=0.806(特异度0.556,敏感度1.000)图4 列线图模型的校准曲线注:图4a 为训练集校准曲线;图4b 为验证集校准曲线 图5 列线图模型的决策曲线分析(DCA) 注:图5a 为训练集DCA;图5b 为验证集DCA
3 讨论
脑胶质瘤患者预后差异较大,术前对胶质瘤进行准确分级具有重要意义[20]。有研究表明,代谢物的改变通常早于结构改变,MRS 可在常规结构成像之前发现病变区域生理/生化异常[21],且其对于鉴别HGG和LGG 具有独特优势。
本研究构建了鉴别HGG 与LGG 的列线图模型,并对模型进行了多种验证以评估其鉴别效果。本模型综合MRS 指标客观及列线图结果直观易读的特点,对HGG 与LGG 具有良好的预测性能,为临床术前鉴别胶质瘤级别提供了重要参考。
3.1 NAA、Cho、Cr 与胶质瘤级别的相关性
脑代谢物的峰值水平因个体差异而有所不同[22-23],且相较于Cho 的绝对含量,Cho/NAA 和Cho/Cr对确定脑肿瘤的Cho 水平更准确[24],因此,本研究选择代谢物之间的比值反映肿瘤内的生化改变。本研究HGG 组的Cho/NAA 比值(3.86)明显高于LGG组(2.13),这可能是因为HGG 细胞增殖更旺盛,导致反映细胞增殖的膜代谢产物Cho 明显升高[25],同时,HGG 具有更明显的侵袭性,对神经元破坏更严重,故NAA 含量明显减低[26],以上原因使得HGG 的Cho/NAA比值明显升高,与之前的研究[9,27]结果一致。本研究中HGG 组的Cho/Cr 比值也高于LGG 组,但差异无统计学意义(P=0.085),这可能与样本量较小有关。
3.2 列线图模型在胶质瘤分级诊断中的应用价值
本研究根据68 例胶质瘤患者的肿瘤代谢物指标建立了列线图,相较于其他临床预测模型,列线图能更直观反映患者的阳性事件概率,是一种很好的预测分类模型[28-30]。本研究中,ROC 曲线能直观显示列线图模型的预测性能,本组训练集AUC 为0.777,验证集AUC 为0.806,表明模型在区分HGG 与LGG中具有良好的预测性能。训练集校准曲线显示预测模型曲线走行与理想曲线具有一致性。但在验证集中,尽管模型AUC 较理想,但特异度较低。同时验证集中校准曲线也表现出较大波动,这可能与样本量有关,因为验证集仅17 例。此外,本研究除评价模型的诊断准确率及预测结果的一致性外,还绘制了DCA 曲线来评估模型在不同阈值概率下的临床效用情况[31-33],由结果可知模型曲线具有偏离极端曲线的趋势,且偏离段曲线对应的阈值概率范围较大。因此,本模型具有指导临床采取干预措施的能力,且模型是相对安全的。
本研究存在的不足:①大量研究表明,NAA 及Cho 在不同级别胶质瘤中具有明显差异[24-25],而Cr常被用作各代谢物的参考对象[34]。为避免将这些重要指标排除在外,本研究参考Li 等[35]的方法,将单因素分析结果中P<0.2 的变量作为预测变量。由于取值范围较大,可能降低了模型的诊断效果。②样本量小,可能导致验证集评价效果不佳。后续需大样本、多中心研究进一步验证。③MRS 测量体素的选取主要通过视觉评估,存在一定的主观性,如何准确选取体素需进一步探讨。
综上所述,基于MRS 的列线图模型对HGG 与LGG 具有良好的鉴别能力。该方法简便易行,同时能通过量化指标降低影像诊断过程中的主观性,有望成为脑胶质瘤患者术前分级诊断的辅助方法之一。

