2种核酸快提取法对羊口疮病毒和羊痘病毒DNA提取效能的比对研究
谭小雨,杨 洋,郭紫晶,李彦敏,张志东通信作者
1.西南民族大学畜牧兽医学院,四川 成都 610041 2.中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室,甘肃 兰州 730046
0 引言
羊口疮(orf),又被称为羊传染性脓疱,是由嗜上皮细胞的羊口疮病毒(orf virus,ORFV)引起的接触性传染病[1]。该病呈现出全球性分布,对养羊业造成重大的经济影响。ORFV是一种双链DNA病毒,其基因组大小约为140 kb,属于痘病毒科(Poxviridae)脊椎动物痘病毒亚科(Chordopoxvirinae)副痘病毒属(Parapoxvirus),编码蛋白种类多且病毒结构复杂[2-4]。羊痘(capripox,CaP)是由羊痘病毒(Capripoxvirus,CaPV)感染引起的一种急性、热性、接触性传染病[5-9],是世界动物卫生组织列为必须通报的动物疫病,是所有动物痘病中最为严重的。CaPV属于痘病毒科(Poxviridae)脊索动物痘病毒亚科(Chordopoxvirinae)山羊痘病毒属(Capripoxvirus)成员。这些病毒主要感染绵羊和山羊,在羊群中广泛存在或流行,给羊养殖业造成巨大的经济损失,严重影响着我国畜牧业的发展。尽管根据被感染动物表现出的临床症状和流行病学调查,可以作出初步诊断,但是往往很难进行确诊。
近年来,除传统的病毒分离与鉴定方法,快速、特异性的PCR、重组酶聚合酶扩增(recombinase polymerase amplification,RPA)等分子检测技术在orf和CaP等病毒病诊断中发挥着越来越重要的作用[10-16]。研究表明,除检测试剂盒特异性、敏感性和重复性等因素外,核酸提取对病毒分子检测的准确性和快速性有较大影响[10]。然而,常用的核酸提取方法操作过程复杂,费时费力。因此,本研究采用2种商品化的核酸快速提取试剂:Cell-to-cDNA裂解液和基于磁珠核酸提取方法(InnuPREP MP Basic Kit A)。提取临床样本(鼻棉拭子、口腔棉拭子、肺脏、脾脏、肾脏)中的ORFV和CaPV核酸,利用qPCR和侧流式免疫层析RPA(RPA-LFD)分析比较核酸提取效果,为合理选择病毒快速核酸提取方法提供科学参考。
1 材料与方法
1.1 试剂
病毒DNA/RNA提取试剂盒(宝生物)、Cell-to-cDNA裂解液、InnuPREP MP Basic Kit A、TwistAmp nfo 试剂盒(Cambridge,United Kingdom)、SYBR Green Master Mix(Life,Applied Biosystems)和Hybridetect 2 T(Milenia Biotec GmbH,Germany)。
1.2 仪器
实时荧光定量PCR仪(安捷伦,Stratagene Mx3005P)、电泳仪(Bio-Rad,1645050)、离心机(Thermo,Legend Micro 21R)、组织破碎仪(MP,FastPrep®-24)、恒温水浴锅(其林贝尔,GL-150)、涡旋仪(桑泽,Vortex-Genie 2)及高压灭菌器(Zealway,GI54TR)。
1.3 样品
本研究涉及的样品均经过相应病毒qPCR的检测,有关样品详细描述和检测结果见Yang et al.公开发表的论文[11-12,14]。Orf疑似样品和CaP疑似样品均采集自甘肃省,采集的拭子放置在1 mL磷酸盐缓冲盐水,于-80 ℃保存备用。Orf疑似临床样品共98份,其中52份组织样品、26份鼻拭子和20份口腔拭子。CaP疑似临床样品共113份,包括61份组织样品、26份鼻拭子和26份口腔拭子。
1.4 核酸提取
病毒核酸提取分别按Cell-to-cDNA裂解液(A法)、基于磁珠核酸提取方法的InnuPREP MP Basic Kit A(B法)和宝生物病毒DNA/RNA提取试剂盒(C法)操作说明进行,然后用核酸蛋白测定仪检测核酸的浓度,于-80 ℃保存备用,每份样品平行进行2次核酸提取。
A法用于鼻拭子和口腔拭子样品中病毒核酸提取,取200 μL鼻拭子或口腔拭子浸泡液加入EP管中,随后加入400 μL的Cell-to-cDNA裂解液混合均匀,75 ℃,10 min;将EP管放在冰上冷却并加入1 μL DNase I混合均匀,75 ℃,10 min;随后取5 μL裂解产物直接用于核酸扩增。
B法分别用于组织、鼻拭子和口腔拭子样品DNA或RNA的提取。对于鼻拭子和口腔拭子,取200 μL拭子浸泡液与300 μL Solution RL/Carrier Mix和20 μL的蛋白酶混合均匀;在用于组织样品时,取1~5 mg组织样品与500 μL Solution RL/Carrier Mix和20 μL的蛋白酶K,震荡混匀10 s;随后按InnuPREP MP Basic Kit A提取试剂盒操作说明书提取样品中病毒核酸,核酸洗脱液体积为50 μL。
C法用于组织、鼻拭子和口腔拭子样品中DNA或RNA的提取。组织样品首先用组织破碎仪打碎(组织质量:PBS体积=1:10),随后按操作说明进行核酸提取,核酸洗脱液体积为50 μL。
1.5 病毒核酸检测
本研究采用公开发表的相关病毒qPCR和RPA-LFD核酸检测方法[11-12,14],检测组织、鼻拭子和口腔拭子样品中相应病毒核酸。每份样品重复检测3次。qPCR使用SYBR® Select Master Mix试剂盒并按操作说明进行,反应体系为25 μL,包括SYBR® Select Master Mix(2×),上下游引物(10 μmol/L),热循环参数为50 ℃,5 min;95 ℃,10 min,40个循环;95 ℃,15 s和60 ℃,1 min;在Stratagene Mx3005P上进行,分析溶解曲线以验证特异性扩增和Mx3005P系统软件对数据进行分析。RPA-LFD使用TwistAmp nfo试剂盒并按操作说明进行,其反应体系为25 μL,包括水解缓冲液、引物和探针(10 μmol/L),恒温扩增温度参数为37 ℃,20 min;扩增完成后使用Hybridetect 2T试纸条检测扩增产物,含有标记物的特异核酸扩增产物可以在含有多抗连接金颗粒的试纸条上显色,整个显色过程在室温下完成。本研究所用的qPCR引物和探针、RPA-LFD生物素标记引物和探针均由生工生物工程(上海)股份有限公司合成,其中RPA引物和探针的具体信息如表1所示。

表1 本研究使用的RPA引物和探针
1.6 统计学分析
每次实验重复3次,用PRISM 5.0软件对试验结果进行统计分析。
2 结果
2.1 2种快速核酸提取方法提取ORFV DNA效能分析
分别使用A法、B法和C法对98份ORFV疑似临床样品进行核酸提取。采用qPCR和RPA-LFD法评价病毒核酸提取效果,以C法的结果作为参考标准,分析A法、B法的核酸提取效能,qPCR对提取的核酸样品检测结果如表2所示。在C法提取的98份orf疑似样品核酸中,32份组织样品、13份鼻拭子和11份口腔拭子为ORFV核酸阳性,与本实验室之前检测的结果一致。在A法提取的46份鼻拭子和口腔拭子核酸样品中,9份鼻拭子和8份口腔拭子为ORFV核酸阳性,与C法相比,拭子核酸阳性符合分别为70.8%;对组织样品分析发现,A法无法用于组织样品中的核酸提取。在B法提取的52份组织样品和46份鼻拭子和口腔拭子核酸样品中,30份组织样品和21份拭子样品为核酸阳性,与C法相比,阳性符合率为93.7%和87.5%;基于全部检测的98份样品,B法提取的核酸样品阳性符合率为91.1%。
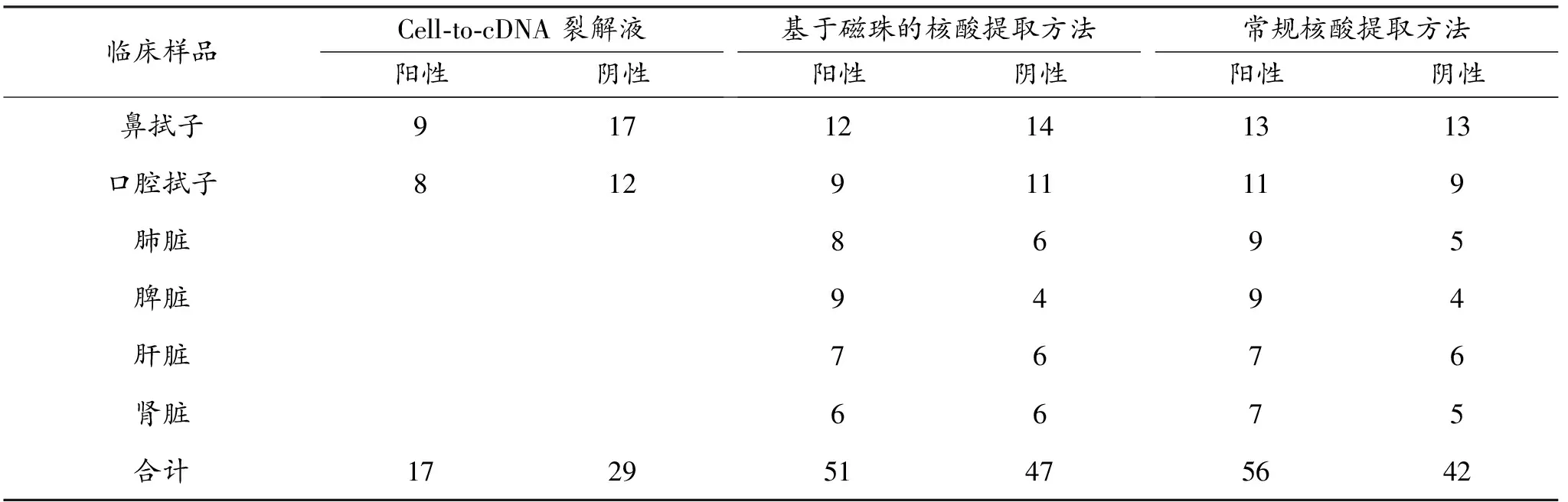
表2 利用qPCR比较Cell-to-cDNA裂解液和基于磁珠的核酸提取试剂盒提取ORFV核酸的性能 单位:份
利用RPA-LFD对A法、B法和C法提取的核酸样品进行检测,结果见表3。在C法提取的98份核酸样品中,53份ORFV阳性和45份阴性。在A法和B法提取的46份拭子核酸样品中,分别检出16份和19份拭子ORFV核酸阳性;与C法相比,阳性符合率分别为69.5%和82.6%;在B法提取的52份临床组织样品核酸中,检出28份ORFV核酸阳性,与C法相比,阳性符合率为93.3%;基于全部的98份临床样品,B法提取的ORFV核酸阳性符合率为89%。上述结果表明,在A法和B法2种快速核酸提取方法中,B法快速提取ORFV核酸的效率更高。基于磁珠的核酸提取方法提取的鼻拭子和口腔拭子以及动物组织样品核酸能够很好地应用于ORFV qPCR和RPA-LFD检测方法中。

表3 利用RPA-LFD比较Cell-to-cDNA裂解液和基于磁珠的核酸提取试剂盒提取ORFV核酸的性能 单位:份
2.2 2种快速核酸提取方法提取CaPV DNA效能分析
分别使用A法、B法和C法对113份CaP疑似临床样品进行核酸提取,采用qPCR和RPA-LFD法评价核酸提取效果,以C法的结果作为参考标准,分析A法、B法的提取效能,qPCR检测结果如表4所示。在C法提取的113份核酸样品中,37份组织样品、16份鼻拭子和14份口腔拭子为CaPV阳性,与本实验室之前检测的结果一致。在A法和B法提取的52份拭子核酸中,qPCR分别检出23份和27份CaPV核酸阳性,与C法相比,阳性符合率分别为77%和90%。B法提取的61份组织样品核酸中,35份为CaPV核酸阳性,与C法相比,其阳性符合率为94.5%。基于B法提取的全部113份样品,与C法相比,核酸阳性符合率为92.5%。
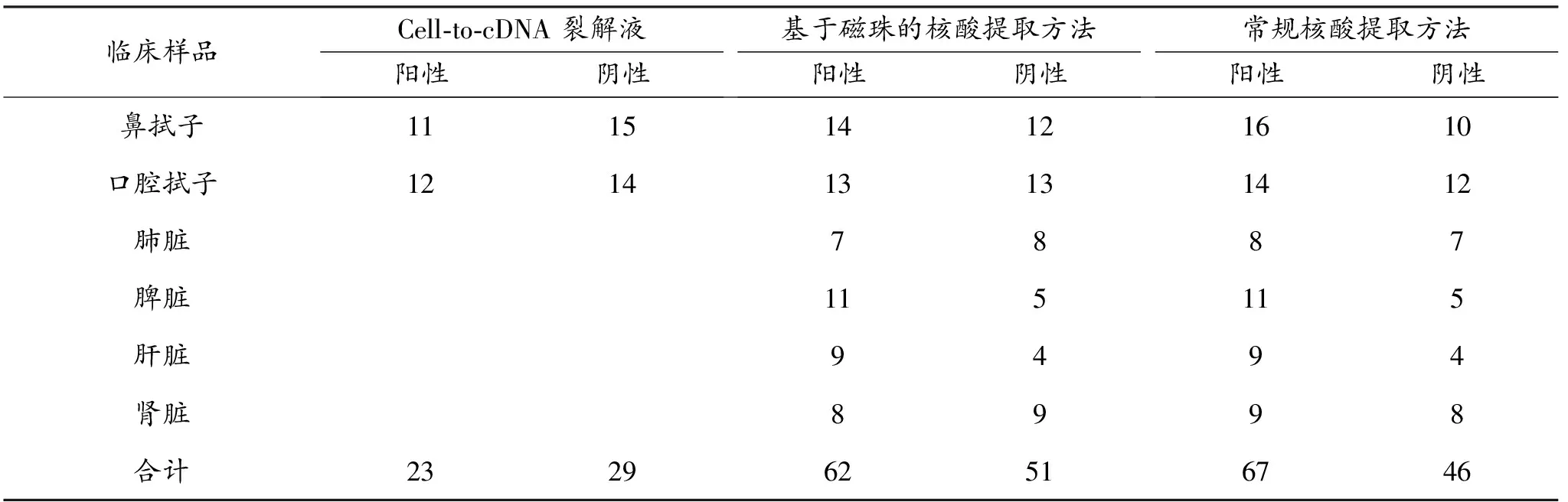
表4 利用qPCR比较Cell-to-cDNA裂解液和基于磁珠的核酸提取试剂盒提取CaPV核酸的性能 单位:份
利用RPA-LFD,对A法、B法和C法提取核酸样品进行检测,其结果如表5所示。在C法提取的113份核酸样品中,65份为CaPV阳性。随后对A法、B法提取的52份拭子核酸进行测定,RPA-LFD分别检出19份和26份CaPV核酸阳性,与C法相比,阳性符合率分别为66%和90%。在B法提取的61份组织样品核酸中,检出32份CaPV核酸阳性,与C法相比,阳性符合率为88.9%;基于全部B法提取的113份核酸样品,阳性符合率为89%。上述结果表明,在A法和B法两种快速核酸提取方法中,B法快速提取CaPV核酸的效率更高,可用于qPCR和RPA-LFD检测方法,快速检测CaPV。
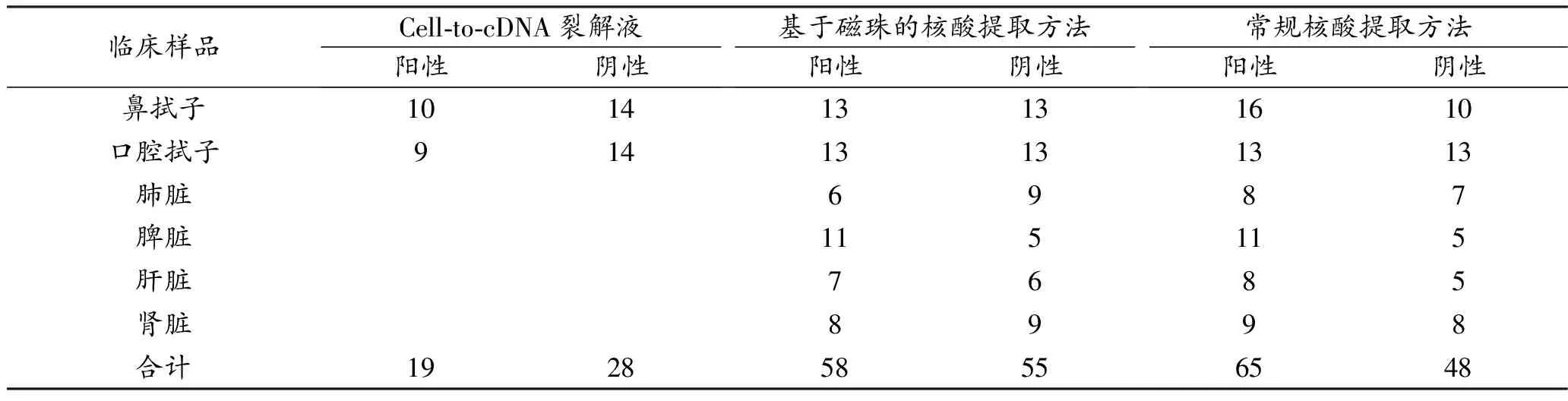
表5 利用RPA-LFD比较Cell-to-cDNA裂解液和基于磁珠的核酸提取试剂盒提取CaPV核酸的性能 单位:份
3 讨论
ORFV和CaPV病毒严重影响着我国畜牧业的发展,快速、特异性的诊断对疫病防控至关重要。近年来,快速、特异性的qPCR、RPA等分子检测技术在动物病毒性疫病的诊断中发挥着越来越重要的作用。而病毒病快速分子生物学检测,首先要面临的最大的挑战就是病毒核酸快速提取。传统的沉淀法和实验室常用的离心柱吸附法,虽然可以提取病毒核酸,但是操作过程复杂,费时费力,且有机溶剂可能对实验人员造成伤害,制约了病毒分子检测方法的快速诊断。同时,在开展病毒分子检测方法过程中往往重点关注方法的敏感性、特异性,而忽略了核酸提取对于检测结果的影响。为了评价不同类型的快速核酸提取试剂盒对病毒核酸的提取效率,本研究选取了2种快速核酸提取方法(Cell-to-cDNA裂解液和基于磁珠的核酸提取方法),分别对羊鼻拭子、口腔拭子及组织样品核酸提取进行了提取效率比较。Cell-to-cDNA裂解液和基于磁珠的核酸提取方法InnuPREP MP Basic Kit A均摆脱了核酸提取过程中离心机的束缚,可以进行核酸快速提取。InnuPREP MP Basic Kit A是通过蛋白变性剂使得样本中的蛋白质达到溶解状态,使得核酸被解离出来,并在磁场和重力的作用下,将杂质去除掉,最后获取较为纯净的核酸样本。在本实验中,在提取组织样品中病毒核酸时,A法对组织样品中的核酸无法进行有效提取,但对鼻拭子和口腔拭子可进行有效提取。而B法对羊鼻拭子、口腔拭子及组织样品中的ORFV和CaPV核酸进行有效提取,与C法相比,一致性良好。
4 结论
与Cell-to-cDNA裂解液相比,磁珠核酸提取方法的提取效率更高,并且能提取组织样品的核酸,具有更广泛的运用和推广价值,并且与RPA-LFD方法联用,可实现病毒病的现场快速诊断,为动物病毒病的早发现、早预防、早防控提供新的技术支撑。在后续实验中,将优化样品制备过程,检测更多的临床样品,进一步评价InnuPREP MP Basic Kit A核酸提取效率。

