牙釉质再矿化的过去、现在与未来
李全利
(1.安徽省矿化疾病研究重点实验室,安徽医科大学附属口腔医院修复科,合肥 230032;2.深圳市龙岗区耳鼻喉医院口腔科,深圳 518172)
“脱矿-再矿化“动态平衡是牙齿表面在口腔唾液环境中的一种基本现象。龋齿的发生是致龋微生态体系酸的产生导致平衡向脱矿方向移动的结果,但是龋病的发生过程仍然是一个脱矿和再矿化并存的慢性过程。釉质早期病损可通过再矿化得以恢复,人们认识到龋损是一个可逆性的过程。随着微创医学理念的兴起,脱矿龋损的再矿化治疗越来越受到人们的重视,但是,目前再矿化的作用有限,临床急需开发新型有效的再矿化制剂,重建病损的釉质结构,再现釉质的机械性能、美学性能和生物学性能。
1 牙釉质“脱矿-再矿化”平衡的认知
20 世纪初期,人们将酸软化的人工龋损浸入唾液可以恢复部分硬度开始认识到龋损的再矿化现象,20 世纪60 年代大量研究确认了龋损在唾液、钙磷过饱和液中可以发生再矿化[1]。另外,釉质龋早期病损的组织学特征从内到外依次为透明带、暗带、病损体部、完整表层结构,结合X-光显微放射、偏振光、透射电子显微镜研究,发现龋病的发展不是一个单纯的持续的溶解过程,至少存在暂时的矿化沉积过程。龋损发展呈现表层下脱矿,而病损表面仍然保持相对的完整性且脱矿程度相对较低。龋损内部钙磷分布的变化,可能是溶解的钙磷离子的扩散再分布沉积,但是不管是釉质龋、牙本质龋,只要致龋环境的消失,龋损都可以静止发生钙磷矿化的沉积,说明唾液可以作为矿化离子的来源促进再矿化的发生。一般认为唾液的钙磷离子可以达到羟基磷灰石晶体(HA)沉积的过饱和度的离子活度。刺激性唾液比静态分泌唾液的钙磷饱和度更高。使用人工矿化液可能比唾液更有效,但是一旦脱矿达到一定的程度,再矿化的作用就有限[1]。
随着龋病研究的深入,人们发现龋齿的发生是一个“脱矿-再矿化的动态平衡”过程。当致龋菌斑的pH 值达到临界pH(釉质5.5,牙本质6.2)时表现脱矿,当pH 值回升,达到钙磷的过饱和,则钙磷重新沉积,即发生再矿化现象。“脱矿-再矿化的动态平衡”是牙齿表面的基本特征,在天然口腔内存在一种从唾液获得钙磷的矿化沉积机制保护着牙齿表面结构的完整性[1]。
至此,人们认识到龋病是一个可逆的(病变初期)进行性疾病,调控脱矿-再矿化平衡是龋病防治的关键。龋病的治疗理念已经从牙齿水平的修复性治疗(创伤的手术治疗),转移到病人整体水平的以龋病危险因素评估管理为基础的医学治疗理念(the total-patient level caries management by risk assessment)。充填修复治疗不能治愈疾病的本身,龋病的治疗程序首先根据病人的危险因素评估,抑制病理的脱矿因素,促进病人的再矿化保护因素。逆转非龋洞的早期病损——白垩斑,再矿化治疗越来越受到人们的重视。迫切需要新型矿化制剂。
2 从釉质再矿化到釉质仿生矿化
2.1 釉质仿生矿化的理论基础
早期狭义的釉质再矿化概念指脱矿的早期龋损内部矿物再沉积,恢复釉质机械性能和结构,而广义的釉质再矿化应包括在釉质表面的矿化沉积。早期使用的再矿化制剂主要是钙磷过饱和液,其诱导的矿化沉积常常发生病损体部的釉柱边缘间质处,沉积的晶体比釉柱晶体大,且不规则;也有小的不规则的球形、颗粒状晶体在病损内部、表面沉积,同时可以观察到小的晶体在健康的釉质表面沉积,晶体的形态、大小都与釉质晶体不同。矿化沉积与矿化液离子的浓度、pH 值、离子的种类有关,如氯离子可以促进矿化,铜离子可以抑制矿化、氟离子可以促进矿化。使用单纯的无机矿化溶液不能重塑天然牙釉质的结构和形态。
人们认识到生物矿化的过程是“在生理条件下有机大分子模板自发地调控无机晶体生长、取向和形态。以此“有机基质模板矿化”理论,20世纪80 年代末形成了一种新兴的——分子仿生软纳米材料合成技术。目前认为分子仿生合成技术是复制天然矿化组织多等级结构的重要途径[2-3]。分子仿生合成设计是依据硬组织的分子矿化机理,首先选择设计合理的有机大分子矿化模板,仿生矿化过程中关键蛋白对无机晶体的调控;其次是矿物盐形成的原料——无机离子或前驱体的设计;最后在生理条件下,通过有机大分子模板与无机离子/前驱体的识别和自组装形成有序的纳米复合杂化材料。
成熟的牙釉质相对于人体其它硬组织是一种无细胞的高矿化组织,不依赖细胞活动的参与,釉质结构的仿生是非细胞再生构建牙体仿生材料研究的切入点,且具有重要的临床应用意义。在分子仿生研究的驱动下,釉质再矿化研究发展到诱导釉质微结构再生的釉质仿生矿化阶段,它不仅关注丢失矿化物的获得,更注意重塑丧失的釉质微结构,以及在牙齿表面形成具有牙釉质结构的再生体,甚至在牙本质表面形成类釉质结构保护牙本质-牙髓复合体。釉质仿生研究概况可以参考相关综述[4-7]。
2.2 釉质仿生矿化设计的基本思路
釉质仿生矿化有机基质模板的设计:釉原蛋白是釉质发育和HA 晶体取向生长聚集、组装形成釉柱结构的关键调控蛋白。因此,围绕釉原蛋白及其相关多肽的设计是釉质仿生矿化的一个重要特色[8-9],其他自组装多肽、氨基酸、仿生多肽、类蛋白活性分子等也是目前研究的热点。
仿生釉质发生牙胚水凝胶基质矿化微环境,以载荷有矿化离子及矿化活性分子水凝胶的形式诱导矿化。如釉原蛋白的复合凝胶涂覆在牙齿表面[10]、装载钙磷氟离子的明胶[11]、聚氧化乙烯与聚丙酰胺的凝胶[12]、琼脂水凝胶介导的钙磷氟离子扩散模型[13]。
无机矿化物原料供给设计。生物矿化无机晶体的生成不是一个以钙磷过饱和液溶液为基础的、从离子开始一步直接生成晶体结构的热力学过程的经典晶体生成途径(classical crystallization theory),而是一个在有机基质模板的调控下,起始于钙磷预成核簇(calcium phosphate prenucleation clusters,CaP-PNCs),如Ca3(PO4)2、Ca6(PO4)4、Ca9(PO4)6、……、[Ca3(PO4)2],在动力学驱动下,经过一系列无定形磷酸钙前驱体的相转变,逐步形成连续的晶相结构,即非经典的晶体生成模式(non-classical crystallization theory)(图1)[2-3,14-15]。如采水溶聚电解质与钙磷离子作用,形成相对稳定的纳米液态矿化前驱体(polymer-induced liquidprecursor,PILP)或钙磷预成核簇[16]。
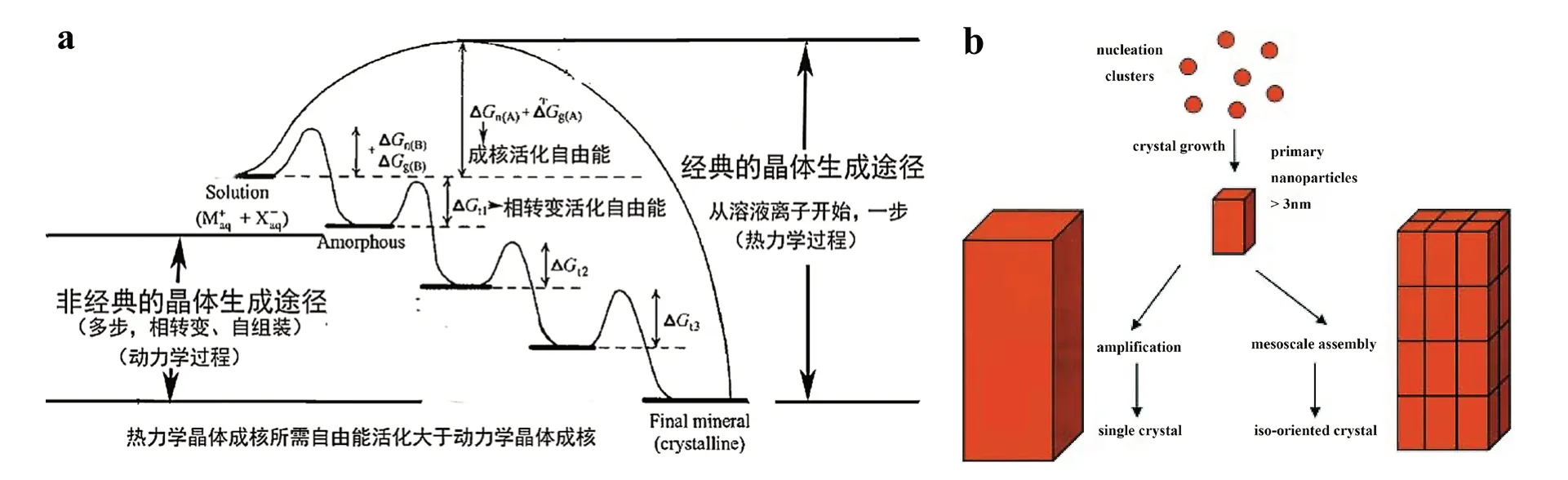
图1 经典成核与非经典晶体成核生长模式图
2.3 釉质仿生矿化的效果
非细胞仿生矿化策略已经实现在牙釉质表面体外重塑釉柱样HA 晶体结构的组装——牙釉质基本显微结构(图2a);甚至在牙本质表面形成类釉质微结构覆盖牙本质表面,保护牙本质-牙髓复合体(图2b)。但是这种仿生矿化策略形成的类釉质微结构还只能在微米级范畴,不能通过矿化时间的延长实现宏观的类釉质结构的再生。矿化再生的类釉质结构与基地具有良好的结合性能。
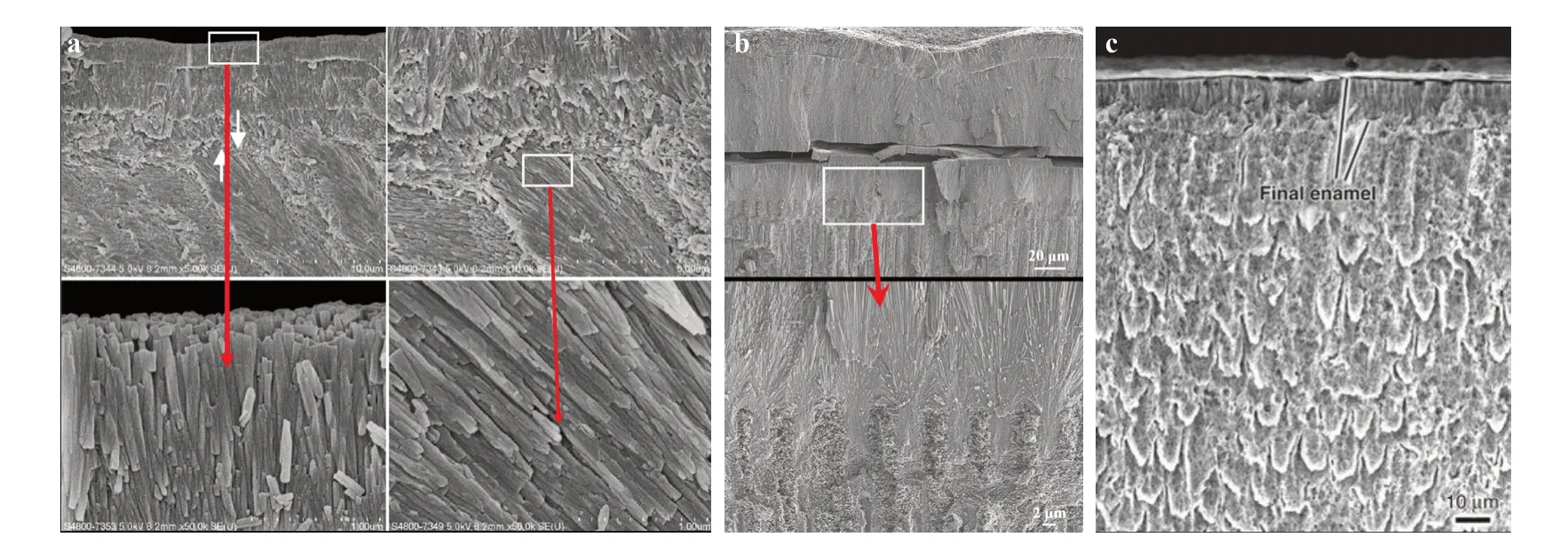
图2 仿生矿化再生类釉质晶体结构(SEM 图)
对于龋损内部结构的修复作用目前数据相对较少,缺少超微结构的数据说明重塑了龋损内部因脱矿导致的釉柱结构的破坏。研究报道多体现在龋损机械性能的恢复等。
2.4 釉质仿生矿化临床转化的应用方向
2.4.1 从唾液中摄取钙磷诱导矿化 该研究策略是通过对诱导矿化的有机分子进行改性设计,接枝与釉质具有亲和力的基团/功能域结构,赋予矿化分子具有釉质结合性能。当其在口腔应用时,如漱口液,或其他涂层形成,吸附于牙齿表面,发挥矿化诱导作用,从唾液中摄取钙磷矿物离子,诱导釉质微结构的再生。目前报道的与釉质结合的分子结构有:焦磷酸结构(如阿仑膦酸钠)、生物多酚、磷酸化的丝氨酸结构、磷灰石结合性多肽等[18-19]。
2.4.2 水凝胶载体诱导矿化 该研究策略将矿化活性分子和矿化无机离子等转载于水凝胶内,通过水凝胶与釉质表面持续接触,矿化离子扩散至牙齿表面或内部诱导矿化,如上述体系[10-13]。临床使用时可以将此凝胶制成薄膜结构,吸附于牙齿表面,或者装载于个性的托盘内患者戴用持续提供矿化。
2.4.3 溶剂挥发浓缩矿化制剂诱导矿化 矿化活性分子溶解在挥发性溶剂中,当矿化溶解滴加在牙齿表面时,溶解挥发,启动晶体相变,诱导矿化。如利用小分子有机物三乙胺获得稳定的几纳米钙磷预成核簇。通过乙醇挥发去除了三乙胺,显示了优良的矿化性能[16]。
3 釉质仿生矿化设计的发展方向
3.1 矿化与生物膜干扰问题
牙齿表面被获得性膜和细菌生物膜所隔离。唾液菌斑复合体(saliva-plaque complex)对矿化必然产生作用。开发的矿化制剂,必须可以穿透菌斑介质,达到牙齿表面,在菌斑系统内聚集钙磷离子。另外菌斑内的细胞外基质成分必然对矿化结构产生影响。如产生结石一样的结构,则导致矿化治疗的失败。目前研究有将抗菌肽与矿化分子结合,消除生物膜的干扰[18,20],纳米酶抗菌消除生物膜的干扰[21]。
3.2 口腔环境智能感知响应矿化体系的设计
新型材料制剂与牙体组织靶向结合、感知口腔环境变化、启动抗菌、并摄取唾液钙磷,诱导矿化牙体组织微结构再生,实现早期牙体组织病损自愈性修复是未来釉质仿生矿化研究的一个重要方向。
课题组近期以可溶性淀粉模板合成了稳定的小粒径CaP-PNCs[22],此制剂可以在液态和固态相互转化而不会发生晶型的改变,冷冻保存数月后仍处于几纳米的CaP-PNCs 状态。在口腔环境应用时,利用口腔环境中富含淀粉酶的特点,淀粉酶水解淀粉,介导CaP-PNCs 现场释放,促进矿化的进行,初步实现了口腔环境调控CaP-PNCs 的释放。
纳米酶(Nanozymes) 具有成本低、稳定性高、易于规模化生产、功能多样化等优点,已成为抗菌材料的研究热点。其中,四氧化三铁纳米酶(Ferumoxytol iron oxide nanozymes,FerIONP)表现出多种酶模拟活性,其具有的过氧化物酶(Peroxidase,POD)特性可以催化底物过氧化氢(H2O2)产生活性氧(Reactive oxygen speices,ROS)来抑制细菌生长或破坏细菌的生物膜[38]。FerIONP具有pH 依赖的过氧化物酶及过氧化氢酶催化活性,在酸性pH 环境下发挥过氧化物酶活性,通过催化底物过氧化氢(H2O2)产生ROS 杀灭变异链球菌(S.mutans)。在中性环境中,FerIONP 则发挥过氧化氢酶的作用,将H2O2分解成氧气和水,降低了对细胞的长时毒性。因此,四氧化三铁纳米酶可以感知致龋产酸作用,发挥抗菌作用,从而实现对龋损破坏的智能感知[23]。
纳米酶需要H2O2底物发挥作用,致龋菌生物膜中的内源性H2O2极其有限,应用时,需要提供外源性H2O2,才能发挥纳米酶的抗菌及抗生物膜的作用,进而阻止龋齿的发展。研究FerIONP 表面偶联葡萄糖氧化酶(GOD),当患者高糖饮食时,GOD 催化分解矿化制剂产生的葡萄糖产生H2O2,为FerIONP 提供丰富的催化底物H2O2,产生ROS杀菌,实现对口腔高糖饮食环境的感知[24]。
S.mutans 可表达多种细胞膜相关的葡聚糖结合蛋白,因此,在FerIONP 表面包覆葡聚糖(Dextan),可以实现纳米酶与S.mutans 的智能感知特异性识别[25],增加对致龋生物膜的亲和力,杀灭致龋菌的同时避免了对其他共生菌的影响。
近期一项研究开发出了基于pH 可裂解的硼酸酯键自组装成细菌响应的多药物递送系统,其可识别致龋条件并在酸性pH 下智能释放药物,从而提供抗细菌粘附和抗龋生物膜活性,并恢复脱矿牙齿的微观结构和机械性能。该纳米新型疗法可有效减少龋齿发生和严重程度。当龋齿发生时,其在酸性条件下会迅速释放抗菌和修复剂。通过唾液获得性肽与牙釉质的有效结合,可以显著提高药物在口腔中的疗效和保留时间[26]。
另一项研究设计了pH 响应纳米载体系统,其在健康的中性口腔微环境中稳定,氯己定封装在核心中,聚乙二醇壳暴露在外层。一旦产生龋齿的生物膜内处于酸性环境,壳核中的柠檬酸酰胺基团降解,迅速拆卸并释放氯己定。该系统可降低氯己定的药物毒性,并在变异链球菌生物膜中表现出优异的抗菌能力[27]。
总之,理想的新型仿生矿化分子模板应具有牙齿结合功能、靶向致龋菌生物膜的抗菌及破坏生物膜结构的功能,载荷钙磷纳米簇矿化前驱体,并能智能感知口腔菌斑微环境变化。
4 釉质仿生矿化研究目前存在的问题
4.1 仿生矿化设计的随意性
虽然牙釉质的再矿化效果远优于牙本质的再矿化,但是对于牙釉质发育矿化的物理化学分子机制的了解远低于以矿化胶原纤维为基础的牙本质/骨硬组织矿化机理。其相对胶原纤维的矿化表现以下特点:(1)牙釉质有机基质构成中90%是釉原蛋白,其相当于骨牙本质的胶原蛋白起着骨架蛋白的作用,对HA 晶体的形成组装成釉柱具有重要的调控作用,但是随后逐渐被降解,远低于胶原纤维的矿化模板作用。(2)非釉原蛋白,相当于骨/牙本质中的非胶原蛋白,存在于分泌的细胞周围,很快被降解,降解片段参与矿化。(3)釉质矿化过程不存在未矿化的前期牙釉质(preenamel layer )如同牙本质/骨矿化的类骨质或前期牙本质(osteoid or predentin)。(4)釉柱的形成直接始于牙本质,随着成釉细胞童氏突(Tomes’process)在釉质形成过程中逐渐向未来釉质表面退缩形成的空间内形成,同时在初期童氏突周围分泌的细胞外基质首先矿化,形成釉柱间质,对釉柱空间进行塑性。(4)釉质矿化不存在胶原矿化的基质小泡,对无机矿化物的作用形式不清,有报道存在磷酸二氢钙、无定形磷酸钙前驱体。
目前釉质的仿生矿化研究不能模拟釉柱形成过程的形态塑造和有机基质的降解,对于矿物离子的供给形式的模拟也缺少依据。
4.2 对类釉质结构再生的误导与泛化
几乎所有釉质仿生矿化的研究都报道了在釉质表面形成了“类釉柱结构”的再生,但是都没有明确以下问题,这在一定程度上对此类研究造成了混乱。
(1)这种“类釉柱结构”的再生只能在微米级范围,不能随着矿化时间的延长,厚度逐渐增加。
(2)这种“类釉柱结构”的再生一般都是釉柱方向垂直于釉质片表面,再生结构沿釉柱固有形态的外延性生长,很少有关于当釉柱方向平行于釉质片表面情况下再生结构是如何生长的报道(图3)。

图3 釉质仿生矿化结构
(3)各种矿化活性分子设计的矿化结果缺少严格的对照。我们在大量的研究中发现无论什么多肽、水凝胶、丝素蛋白,甚至单纯的矿化液,都可以在釉质表面生长出所谓的“釉柱样结构”,只是晶体大小、生长的速度、排列稍微的不同。我们认为:对于釉质表面矿化再生结构的形态,釉质基底结构起了关键的调控作用。当釉柱垂直于表面时生长容易,且极像釉柱的外延性生长;但是当釉柱平行于牙片表面时,生长困难,需要重新成核取向生长。垂直于表面的晶体生长是一种规律,也是能量最优化的生长方式。不管基底形态如何,晶体在成核位置的生长,总是垂直于该位置的切线方向,获得能量最优化。随着晶体生长的逐渐调整,最终所有晶体都按照垂直于表面的方向取向生长;不同的基底表面形态,晶体生长只是体现在最初的调整取向阶段的不同。不同的矿化分子的设计并没有改变这样的总体生长规律(图3c,图4)。
(4)随着矿化沉积物的生长,牙釉质基底形态对再生晶体生长的调控作用越来越弱,最终形成完全平行的致密排列的晶体阵列。其形貌类似于天然釉质表层的无釉柱结构。天然釉质表层的晶体生长也是丧失了细胞调控的结果(图3c、d,图4)。
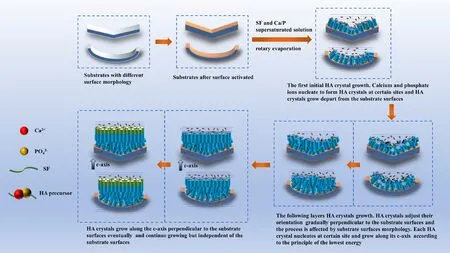
图4 矿化再生晶体在不同表面生长,最终逐渐调整为垂直于表面生长的模式机理图[28]
(5)矿化物结构机械性能的评价,常常采用显微硬度、纳米压痕,不同报道具有较大的差异性。由于基底表面形态的差异性,再生晶体生长方向的调整的差异性,使最终晶体表面不完全一致,类似于酸蚀后釉质微晶,相对粗糙,所以直接测量数据间差别较大,相对粗糙的表面,也不适合于纳米压痕的测量。
(6)矿化晶体的供给方式,对釉质矿化的效果,最终晶体生长的结构形态具有重要的影响。预成核簇不同的状态直接决定矿化效能,这也是研究在重复性方面被忽视的一个重要原因。也是新型矿化制剂开发的一个思路。目前认为生物矿化使通过钙磷预成核簇的项转变的动力学过程,但是钙磷预成核簇的不同阶段具有不同的矿化性能[14-15]。钙磷预成核簇第一阶段是无机矿物离子形成预成核簇PNCs,直径约为(0.87±0.2)nm,也称为Posner团簇;第二阶段CaP-PNCs 开始松散粘附于有机分子或基底物表面;第三阶段CaP-PNCs 开始聚集并形成直径约50nm 左右的CaP-PNCs 纳米团簇;第四阶段,CaP-PNCs 纳米团簇进一步成核聚集,形成ACP 纳米颗粒;第五阶段,随着时间的延长,ACP 纳米颗粒开始生长结晶,逐渐转化为晶体。即在生物矿化的过程中,最早期形成的是CaPPNCs,它们随后粘附于基底物表面成核聚集形成非晶态无定形中间相ACP,再成核、生长并转化为晶体。目前应用的仿生矿化制剂主要是上述第四、五阶段的纳米ACP 团聚物或低结晶的纳米羟基磷灰石,它们矿化活性相对较低,难以满足临床需求。上述第一、二、三阶段的CaP-PNCs 具有较高的矿化活性,是更为理想的仿生矿化制剂,但是CaPPNCs 极不稳定,可以在几秒钟内自发聚集甚至成核和转化(图5 a),因此,常常导致研究结果的重复性差。另外,不同的成核簇矿化前驱体的结构和稳定性,从而具有不同的矿化活性。例如聚丙烯酸稳定的钙磷矿化前驱体比聚天冬氨酸稳定的钙磷矿化前驱体更加团聚致密,因而具有相对较低的矿化活性(图5b)。
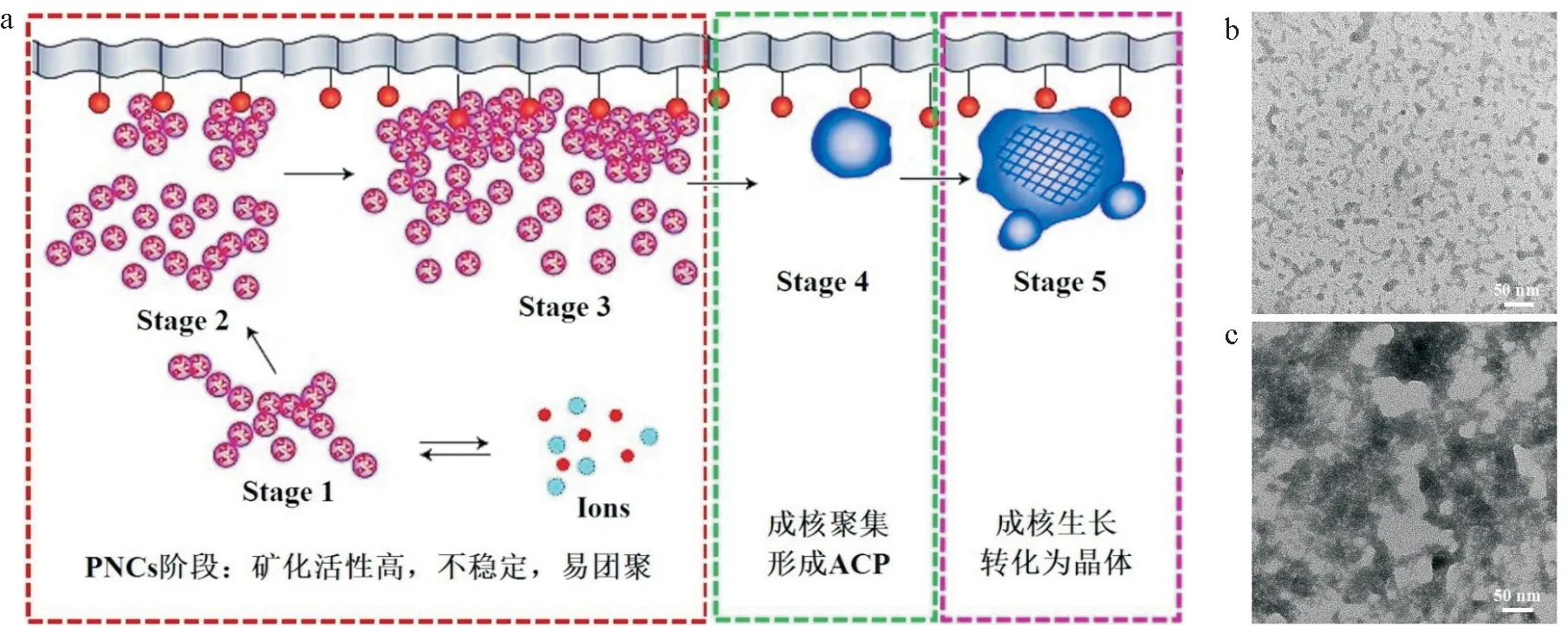
图5 生物矿化过程中钙磷离子预成核簇(PNC-CaP)不同阶段特点与晶体成核生长的关系
5 釉质再矿化的临床应用产品
再矿化治疗目前临床主要应用于没有形成龋洞的早期龋损、正畸治疗的白垩斑、酸蚀症的早期病损。氟制剂及其相关复合物产品,仍然占据治疗的主导地位,是再矿化治疗的“金标准”。非氟矿化制剂迅速发展,某些商品化的制剂声称获得了类似或优越于氟制剂的矿化效果,也克服了氟制剂应用潜在的安全问题担忧。商品化非氟矿化制剂概括如下:
5.1 摄取口腔唾液钙磷成分诱导矿化的制剂
这类制剂通过与牙齿脱矿部位结合、诱导内源性钙磷(如唾液)在其表面聚集、诱导钙磷成核、HA 晶体原位生长。P11-4 自组装多肽(Curodont Repair,Credentis,Windisch,Switzerland)是这类唯一商品化制剂[27-32]。其结构为:Ace-Gln-Gln-Arg-Phe-Glu-Trp-Glu-Phe-Glu-GlnGln-NH2。采用多肽合成仪合成。应用时,多肽单体溶液通过脱矿牙釉质的孔隙扩散到釉质龋损表面下方,在特定环境(如高离子浓度、酸性ph)下触发原位自组装成三维纤维支架,可模拟釉原蛋白控制晶体取向的功能,吸引聚集唾液中的Ca2+成核,仿生矿化过程中羟基磷灰石晶体的形成。P11-4 仿生再矿化已在体外被证明是治疗早期龋齿的有效方法,优于其他再矿化剂如氟化物、CPP-ACP 等。临床随机对照实验结果表明P11-4 与氟化物联合治疗能够起到更好的矿化作用,促进早期龋齿消退,优于单独使用氟化物。然而多肽纤维周围重新形成的晶体往往呈扇形排列,与平行排列的釉柱晶体有所区别。另外,矿化后多肽无法去除,难以达到较高的无机矿物量。P11-4 依赖于唾液驱动的自然再矿化,效果受个体唾液质量影响,如舍格伦综合征、头颈部放疗患者因唾液分泌减少效果可能受限;而且目前P11-4 仍缺乏更长期的临床实验数据。
5.2 提供外源性矿物原料诱导再矿化的制剂
5.2.1 CCP-ACP 制剂 酪蛋白磷酸肽稳定的无定形磷酸钙(Casein phospho-protein stabilized -amorphous calcium (fluoride) phosphate (CPP-ACP;CPP-ACFP) 以 商 品 名“Tooth Mousse/MI Paste Crèmes,Re-caldent/Trident White sugar-free gum and MI Paste One toothpaste”中文“护牙素”,作为牙膏糊剂或无糖口香糖的形式应用,是目前临床询证数据最丰富的钙磷制剂[33]。
该制剂是最具典型的有机基质调控无机晶体矿化概念应用的范例。水溶性的酸性蛋白分子稳定钙磷离子,形成有机-无机复合矿化前驱体。CCP含有大量的酸性残基,特别富含“-S(p)S(p)S(p)EE-”残基,在酸性条件下可以与钙磷离子相互作用,可以稳定很高浓度的钙磷,形成CCP-ACP,或CCP-ACFP 复合体,钙磷离子纳米簇,大小约1.53 nm 或2.13 nm,相对稳定存在于钙磷过饱和溶液中,具有一定的固态性质。CCP-ACP 复合体中,钙离子藏在于钙磷离子纳米簇表面与CPP 负电荷的残基通过静电相互作用。溶液中CCP 抑制了钙磷预成核簇的生长,保持相对的稳定性,从而抑制ACP 的相转变,HA 的结晶生长。研究表明CCP 与钙磷离子的作用相对较弱,游离钙磷与CCP 结合的钙磷保持着动态的平衡,CCP-ACP 复合体可以作为一个钙磷矿化源的储存库。这个平衡的移动与pH 值的改变、钙磷浓度的改变、CCP竞争性结合物的存在有关。当CCP-ACP 存在口腔中,CCP 具有很强的HA 结合性能,唾液的缓冲等因素,都可以促进钙磷离子簇的游离,ACP 相转变发生,HA 晶体的形成。目前大量的询证医学证据表明CCP-ACP 一定时期内的规律使用可以促进釉质再矿化,改善脱矿釉质的美学、力学、抗酸活性,提高唾液的缓冲功能,具有类似或优于氟制剂的功效。但是仍有矛盾的结果报道,可能源于CCP-ACP 与氟制剂防龋再矿化机理不同,研究设计的差异所致,但是目前还是需要大量的长期的多中心的研究来证明其效能。
5.2.2 其他钙磷制剂 纳米羟基磷灰石(nHA)是使用最广泛的钙磷再矿化制剂,常常在牙膏中使用。其矿化性能报道也具有较大争议。可能与颗粒大小、结晶度有关。颗粒越小,结晶度越低,与牙齿的结合性能越好,也越有利于钙磷的溶解平衡、晶体的形成。
无定形磷硅酸钙纳生物玻璃(Calcium sodium phosphosilicate (CSP,amorphous) bioglass),目前的商品化产品为NovaMinTM(Oravive toothpaste)。体外体内研究对其矿化性能都有较大的争议,需要进一步的临床试验[34-35]。
总之,龋病、慢性非龋性损伤性牙体疾病的无创微创性治疗临床需求极大地刺激了非氟矿化制剂的发展。牙体仿生矿化策略为牙体表面病损的治愈性修复提供新的研究思路,新的仿生矿化体系的开发是釉质再矿化研究的重要方向和临床需求。
6 结语
釉质的再矿化研究已经进入仿生矿化诱导釉质微结构再生的阶段,其部分研究结果在临床应用中也显示了良好的效果,但是仍然需要大量的临床实践的验证。由于对釉质生物矿化的物理化学调控本质缺少深入的理解,目前釉质仿生矿化技术体系具有一定的随意性、缺少严格的对照,文献报道中存在一定的误导,对于仿生矿化诱导釉质微结构再生晶体生长的本质规律缺少足够的试验证据。釉质仿生矿化的抗菌、矿化性能智能感知口腔环境变化而启动的技术是未来牙体组织再矿化研究的一个重要方向。

