湿空气环境下镁金属药柱释氢性能模拟研究
赵妍阳, 李 裕, 田忠霖, 李潇潇, 崔 剑
(中北大学 化学与化工学院, 山西 太原 030051)
0 引 言
镁金属药柱是水冲压发动机的主要能源燃料[1-2], 其燃烧性能决定着水冲压发动机的综合性能, 周杰等[3]、薛晓中等[4]的研究发现, 推进剂中镁金属燃料的含量越高, 水冲压发动机在能量和速度方面就具有越大的优势。因此, 研究水反应金属燃料技术具有极其重要的现实意义。Miller[5]深入研究了基于水下推进的水冲压发动机问题, 并采用高压给气方法研究了Mg/H2O等水反应金属燃料的特性[5]。刘迎吉等[6]研究了二茂铁类燃速催化剂对含镁铝富燃料推进剂一次燃烧性能的影响。黄海涛[7]通过工艺加工性能和燃烧性能优化筛选出镁基水反应金属燃料推进剂的最优配方。张天佑[8]利用FactSage软件进行了铝水反应热力学理论研究。
镁金属药柱的化学性质活泼, 在运输和存贮过程中极易与空气中的氧气和水汽发生反应, 导致其燃烧性能降低[9-12]。镁金属药柱与湿空气中的水汽反应属于典型的气固反应类型, 可采用气固缩芯模型进行研究。关于气固缩芯模型的研究, Levenspiel[13]给出了描述液体与球形固体颗粒接触和反应的非均相反应的传统计算模型。Razavi-Tousi等[14]考虑了非线性扩散系数和粒度增长的影响, 提出了一种改进的收缩核模型。Wang等[15]提出了一个水化模型来估计水泥水化过程中的放热率, 该模型进一步考虑了温度对水化速率的影响。迄今为止, 几乎没有关于镁金属药柱与湿空气中水汽反应的缩芯模型的研究, 本文通过反应缩芯模型对镁金属药柱的释氢性能进行模拟并通过实验进行验证, 以期为镁金属的安全运输和存贮环境提供理论依据。
1 模型建立
1.1 过程描述
镁金属药柱所处的环境温度为室温; 使用环境为通风良好, 无明火且设备接地、不产生静电火电; 贮存措施是作为裸药柱/条贮存于干燥环境, 内包装用牛皮纸或静电袋, 中包装用泡沫塑料, 外包装用木箱, 正面水平放置, 不许倒置。镁金属药柱含有镁粉、高氯酸钾及其他粘结剂和助剂等物质, 其中镁粉约占85%, 高氯酸钾及其他粘结剂和助剂约占15%。高氯酸钾及其他粘结剂和助剂均不与水蒸气反应。当镁金属药柱与水蒸气接触, 镁与湿空气中的水蒸气发生反应, 反应式为
Mg+2H2O(气)→Mg(OH)2+H2↑。
反应缩芯模型如图1 所示。

B-收缩未反应芯; P-新生成的固体产物
随着表面镁粉不断被消耗, 未反应芯逐渐缩小; 整个反应只在未反应芯表面进行; 生成的氢氧化镁留在反应物镁的位置, 用来使整个颗粒的体积保持不变。整个过程可分解为:
1)气相反应物水蒸气由气相主体通过气膜, 扩散到药柱固体外表面。
2)气相反应物水蒸气与固体外表面活性物质镁粉发生反应, 得到固相产物氢氧化镁, 气相产物氢气扩散到气相主体。
3)气相反应物水蒸气通过固相产物层扩散至反应芯, 继续与活性物质镁发生反应, 气相产物(氢气)通过固相产物层扩散到气相主体。
1.2 模型假设
1)药柱为致密材料, 镁分布均匀;
2)反应过程中, 反应系统的温度与湿度恒定不变。
3)反应产生的氢氧化镁膜为多孔结构, 水蒸气和氢气可通过孔隙扩散。
4)系统中水蒸气过量, 其浓度不变, 忽略水蒸气凝结和氢气吸附。
5)产物层扩散控制为整个过程的控制步。
6)忽略氧气的影响。
1.3 模型建立
1.3.1 总传质速率
药柱是圆柱体, 其表面积为
S=2πhR+2πR2。
(1)
产物层扩散控制过程的传质速率可表示为

(2)
式中:Rs为药柱半径, cm;Rc为药柱反应芯半径, cm;h为药柱高度, cm;De为有效扩散系数, cm2·s-1;cA为气相反应物A(水蒸气)的界面浓度, mol·L-1;NAD为气相反应物的传质速率, mol·(m2·s)-1。
在稳定情况下, 单位时间内通过产物层任何表面上的量是相等的, 扩散速率不随药柱半径Rs和药柱反应芯半径Rc变化, 积分可得

(3)
式中:cAs为药柱界面的水蒸气浓度, mol·L-1;cAc为药柱反应芯界面的水蒸气浓度, mol·L-1;δ为反应层高度, cm。
由于缩芯反应存在内扩散阻力, 反应越往内层, 阻力越大, 对于药柱而言, 反应量会急剧减小, 甚至会停止反应, 故药柱反应层可简化处理, 认为Rc+δ≈Rs+δ。得

(4)
水蒸气A通过气膜的传递速率(外扩散)为
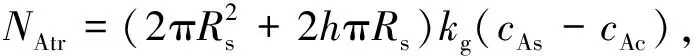
(5)
式中:kg为水蒸气在药柱中的传质系数, m2·s-1;NAtr为外扩散传递速率, mol·(m2·s)-1。
气相反应物A(水蒸气)与固相反应物B(镁)在反应芯表面反应的消耗速率为
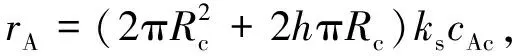
(6)
式中:ks为反应速率常数, m·s-1;rA为反应速率, mol·(m2·s)-1。
结合式(4)~式(6), 当镁金属药柱的粒径不变时, 在单颗镁金属颗粒上进行等温一级不可逆反应的反应速率式为
NAtr=NAD=rA=
式中:cAg为药柱表面水蒸气的浓度, mol·L-1。
固相反应物B的转化率随时间的变化关系与气相反应物A的消耗速率的关系为
A(g)+bB(s)→fF(g)+pP(s)
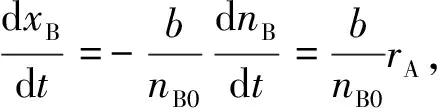
(8)
式中:xB为反应物B的转化率;nB0为反应物B初始物质的量, mol;nB为反应物B反应后的物质的量, mol。
假设反应物B的密度为ρB, 反应物B的相对分子质量为MB, 则B初始物质的量为

(9)
由反应物B转化率的定义, 可以得到反应芯的半径Rc与药柱半径Rs的比值为

(10)
式中:ρs为药柱界面密度, g·cm-3;ρc为药柱反应芯界面密度, g·cm-3;Ms为药柱界面相对分子质量;Mc为药柱反应芯界面相对分子质量。
1.3.2 产物层扩散控制
反应物水蒸气在镁金属药柱表面的浓度近似等于其在氢气气流主体的浓度, 反应的初始浓度近似为反应平衡的浓度, 即cAg≈cAs,cA≈cAc。

(11)
将rA代入式(8), 可以得到
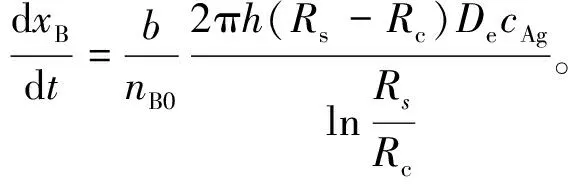
(12)
式(12)积分可得转化率与时间的关系为
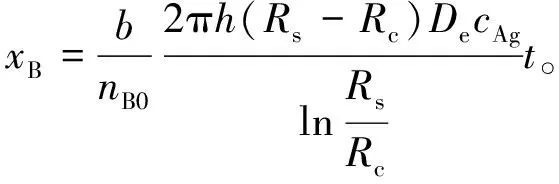
(13)
令转化率为1, 可得药柱固体颗粒完全反应的时间为
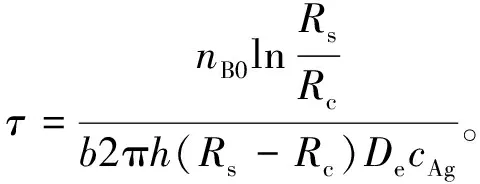
(14)
1.3.3 氢气浓度与反应时间的关系
由化学反应式可知, 1 mol Mg与水蒸气充分反应产生1 mol氢气, 简化起见, 将药柱视作含镁元素为85%。本文中所用镁金属药柱的密度为1.59×103kg·m-3, 高度为20 mm。
由式(9)可求得镁金属药柱的物质的量为0.354 mol。
由药柱中镁金属与水蒸气的反应式可以求得药柱在相应转化率时所产生的氢气的物质的量, 记产生氢气的物质的量为nH, 可表示为
nH=xBnB0。
(15)
将式(9)代入式(15), 可得到产生氢气的物质的量与反应物转化率的关系为
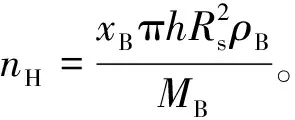
(16)
氢气的质量为

(17)
由体积分数的计算公式, 可得氢气质量的浓度为

(18)
式中:V为反应容器的体积, m3。
联立式(13)和式(18), 可得金属药柱水反应中产物层扩散控制释放氢气的质量浓度与时间的关系为

(19)
2 模型求解
2.1 反应层中扩散系数的确定
在反应层中, 金属镁与水蒸气发生反应后形成堆积层, 而镁金属药柱是经过挤压成型的, 所以孔隙较为致密, 磁撞主要发生在气体分子与孔壁之间, 即为克努森扩散。

(20)
式中:DK为克努森扩散系数, cm·s-1;T为温度, K;M为扩散物质的相对分子质量;d0为微孔孔径, cm。
微孔孔径d0可以用当量直径进行计算。不同温度下水蒸气在不同孔径中的扩散系数见图2。
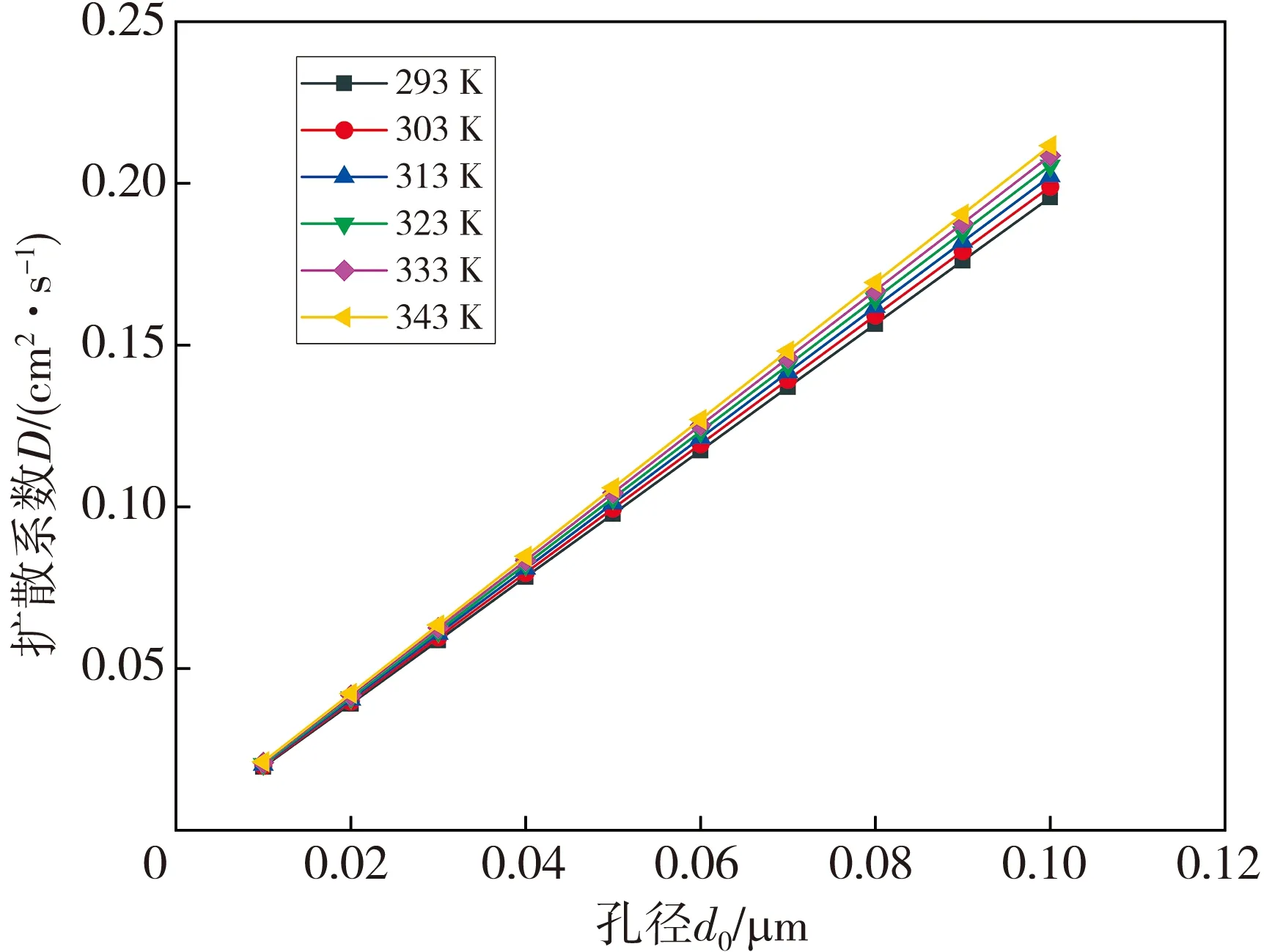
图2 不同温度下水蒸气在不同孔径中的扩散系数
由图2 可知: 在相同孔径下, 随着温度的逐渐升高, 水蒸气在孔径中的扩散系数逐渐增大; 在相同温度下, 随着孔径的逐渐变大, 水蒸气在孔径中的扩散系数逐渐增大。
不同温度下氢气在不同孔径中的扩散系数见图3。
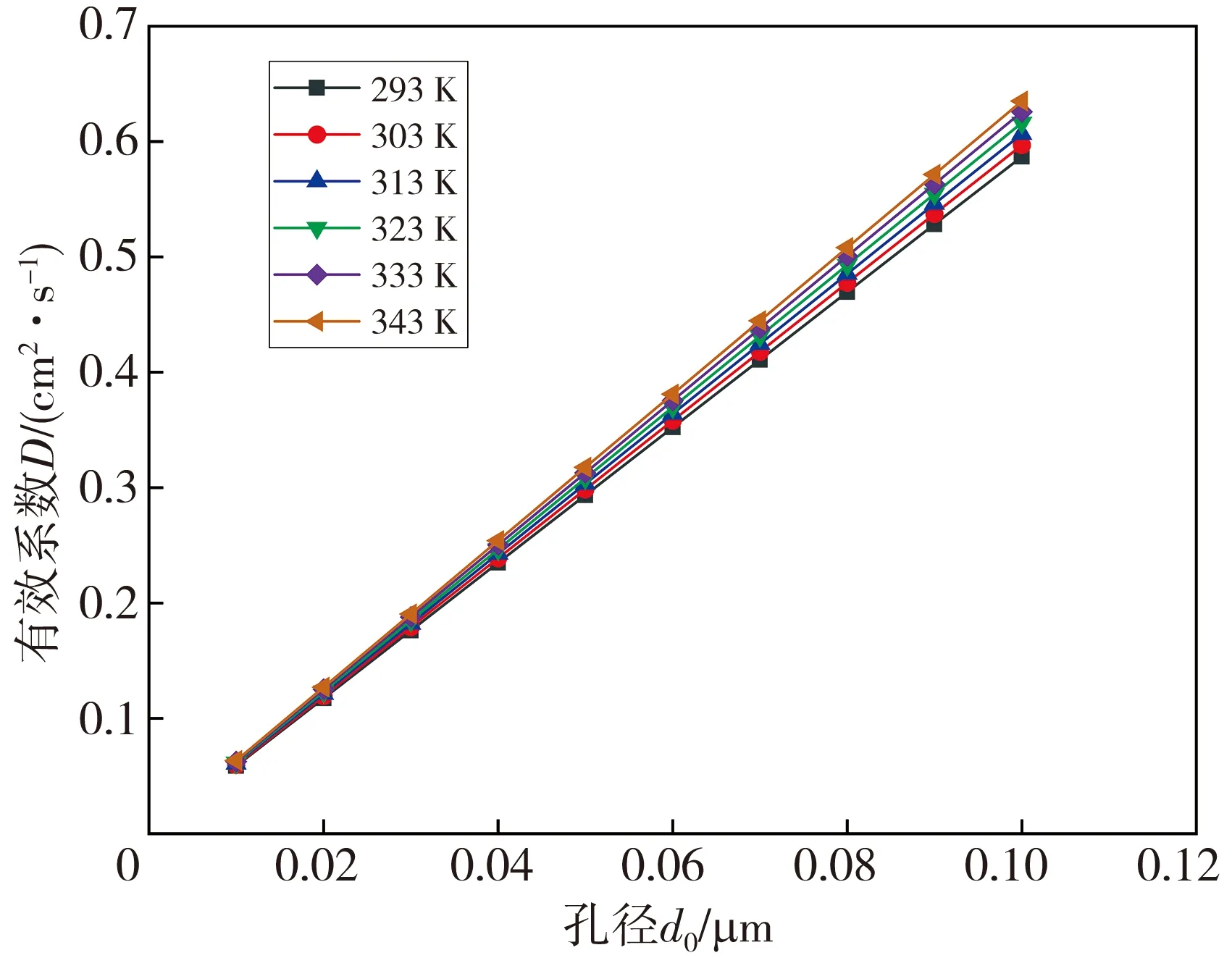
图3 不同温度下氢气在不同孔径中的扩散系数
由图3 可知: 在相同孔径下, 随着温度的逐渐升高, 氢气在孔径中的扩散系数逐渐增大; 在相同温度下, 随着孔径的逐渐变大, 氢气在孔径中的扩散系数逐渐增大。
2.2 模拟结果
2.2.1 金属药柱在湿气体下的湿度分析
设定初始温度分别为50 ℃和60 ℃, 假设孔径大小为0.01 μm, 在Matlab模型中湿度分别调节为0, 30%, 60%, 100%, 得到的模拟结果见图4。
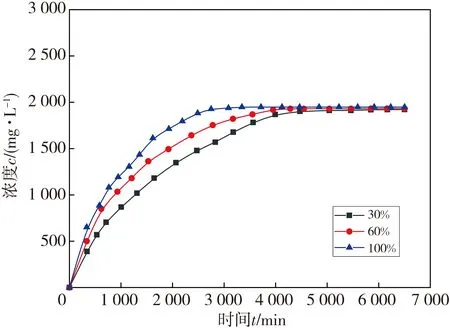
(a)初始温度50 ℃
由图4 可知, 湿度为0时, 反应不产生氢气。初始温度为50 ℃, 反应湿度为30%时, 在反应初期, 水反应释放氢气的速率不断增加, 当达到5 000 min时, 氢气浓度基本稳定, 约为2 000 mg·L-1; 随着反应湿度的增加, 在反应初期, 水反应释放氢气的速率不断增加。当初始温度变为60 ℃时, 水反应金属药柱释放氢气的速率和氢气的浓度与初始温度为50 ℃时相比明显变大。当反应湿度为100%时, 同等温度下, 氢气浓度达到最大所用的时间更短, 故较适宜的湿度为100%。
2.2.2 金属药柱在湿气体下的温度分析
设定初始湿度分别为30%和60%, 假设孔径大小为0.01 μm, 在Matlab模型中温度分别调节为20 ℃, 40 ℃, 50 ℃, 60 ℃, 得到的模拟结果见图5。

(a)初始湿度30%
由图5 可知, 初始湿度为30%, 反应温度为20 ℃时, 在反应开始的6 000 min内, 水反应释放氢气的速率不断增大, 之后趋于稳定, 氢气浓度约为1 500 mg·L-1。随着反应温度的升高, 反应初期释放氢气的速率也不断升高, 当反应温度达到40 ℃, 50 ℃和60 ℃, 对应的时间达到5 500 min, 4 800 min和4 200 min时, 氢气浓度逐渐趋于稳定, 浓度分别为1 700 mg·L-1, 2 000 mg·L-1和2 400 mg·L-1。当初始湿度为60%时, 水反应金属药柱释放氢气的量与初始湿度为30%时相比有所升高, 但升高的幅度不太大。但是, 当反应温度为60 ℃时, 同等湿度下, 氢气浓度达到最大浓度所用的时间更短, 故较适宜的温度为60 ℃。
3 实验验证
将药柱竖直放置在反应釜中, 打开氮气对管路进行吹扫, 直置空气被完全置换。
3.1 不同温度下药柱释氢速率的影响
镁金属药柱在相对湿度为60%, 反应釜温度为20 ℃, 氮气循环流量为3 L·min-1时的释氢规律见图6。

图6 药柱释氢浓度监测结果(20 ℃)
由图6 可知, 开始时氢气浓度不断升高, 当达到6 000 min时, 氢气浓度基本趋于稳定, 约为1 500 mg·L-1。同时, 可以看出实验结果与模拟结果基本一致。
镁金属药柱在相对湿度为60%, 反应釜温度为50 ℃, 氮气循环流量为3 L·min-1的环境中反应, 当释放氢气的浓度趋于稳定后, 升高反应釜温度至70 ℃, 整个过程的释氢规律见图7。
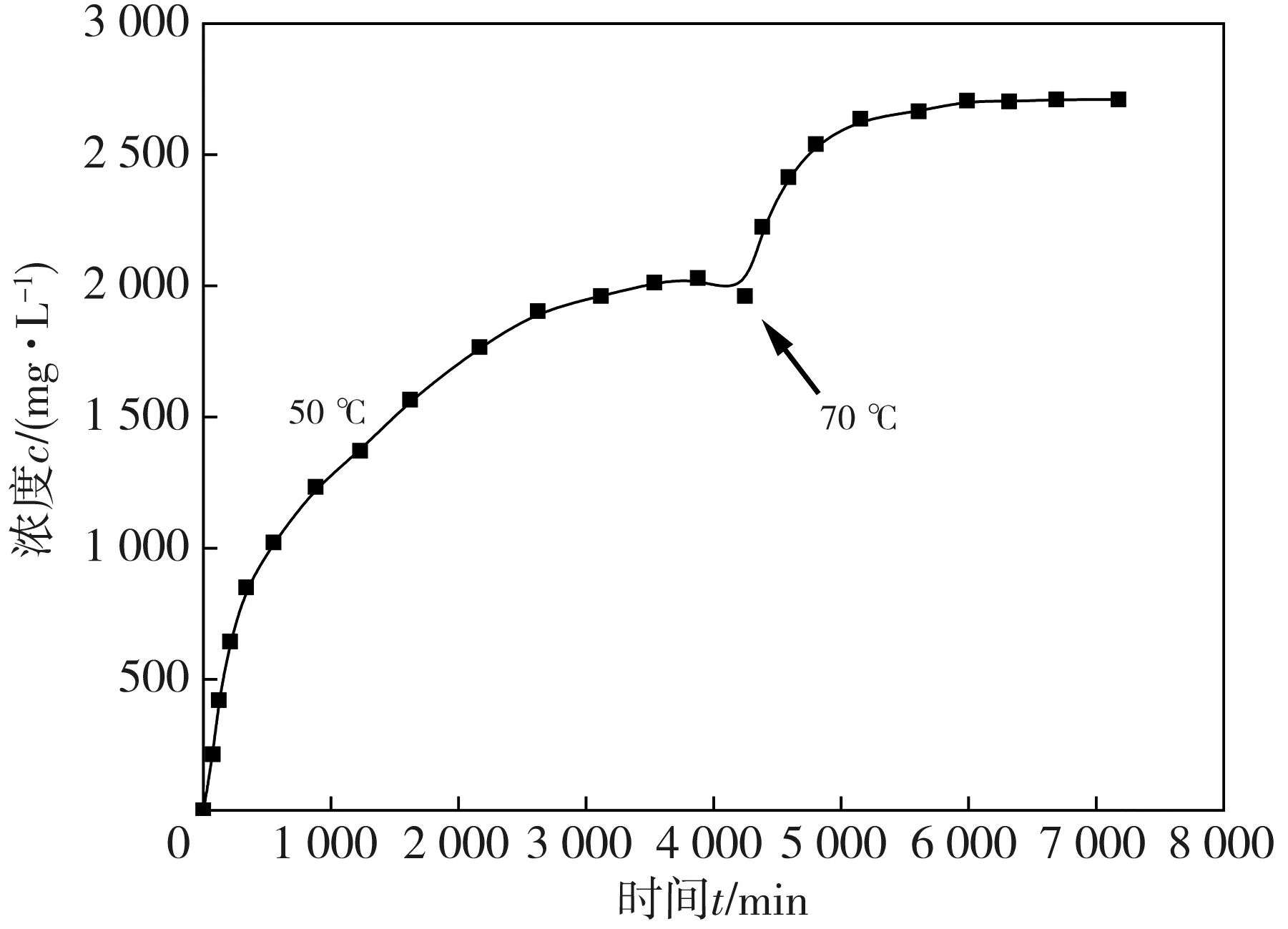
图7 药柱释氢浓度监测结果(50 ℃→70 ℃)
由图7 可知, 开始时氢气浓度不断升高, 当达到4 000 min时, 氢气浓度基本趋于稳定, 接近2 000 mg·L-1。此时, 将反应釜温度升高到70 ℃, 系统中氢气浓度继续升高, 在7 000 min时, 浓度稳定在2 600 mg·L-1左右。可见, 水浴温度越高, 氢气浓度达到稳定的时间越短, 升高温度能缩短氢气浓度达到稳定的时间。
3.2 不同湿度下药柱释氢速率的影响
反应釜温度为50 ℃, 氢气循环流量为3 L·min-1时, 镁金属药柱在不同湿度下的释放氢气规律见图8。图中, 实线为模拟值, 虚线为实验值。
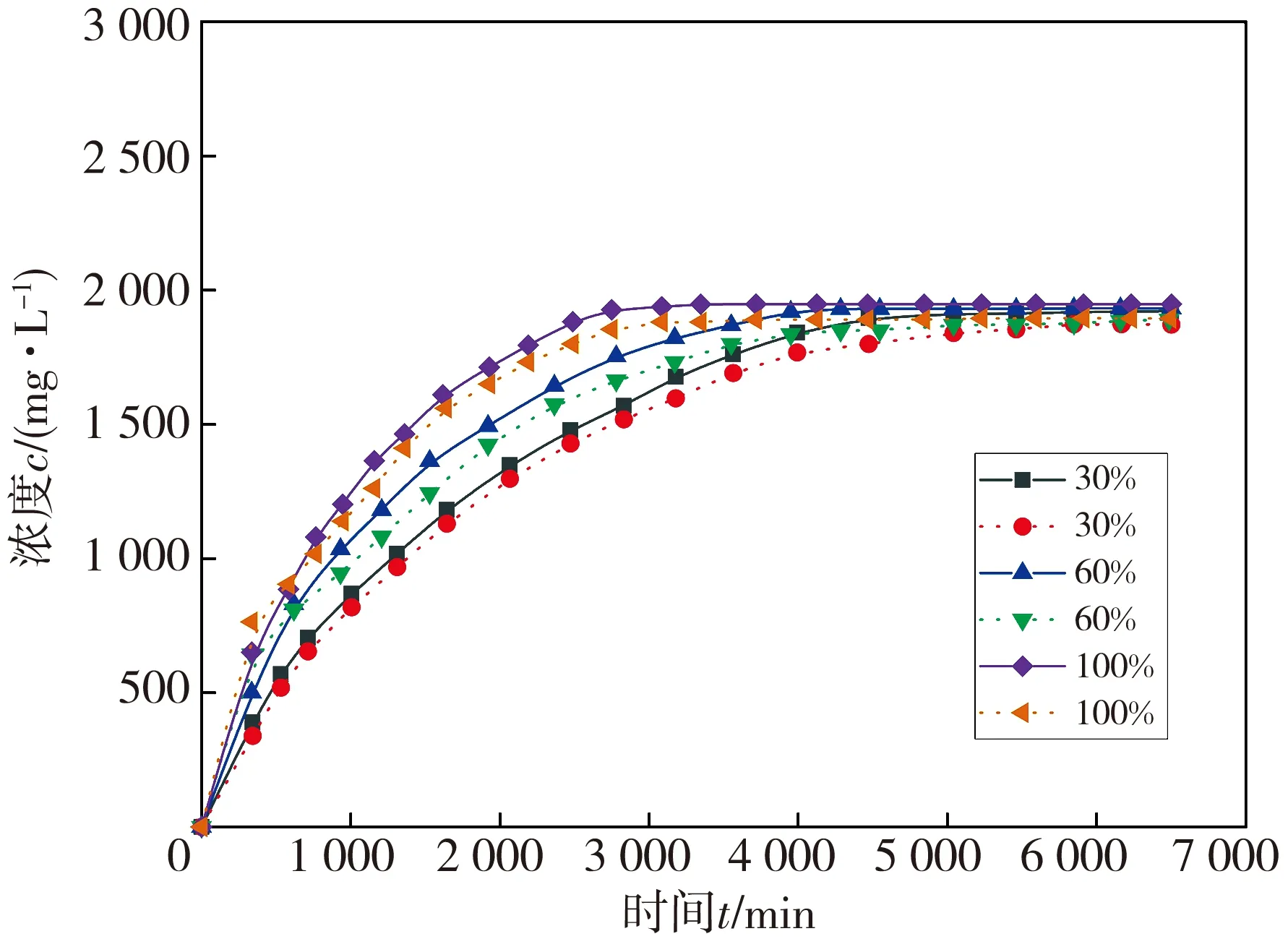
图8 药柱在不同湿度下释放氢气的规律(50 ℃)
由图8 可知, 干气条件下不产生氢气, 随着湿度的增加, 释氢速率加快, 在相同温度下最终的释氢量相差不大。由此可见, 湿度升高开始阶段能促进药柱释氢, 不同湿度下的最终氢气浓度相差不大, 温度决定反应最终的氢气的浓度。同时, 可以看出实验结果与模拟结果基本一致。
4 结 论
本文利用Matlab软件并基于产物层扩散控制对镁金属药柱反应缩芯模型进行研究, 得到了在不同温度和湿度条件下水反应金属药柱的释氢性能, 并通过实验验证了模拟结果的正确性, 最终得到以下结论:
1)初始温度为50 ℃时, 反应过程中的湿度越大, 在反应初期的反应速率就越大, 释放氢气的浓度趋于稳定的时间就越短, 但随着湿度的增加, 水反应释放氢气浓度的大小相差不大, 约为2 000 mg·L-1左右, 当湿度为0的时候, 反应不产生氢气。而当初始温度变为60 ℃时, 水反应金属药柱释放氢气的速率和氢气的浓度明显变大, 氢气浓度达到2 400 mg·L-1左右。
2)初始湿度为30%时, 反应过程中随着温度的升高, 在反应初期, 水反应释放氢气的速率不断增加, 释放氢气的浓度趋于稳定的时间不断减少, 且温度越高, 水反应最终释放氢气的浓度就越高, 反应程度也越大, 氢气最终趋于稳定的浓度由1 500 mg·L-1升到2 400 mg·L-1。当初始湿度为60%时, 水反应金属药柱释放氢气的速率有所升高, 但升高的幅度不太大, 释放氢气的浓度也相差不大, 依旧由1 500 mg·L-1左右升到2 400 mg·L-1左右。
3)升高温度对镁金属药柱释氢性能的影响更为明显。

