‘赞皇大枣’和‘冬枣’对干旱胁迫的生理响应
张露荷,赵 通,黄华梨,王 博,张 德,王 芳,王多锋,李 毅
(1.甘肃农业大学林学院,甘肃 兰州 730070;2.甘肃省林业科学研究院,甘肃 兰州 730020)
干旱显著影响植物各阶段的生长发育、生理生化代谢过程和生态环境,是植物成活与生长的重要限制因素之一。植物在干旱胁迫下,除了在形态结构上发生适应性变化以外,其内部生理生化代谢也会产生一定的调整以适应干旱环境。枣树是抗旱性较强的树种之一,在改良荒滩、水土保持、改善生态环境等方面作用重大,是防风固沙的“急先锋”,在我国西北干旱地区分布较多,但降雨量偏少或季节性干旱往往制约着枣树的稳产和高产[1]。因此,选育抗旱性强的枣品种对枣产业的可持续发展及退耕还林具有重要意义。
植物幼苗生长阶段对水分最为敏感,此阶段也是水分不足容易导致植株死亡的关键时期[2]。植物对干旱胁迫的响应因干旱胁迫的程度、胁迫时长和植物种类的不同而存在差异。水分胁迫后,植株表现出器官萎缩甚至停止生长,所以当植物受到干旱胁迫时就会出现负增长[3]。枣树在生长期受到干旱胁迫会影响其抽枝、展叶、现蕾、开花和座果[4],枣树叶片在受到干旱胁迫时会通过卷曲来减小受光面,关闭部分气孔,减小蒸腾来减少水分散失[5]。干旱胁迫导致枣树叶片变黄、枯萎或脱落,枣吊变软,幼果黄化、枣果脱落,直接影响枣树的产量和枣果的质量。
植物受逆境胁迫时,细胞内因自由基的产生与清除之间的平衡受到破坏而出现自由基的累积,在细胞缺乏保护机制时,它们可能对细胞结构和功能产生不同的伤害[6]。植物受水分胁迫时能做出多种抗逆性反应,除气孔关闭、蒸腾下降、生长抑制外,还有渗透调节能力和抗氧化能力的提高,以及产生抗逆蛋白等。前人对枣树抗旱性的研究略显匮乏,对枣树抗旱机理的阐述较少,已见报道的品种主要有‘梨枣’、‘蒙山脆枣’、‘沾化冬枣’、‘狗头枣’、‘掉牙枣’、‘木枣’和‘骏枣’等[7-11],‘赞皇大枣’和‘冬枣’两个品种的抗旱性研究尚未见报道。本研究通过盆栽试验结合人工灌水后自然耗水的方法,测定干旱条件下3 a生枣树截干苗的生长状况、光合生理及叶绿素荧光参数、抗逆生理指标的变化情况,进而揭示两个枣树品种对干旱胁迫的响应机制,以期为该两个枣树品种在干旱区的栽培推广提供理论依据。
1 材料与方法
1.1 试验设计
于2021年3—7月在甘肃农业大学标准设施温室进行盆栽试验,以河北农业大学提供的3 a生‘赞皇大枣’和‘冬枣’枣树品种嫁接苗为试验材料,砧木均为长基枝酸枣,两个枣树品种均为定干80 cm的截干苗;设干旱(T)和正常灌水(CK)两种处理。枣树萌芽前灌水一致;在枣树全部萌芽后的生育期进行干旱处理(土壤含水量为田间持水量的25%±5%),对照植株保持土壤水分充足但不涝(土壤含水量为田间持水量的65%±5%),定期用土壤湿度计监测。每个处理的试验设计为随机完全区组试验,每个处理3次重复,每个重复选取5盆长势一致的枣树苗,每盆定植1株,共15株;塑料盆口直径50 cm,盆高37 cm。栽培基质配比为45%田园土+40%泥炭土+10%粗沙+5%腐熟的有机肥。通过观察叶片表型,叶片在处理第21 d时大多数萎蔫,此时测定以下指标并采集叶片,所采叶片保存在-80℃超低温冰箱,用以后续测定相关指标。
1.2 测定指标及方法
1.2.1 枣树生长指标及叶绿素含量 随机选取各处理的6株枣树苗,用直尺测量每株所有新梢长度和枣吊长度;每株随机测量20个叶片的长度和宽度;在距离主干1 cm处用游标卡尺测量所有的新梢直径,各测定结果均取平均值。采用乙醇-丙酮1∶1的混合液浸提比色法测定枣树叶片叶绿素总量、叶绿素a、叶绿素b含量[12]。
1.2.2 叶片光合特性 各处理选3株树,每株选择新梢的第3、4片无机械损伤、无病虫害的叶片进行测定。利用LI-6400便携式光合测定分析仪于晴天9∶00—11∶00测定光合生理参数(净光合速率Pn、气孔导度Gs和蒸腾速率Tr)和叶绿素荧光参数(重复6次)。测定叶绿素荧光参数前暗适应30 min,然后采用配备的叶绿素荧光叶室,分别测定暗适应后叶片的初始荧光(F0)、最大荧光(Fm)等荧光参数;再照射远红光,测定其光下最小荧光(F0′)、光下最大荧光(Fm′)和稳态荧光(Fs);之后仪器自动计算出光化学量子效率(Fv/Fm)、PSⅡ反应中心电荷分离实际量子效率(ΦPSⅡ)、光化学猝灭系数(qP)和非光化学猝灭系数(qN)。
1.2.3 渗透调节物质 使用DDS-11A型数字显示电导仪测定相对电导率,采用泉州市睿信生物科技有限公司RXWB0005-96试剂盒测定丙二醛(MDA)含量,采用蒽酮法测定可溶性糖含量[13],采用水合茚三酮比色法测定脯氨酸(Pro)含量[14],采用考马斯亮蓝G-250法(Bradford法)测定可溶性蛋白含量[13]。
1.2.4 抗氧化酶活性 采用泉州市睿信生物科技有限公司的试剂盒进行测定抗氧化酶活性,其中超氧化物歧化酶(SOD)活性测定使用RXWB0482-96试剂盒,过氧化物酶(POD)活性测定使用RXWB0111-96试剂盒,过氧化氢酶(CAT)活性测定使用RXWB0478-96试剂盒,谷胱甘肽S-转移酶(GST)活性测定使用RXWB0099-96试剂盒。
1.2.5 内源激素 按照张莹等[15]的方法提取枣树叶片的内源激素,后用ACCHROM S3000高效液相色谱仪进行测定。HPLC液相条件:Alphasil VC-C18(4.6 mm×250 mm,5 m)色谱,流动相的配制:量取600 mL超纯水,加入6 mL乙酸混匀溶解,加入400 mL甲醇并混匀。打开电脑、泵和检测器,安装色谱柱,打开软件,设置进样量10 μL,流速0.8 mL·min-1,柱温30℃,走样时间40 min,紫外检测波长254 nm。用流动相过柱子,待基线稳定后开始添加样品。用标准曲线计算激素含量,每种激素的标准曲线方程及保留时间如下:(1)玉米素核苷(ZR):y=301.705x-1.191,R2=0.9994,保留时间4 min;(2)脱落酸(ABA):y=364.24x-3.0204,R2=0.9999,保留时间27 min;(3)赤霉素(GA3):y=366.73x-0.4804,R2=0.9999,保留时间6.9 min;(4)吲哚乙酸(IAA):y=389.026x-0.149,R2=0.9991,保留时间15 min。
1.3 数据处理与分析
用Excel 2007软件进行数据整理,用SPSS 22.0统计软件对数据进行统计和差异显著分析(P≤0.05),用Origin 2018作图。
2 结果与分析
2.1 干旱胁迫对‘冬枣’和‘赞皇大枣’生长的影响
2.1.1 新梢和枣吊生长 由表1可知,干旱胁迫抑制了两种枣树新梢长度和直径的增长,但抑制程度尚未达显著水平(P>0.05);在正常灌水和干旱处理下,‘赞皇大枣’新梢长度均大于‘冬枣’。干旱胁迫显著减少了‘冬枣’的新梢节间数,为CK的54.50%。干旱胁迫均减少了两个枣树品种的新梢上叶片个数,与CK相比,‘赞皇大枣’和‘冬枣’新梢上叶片个数分别减少了34.69%和57.14%;在正常灌水和干旱胁迫条件下,‘赞皇大枣’的新梢上叶片个数分别为‘冬枣’的3.21倍和5.48倍。干旱胁迫后,‘赞皇大枣’的单株枣吊总数下降了45.61%。干旱胁迫显著缩短了两个枣树品种的枣吊长度,与正常灌水相比较,干旱处理后‘赞皇大枣’和‘冬枣’的枣吊长度分别缩短了54.14%和41.86%;两个枣树品种在正常灌水和干旱胁迫下的枣吊上叶片数无显著性差异;‘赞皇大枣’的枣吊上叶片数显著多于‘冬枣’。

表1 干旱胁迫对‘冬枣’和‘赞皇大枣’新梢和枣吊生长的影响Table 1 Effect of drought stress on the growth of new branch and jujube hanging of ‘Dongzao’ and ‘Zanhuangdazao’
2.1.2 叶片生长及叶绿素含量 如表2所示,干旱胁迫显著抑制了两个枣树品种的叶片长度,与CK相比,干旱处理后‘赞皇大枣’和‘冬枣’的叶片长度分别缩短了27.62%和30.78%;在正常灌水和干旱胁迫条件下,‘赞皇大枣’的叶片长度、叶片宽度均大于‘冬枣’。干旱胁迫对两个枣树品种的叶片宽度无显著影响。干旱胁迫显著降低了两个枣树品种的叶绿素a、叶绿素b含量和叶绿素总量,与CK相比,干旱处理后‘赞皇大枣’的叶片叶绿素a、叶绿素b含量和叶绿素总量分别降低了18.75%、19.56%和18.94%,‘冬枣’分别降低了29.44%、28.93%和29.32%。在正常灌水和干旱胁迫条件下,‘赞皇大枣’的叶绿素a、叶绿素b含量和叶绿素总量均高于‘冬枣’。相比‘赞皇大枣’,‘冬枣’的叶片生长和叶绿素含量对干旱胁迫更加敏感。

表2 干旱胁迫对‘冬枣’和‘赞皇大枣’叶片生长及叶绿素含量的影响Table 2 Effects of drought stress on the leaf of ‘Dongzao’ and ‘Zanhuangdazao’
2.2 干旱胁迫对‘冬枣’和‘赞皇大枣’叶片光合生理参数的影响
干旱胁迫显著降低了两个枣树品种的Pn、Gs和Tr(图1)。正常灌水时,‘赞皇大枣’叶片Pn、Gs和Tr分别为‘冬枣’的1.75倍、1.72倍和1.36倍;干旱处理下,‘赞皇大枣’叶片Pn、Gs和Tr分别为‘冬枣’的1.89倍、5.15倍和3.82倍。与CK相比,干旱处理后‘赞皇大枣’的Pn、Gs和Tr分别降低了64.62%、71.03%和75.96%,而‘冬枣’分别降低了67.20%、90.33%和91.41%;干旱胁迫显著降低了‘冬枣’的胞间CO2浓度(Ci),降幅为48.07%;而干旱胁迫对‘赞皇大枣’Ci的影响不显著。干旱胁迫对‘冬枣’光合的影响程度均高于‘赞皇大枣’。
2.3 干旱胁迫对‘冬枣’和‘赞皇大枣’叶片叶绿素荧光参数的影响
如图2所示,干旱胁迫显著增高了两个枣树品种的F0。与CK相比,干旱胁迫后‘赞皇大枣’和‘冬枣’的F0分别增加17.73%和30.79%。在正常灌水和干旱处理下,‘赞皇大枣’和‘冬枣’的F0之间均无显著性差异。干旱胁迫显著降低了两个枣树品种的Fm、Fv/Fm和ΦPSⅡ,与CK相比,干旱处理后‘赞皇大枣’的Fm、Fv/Fm、ΦPSⅡ分别降低了22.65%、24.81%、71.81%,‘冬枣’分别降低了30.87%、33.11%、83.49%。在正常灌水和干旱处理下,‘赞皇大枣’的Fm分别为‘冬枣’的1.16倍和1.30倍。正常灌水时,‘赞皇大枣’和‘冬枣’的Fv/Fm、ΦPSⅡ之间均无显著性差异,然而在干旱处理下,‘赞皇大枣’的Fv/Fm和ΦPSⅡ均显著高于‘冬枣’,干旱胁迫后‘赞皇大枣’的ΦPSⅡ较‘冬枣’提高97.69%。

注:不同小写字母表示处理间差异显著(P<0.05)。下同。Note:Different lowercase letters indicate significant differences (P<0.05).The same below.图1 干旱胁迫对‘冬枣’和‘赞皇大枣’光合参数的影响Fig.1 Effect of drought stress on photosynthetic physiological parameters of ‘Dongzao’ and ‘Zanhuangdazao’
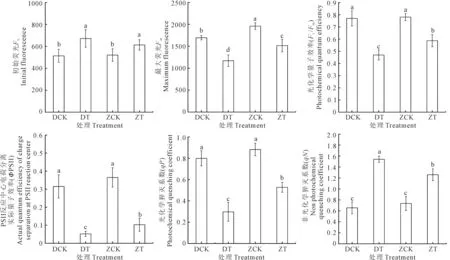
图2 干旱胁迫对‘冬枣’和‘赞皇大枣’叶绿素荧光参数的影响Fig.2 Effect of drought stress on chlorophyll fluorescence parameters of ‘Dongzao’ and ‘Zanhuangdazao’
干旱胁迫显著降低了两个枣树品种的qP;与CK相比,干旱处理后‘赞皇大枣’和‘冬枣’的qP分别降低了40.26%和62.34%。干旱处理下,‘赞皇大枣’的qP显著高于‘冬枣’。干旱胁迫显著增高了两个枣树品种的qN,与CK相比,干旱处理后‘赞皇大枣’和‘冬枣’的qN分别增加71.46%和118.52%。正常灌水时,‘赞皇大枣’和‘冬枣’的qN之间无显著性差异,然而在干旱处理下,‘赞皇大枣’的qN显著低于‘冬枣’。相比于‘冬枣’,干旱胁迫后‘赞皇大枣’的qP提高77.25%、qN降低18.29%。
2.4 干旱胁迫对‘冬枣’和‘赞皇大枣’叶片渗透调节物质含量的影响
如表3 所示,干旱胁迫显著增高了两个枣树品种的相对电导率。与CK相比,干旱胁迫后‘赞皇大枣’和‘冬枣’叶片的相对电导率分别增加60.35%和75.36%。干旱胁迫后,‘冬枣’的相对电导率较‘赞皇大枣’显著提高16.01%。干旱胁迫显著增高了两个枣树品种的MDA、Pro和可溶性糖含量,与正常灌水处理相比,干旱胁迫后‘赞皇大枣’的MDA、Pro和可溶性糖含量分别增高了29.84%、1506.10%和45.40%,‘冬枣’分别增高了55.84%、784.32%和110.74%。干旱处理下,‘赞皇大枣’的Pro和可溶性糖含量分别为‘冬枣’的1.55倍和1.71倍。干旱胁迫显著增高了‘赞皇大枣’的可溶性蛋白含量,增幅为24.34%,但显著降低了‘冬枣’的可溶性蛋白含量,降幅为11.57%。干旱胁迫后,‘冬枣’的Pro和可溶性蛋白含量较‘赞皇大枣’分别显著降低35.49%和35.98%。
2.5 干旱胁迫对‘冬枣’和‘赞皇大枣’叶片抗氧化酶活性的影响
如表4 所示,干旱胁迫显著增高了两个枣树品种的SOD活性。与CK相比,干旱胁迫后‘赞皇大枣’和‘冬枣’的SOD活性分别增高了63.98%和34.16%;干旱胁迫显著增高了‘赞皇大枣’的POD活性,增幅为13.43%,却显著降低了‘冬枣’的POD活性,降幅为53.82%;正常灌水时,‘赞皇大枣’和‘冬枣’的POD活性之间无显著性差异;干旱胁迫后,‘赞皇大枣’的SOD和POD活性分别比‘冬枣’提高25.77%和76.82%。干旱胁迫显著增高了两个枣树品种的CAT和GST活性,与CK相比,干旱胁迫后‘赞皇大枣’的CAT和GST活性分别增高了56.60%和61.60%,‘冬枣’分别增高了58.78%和62.88%;‘赞皇大枣’的CAT活性在正常灌水和干旱处理下均显著高于‘冬枣’。‘赞皇大枣’的GST活性在正常灌水和干旱处理下与‘冬枣’均无显著性差异。
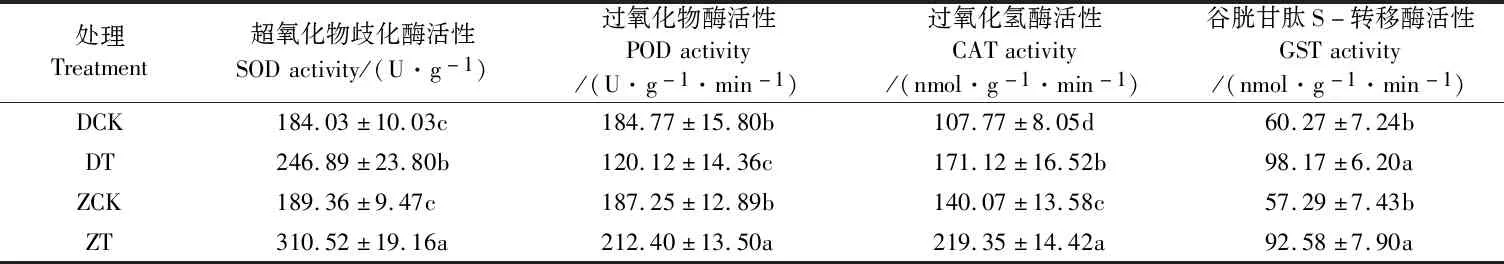
表4 干旱胁迫对‘冬枣’和‘赞皇大枣’叶片抗氧化酶活性的影响Table 4 Effect of drought stress on the activities of antioxidant enzymes in leaf of ‘Dongzao’ and ‘Zanhuangdazao’
2.6 干旱胁迫对‘冬枣’和‘赞皇大枣’叶片内源激素含量的影响
如表5 所示,干旱胁迫显著升高了两个枣树品种的ZR和ABA含量。与CK相比,干旱胁迫后‘赞皇大枣’的ZR和ABA含量分别升高了39.90%和61.77%,‘冬枣’分别升高了39.21%和29.19%;正常灌水和干旱处理下,‘赞皇大枣’的ZR含量均显著高于‘冬枣’;干旱处理下,‘赞皇大枣’的ABA含量为‘冬枣’的1.31倍。干旱胁迫显著降低了‘冬枣’的GA3含量,但对‘赞皇大枣’的GA3含量无显著影响。干旱胁迫显著降低了两个枣树品种的IAA含量,与CK相比,干旱胁迫后‘赞皇大枣’和‘冬枣’的IAA含量分别降低了34.72%和51.88%;正常灌水和干旱处理下,‘赞皇大枣’的IAA均显著高于‘冬枣’。干旱胁迫后‘赞皇大枣’4种激素的含量均显著高于‘冬枣’;干旱处理后‘赞皇大枣’和‘冬枣’的IAA/ABA、GA3/ABA均显著下降,降幅分别为59.72%、40.76%和62.77%、56.34%。
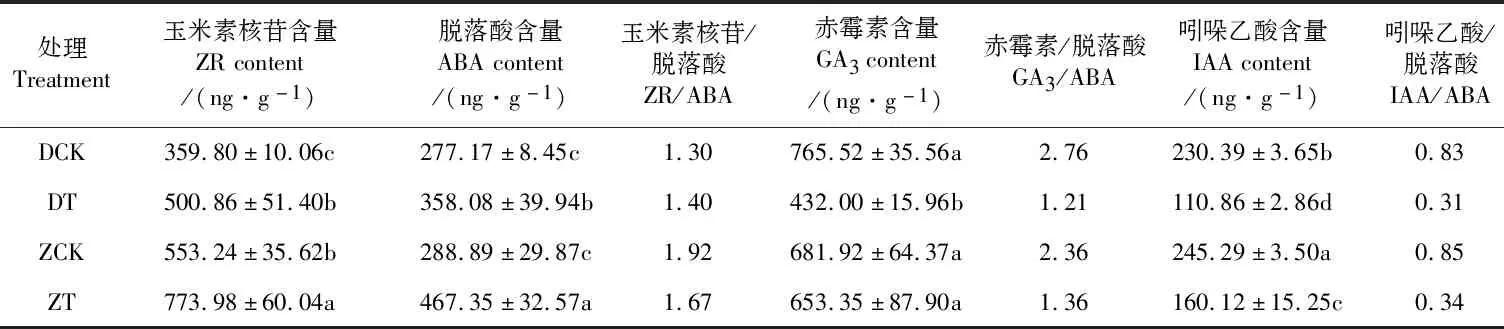
表5 干旱胁迫对‘冬枣’和‘赞皇大枣’叶片内源激素含量的影响Table 5 Effect of drought stress on endogenous hormone contentin in leaf of ‘Dongzao’ and ‘Zanhuangdazao’
3 讨 论
3.1 枣树生长与干旱胁迫
干旱胁迫时,植物的株高、茎粗和生物量等生长指标可以直接反映其生长状况。有研究表明[16-17],随着干旱胁迫程度的加重和时间的延长,叶绿素总量、叶绿素a、叶绿素b含量均呈下降趋势;冯宝春等[9]研究表明‘蒙山脆枣’和‘沾化冬枣’在受到干旱胁迫时其叶片叶绿素含量下降,本研究也得出相似结果,这可能是叶绿体的结构受到破坏,叶绿素合成与降解的动态平衡被打破所致。干旱胁迫后,‘冬枣’的叶绿素a、叶绿素b含量和叶绿素总量降幅均大于‘赞皇大枣’,说明‘赞皇大枣’维持叶绿素稳定的能力高于‘冬枣’。干旱胁迫下,植物细胞膨压降低,引起植株生长速度下降,主要表现有株高下降、茎粗下降、叶片面积减小、叶片发黄甚至掉落[3,18],从而导致植株生物量积累大幅度下降。本研究中,干旱胁迫均减少了两个品种的新梢叶片数,减小了枣吊和叶片长度,这与吴永宏[19]在刨花楠幼苗中的研究结果相类似,而胁迫21 d后两品种的新梢长度、粗度、节间数、枣吊个数等存在不一致结果,可能与两个品种抗旱性有差异,且根和树干中前期储存的非结构性碳水化合物与移栽后生长前期的新梢生长有关。
3.2 枣树光合特性与干旱胁迫
植物叶片的光合参数是监测干旱胁迫程度的敏感指标,可用于判断植物生长状况及其抗逆性[20]。干旱胁迫下,植物会通过减小气孔的开放程度或关闭气孔来维持自身的水分平衡,表现为Pn和Tr的下降,植物生长也会受到抑制[21-22]。冯宝春等[9]研究表明‘蒙山脆枣’和‘沾化冬枣’在受到干旱胁迫时,其Gs、Tr、Pn均下降;马军勇等[23]研究表明降低灌水下限导致‘灰枣’的Pn、Tr和Gs降低;本研究表明干旱胁迫显著降低了‘赞皇大枣’和‘冬枣’的Pn、Gs和Tr,这可能是因为枣树受到干旱胁迫时,通过降低Gs来减少水分散失,使得Tr也随之下降,Gs的降低还会导致Pn的降低,且‘赞皇大枣’叶片的Pn、Gs和Tr降幅均小于‘冬枣’,说明‘赞皇大枣’的抗旱性高于‘冬枣’。干旱胁迫降低了‘冬枣’Pn、Ci、Gs、Tr,而‘赞皇大枣’Ci并没有降低,推测可知干旱影响‘冬枣’Pn主要受气孔因素的影响,而干旱对‘赞皇大枣’Pn的影响主要受非气孔因素的影响。干旱胁迫下,植物吸收的光能往往多于自身所能利用的光能,导致激发能过剩,造成光抑制,加重植物的受害程度。本研究中,胁迫显著增高了两个品种的F0,显著降低了两个枣树品种的Fm、Fv/Fm、ΦPSⅡ,这与张栋[24]在苹果中的研究结论相一致;植物叶片Fm和Fv/Fm的降低表明其受到了光抑制[24],Fv/Fm值通常在0.75~0.85之间。本研究发现,胁迫后两个品种的Fm和Fv/Fm均显著下降,且‘赞皇大枣’叶片的Fm和Fv/Fm降幅均小于‘冬枣’,推测‘冬枣’的PSⅡ反应中心受到损伤较大,降低了其原初光反应效率[25]。胁迫显著增高了两个品种的qN,说明枣树为避免过量光能所造成的伤害,通过增加qN以热传递的形式耗散过剩光能。
3.3 枣树渗透调节物质与干旱胁迫
当植物受到干旱胁迫时,细胞电导率增加,其相对电导率越大,表明质膜受损的程度越大[26]。本研究中,干旱处理下‘赞皇大枣’的相对电导率显著低于‘冬枣’,表明‘冬枣’的质膜受损程度更大。MDA可在一定程度上反映植物膜系统的损伤程度[9,27],MDA的增幅越大表明其机体脂质过氧化的程度越大,细胞结构被破坏的程度越大。本研究表明,干旱胁迫后‘赞皇大枣’的MDA增幅小于‘冬枣’,说明‘冬枣’的细胞结构损伤程度更大。在逆境条件下,植物可以通过积累Pro、可溶性糖和蛋白等渗透调节物质来实现自我保护[9,28]。干旱胁迫下玉米Pro和可溶性糖含量增加[29],与本研究结果相似。本研究中,干旱胁迫显著增高了‘赞皇大枣’的可溶性蛋白含量,但显著降低了‘冬枣’的可溶性蛋白含量,其原因可能与两种枣树对干旱胁迫的耐受力差异有关,尚需进一步研究。供试两种枣树可溶性蛋白含量的变化幅度均小于Pro和可溶性糖的变化幅度,因此枣树可能首先依赖渗透调节来抵御干旱胁迫。
3.4 枣树抗氧化酶活性与干旱胁迫
植物叶片通过SOD、POD、CAT、GST、APX等酶协同清除过量的活性氧,减轻过氧化对细胞的损伤,保护质膜系统[30]。本研究表明,胁迫显著增加了两个枣树品种的SOD、CAT、GST活性,这与熊仕发等[31]在白栎幼苗中的研究结论相一致。干旱胁迫显著增高了‘赞皇大枣’的POD活性,却显著降低了‘冬枣’的POD活性;与此同时,‘赞皇大枣’的SOD活性增幅大于‘冬枣’。这些可能是‘赞皇大枣’更抗旱的原因,通过较高的抗氧化酶活性更有效地清除活性氧,抑制膜脂过氧化。
3.5 枣树内源激素与干旱胁迫
植物在逆境下可通过调节体内激素水平和不同激素间的比例来调控自身生长发育[30]。本研究中,胁迫后两个枣树品种的ZR含量显著升高,IAA含量显著降低,‘冬枣’的GA3含量显著降低,这与王得运等[32]的研究结论相似。ABA是植物体内的一种抗胁迫激素,参与传递逆境信号,诱导植物产生一系列抗逆反应[33],如ABA通过调控气孔运动或有关抗旱基因的表达来提高植物的抗旱性。有研究证实干旱胁迫可导致ABA快速积累[34],本研究同样表明干旱胁迫显著升高了两个枣树品种的ABA含量,且干旱胁迫后‘赞皇大枣’的ABA含量增幅大于‘冬枣’。胁迫后两个枣树叶片的IAA/ABA、GA3/ABA均大幅度下降,且‘赞皇大枣’的降幅大于‘冬枣’,说明干旱胁迫下‘赞皇大枣’对干旱的响应能力更强。
3.6 ‘赞皇大枣’和‘冬枣’的品种特性及抗旱性比较
笔者在甘肃沿黄灌区开展枣树引种试验时发现:在甘肃沿黄灌区栽植密度为1.5 m×3.5 m的枣园中,7 a生的‘赞皇大枣’单株鲜果产量为8 340 g,而‘冬枣’为1 720 g;‘赞皇大枣’在甘肃沿黄灌区生长表现状况佳且产量高,而‘冬枣’生长表现状况一般且产量低,推测可能与两个品种的抗旱性差异有关。‘赞皇大枣’原产于河北省赞皇县的太行山区,‘冬枣’原产于渤海湾地区。‘赞皇大枣’树姿半开张,干性中强,枝条较稀且粗壮,针刺发达;‘冬枣’树姿较开张,干性较强,枝条细而密,针刺退化。‘赞皇大枣’的叶片厚而宽大,‘冬枣’的叶片中等大。‘赞皇大枣’花朵大,坐果率高,为晚熟的兼用品种;‘冬枣’的花朵小,幼龄枝结实能力较差,为极晚熟的鲜食品种。‘赞皇大枣’果实较大,核内无种仁;‘冬枣’果实较小,种仁较饱满。‘赞皇大枣’适应性较强,耐瘠耐旱,产量较高,坐果稳定,适宜北方日照充足、夏季气候温热的地区发展;‘冬枣’虽然果实品质极佳、抗病,但抗旱性较差,幼树抗寒性也较差,适宜年均温11℃以上的有灌溉条件或雨量充沛的地区种植[35]。本研究中,干旱胁迫后,‘冬枣’的叶片长度、叶绿素a、叶绿素b含量、叶绿素总量、净光合速率、光化学量子效率和IAA的降幅大于‘赞皇大枣’,‘冬枣’的相对电导率的增幅大于‘赞皇大枣’,‘冬枣’的Pro、SOD活性、ABA的增幅小于‘赞皇大枣’,以上指标的变化差异体现出‘赞皇大枣’具有更强的抗旱性。
4 结 论
干旱胁迫主要抑制了两个枣树品种的新梢叶片数、叶片长度和枣吊长度;干旱胁迫下‘赞皇大枣’的新梢上叶片个数为‘冬枣’的5.48倍。干旱胁迫后‘赞皇大枣’的叶片叶绿素总含量下降了18.94%,而‘冬枣’下降了29.32%;与‘冬枣’相比,‘赞皇大枣’具有更高的光合和蒸腾速率,干旱胁迫后‘赞皇大枣’的ΦPSⅡ和qP分别提高97.69%和77.25%,qN降低18.29%;干旱胁迫后‘冬枣’的相对电导率较‘赞皇大枣’显著提高16.01%,Pro和可溶性蛋白含量显著降低35.49%和35.98%;干旱胁迫后‘赞皇大枣’比‘冬枣’的SOD和POD活性分别提高25.77%和76.82%。综上,与干旱敏感的‘冬枣’相比,高抗旱枣树品种‘赞皇大枣’的叶片在抗衰老和脱落、维持细胞膜稳定和渗透平衡、清除自由基、提高PSII反应中心的电子传递效率等方面所具有的代谢优势,是其抗旱高产的主要生理机制。

