基于电子顺磁共振波谱法的土壤环境持久性自由基的检测方法研究①
蒋 倩,唐昊冶,刘 云,陆国兴,倪 俊,涂勇辉,范巧君,龚 华,马作豪
基于电子顺磁共振波谱法的土壤环境持久性自由基的检测方法研究①
蒋 倩,唐昊冶,刘 云,陆国兴,倪 俊,涂勇辉,范巧君,龚 华,马作豪
(中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008)
本研究以不同类型土壤为研究对象,分别对电子顺磁/自旋共振波谱仪(EPR/ESR,X-波段连续波)的中心磁场、微波功率、调制幅度等主要测试参数进行调试与优选,确立EPR测定土壤环境持久性自由基(EPFRs)的仪器参数优选方法及参考值。结果表明,根据样品实测频率(约9.82 GHz)与EPFRs的因子可设置谱仪中心磁场约3 502 G。微波功率可采用微波功率饱和曲线法、微波衰减相邻6 dB信号比较法优选,两法各有优缺点,建议结合选用。若与27 dB相比,微波衰减设置为≤15 dB,低场峰(=2.003 0 ~ 2.003 5)有由于功率饱和而引起其自旋浓度被不同程度抑制的趋势,并且27 dB左右(25 ~ 30 dB)被认为是该峰的较优微波衰减值。然而,高场峰(=2.000 4)对其响应存在差异,高衰减值为较佳。此外,调制幅度应小于峰-峰宽(3.28 G),若兼顾研究较窄峰(约 1 G),1 G较为适宜。本EPR谱仪测试参数优选方法可确保因子的准确度、EPR图谱的分辨率与超精细分裂等信息的可靠性,为土壤与环境固态样品EPFRs的测定提供科学依据,促进该项技术的应用与发展。
电子顺磁共振;电子自旋共振;波谱法;环境持久性自由基;土壤
环境持久性自由基(environmental persistent free radicals,EPFRs)是分子结构极为稳定、半衰期较长的新型环境污染物,可以稳定存在数分钟至几十天左右[1]。研究表明,EPFRs广泛存在于天然有机质和土壤沉积物等环境介质中[2–6]。其中,土壤沉积物中EPFRs主要源于工业热处理过程与人类的活动,比如煤炭与秸秆的燃烧,以及汽车尾气的释放等[7]。近年来,研究人员对土壤EPFRs形成与有机质、金属离子及污染物的相互作用进行了大量的研究并取得进展。比如土壤有机质中的腐殖酸和金属离子等能够与土壤中的含氯农药等有机污染物作用产生多酚类自由基[8],并且在土壤腐殖质和类腐殖质中也发现半醌类自由基的存在[9]。土壤EPFRs形成来源于有机质、土壤无机矿物质或者金属离子等与有机污染物相互作用,并且有机污染物与黏土矿物的结合对EPFRs 形成和稳定起着重要作用[10]。目前,也有土壤EPFRs浓度与Fe3+、Cu2+等金属离子含量呈正相关关系的报道[11]。但Aeschbacher等[3]则提出了土壤有机质能够作为电子导体,使有机污染物在不与金属离子接触的条件下发生电子转移,也可产生EPFRs。这些研究结果表明,EPFRs是有机污染物环境归趋的重要组成部分,且与土壤无机矿物及过渡金属位点的结合会提高其稳定性和持久性,使其有条件进行长距离、不同环境介质的迁移与转化,可能增大了潜在的环境风险[12–13]。另一方面,EPFRs也正在被研究者应用在污染物降解的研究中,其可以激发双氧水和过硫酸盐产生羟基和硫酸根等自由基,这些活性组分可用于降解有机污染物[14–16]。可见,如果将具有高活性、高反应性的EPFRs 影响有机和无机污染物转化这一特性应用到土壤与环境催化领域,将对解决目前国内外一些环境污染问题具有重要的意义。
国内外研究中,EPFRs的主要检测方法是电子顺磁共振波谱法/自旋共振(electron paramagnetic/spin resonance,简称EPR/ESR)波谱法[1]。基本原理是未配对电子在磁场中吸收频率v的电磁辐射,若吸收能量与能级间间距∆E相匹配,则会发生塞曼跃迁与顺磁共振现象。该方法可直接检测样品中自由基,是一种可原位、无损和直接跟踪含有未配对电子的技术方法,具有检测速度较快、无干扰,且对后续分析测试项目无影响等优点[17]。其不足之处是对样品管与制备均有相应的要求,比如石英材质样品管介电损耗更低、更利于微波场分布而被选用;样品管形状大小受限于样品的性质,如固体粉末需选用直径3 ~ 4 mm的圆柱形管;瞬态自由基通常需现场即时捕获等[18]。EPR图谱信息中,因子反映未成对电子的自旋角动量与轨道角动量之间的耦合,是表征自由基的重要参数[19]。对EPFRs 的因子进行解析可获知其类型信息,若因子为2.002 8,则表明EPFRs以碳为中心,如芳烃类自由基[4,6,20];若因子为2.003 0 ~ 2.004 0,则表明EPFRs以碳氧为中心或是碳中心与氧中心的混合物[13,21–22];若因子值大于2.004 0,则EPFRs是以氧原子为中心,如半醌自由基[23]。可见,因子信息有助于解析信号的来源和磁性粒子的性质,进而获悉土壤的污染来源及类型[24]。同时,该法也可对图谱峰进行自旋浓度的定量分析。目前,电子顺磁共振波谱法已广泛应用于土壤、生物质炭等介质中EPFRs的检测[25–27]。然而,关于顺磁共振波谱仪测定EPFRs适宜参数的研究报道较少,这不仅会影响自由基定性定量的可靠性,也会在一定程度上制约该技术的应用。本研究以不同类型土壤EPFRs为研究对象,对EPR谱仪的主要测试参数进行逐一调试与优选,旨在建立准确的谱仪参数优选方法,促进该技术在土壤与环境固态样品EPFRs测试中的应用与发展。
1 实验部分
1.1 仪器
电子天平(ML503T,梅特勒,瑞士);电子顺磁共振波谱仪(X波段连续波,E-500 9.5/12,布鲁克,德国)。
1.2 试剂
为了确保电子顺磁共振波谱法测试数据的准确性和可靠性,定期采用相应的标准试剂,遵照检定规程以及仪器商提供的使用指南对EPR谱仪进行检定与校准[28–30]。以下试剂均由布鲁克公司提供。
锰标,Mn2+为六重峰,第三峰(=2.032 7±0.000 2)与第四峰(=1.980 3±0.000 2)的间隔为9.076 mT。六重分裂的间隔从低场到高场稍有增加,线宽也如此[18],校准磁场等。
弱酶 (weak pitch,WP),=2.002 8±0.000 2,检验仪器噪声水平等。
强酶 (strong pitch,SP),=2.002 8±0.000 2,校准仪器定量等。
BDPA苯自由基络合物(bis diphenyl allyI- benzene complex),=2.002 54±0.000 32,校准仪器调制幅度、相位、数据质量控制等。
丙氨酸片(alanine),其电子自旋数的参考值为1.43×1017,数据质量控制。
1.3 样品
本研究选用土壤样品S1 ~ S8涉及沉积物、棕壤、潮壤、水稻土等多种土壤类型,并且有机质(OM)、过渡金属含量差异较大(表1),更多理化指标参见标准物质证书。其中,S1 ~ S6为购自河北廊坊地球物理地球化学勘查研究所土壤标准样品。S7、S8分别取自河南封丘、江苏常熟的土壤样品,土样经风干,剔除植物残体、植物须根与石块等侵入体后,用玛瑙研钵研磨,按照土壤研磨四分法,分别过2 mm (10目)、0.25 mm(60目)、0.149 mm(100目)孔径尼龙筛,待用[30]。

表1 土壤样品基本性质
注:有机质 (OM) 及S7和S8样品的相关数据均是本文测定值,其余数据源自标准物质证书。
2 结果与讨论
2.1 样品高度与质量的选择
称取土壤样品的质量由其强度决定,样品高度应小于谐振腔的灵敏上限值。本研究使用谱仪谐振腔型号为ER4122SHQE-W1,样品高度最佳灵敏上限值为20 mm。EPFRs检测中,应视样品的信号响应强度与谱仪的调谐难易程度等情况来选择适宜的样品质量。据图1,样品S1 ~ S6分别置于内径为4 mm石英管中,其高度分别从10 mm增至15 mm、20 mm,谱仪的值会逐渐降低,其下降范围为6 000 ~ 2 400,意味着仪器灵敏度随着样品高度的增加而下降,这是由于土壤样品内金属对微波的介电损耗造成的。本文为了保持谱仪的较高灵敏度与所有研究样品具有较高信号强度(图1),选用样品高度中间值15 mm。

图1 不同高度样品的响应
此外,本文对具有相同样品高度且目数不同的土壤S7、S8中EPFRs进行了研究。从图2可知,10目、60目、100目土样的峰强无明显差异。在检测过程中,观察到谱仪谐振腔品质因子值存在较小波动(范围分别为2 800 ~ 2 600、2 000 ~ 1 900),这种现象可能是同高度且不同孔径的样品间存在质量差异而引起的。为了尽量确保仪器条件一致,实际样品应尽量与标样目数保持一致或相近,即优先选择100目。
在保持样品约15 mm的相同高度情况下,土壤S1 ~ S8的质量约在0.162 9 ~ 0.267 8 g(表2)。为了控制自旋浓度的定量偏差,应准确称量样品质量至0.000 1 g。当然,也可在仪器灵敏上限的样品高度前提下,选择某一相同样品质量。

表2 电子顺磁共振波谱法测定土壤EPFRs
注:Wpp为谱峰宽;Δpp为峰–峰宽;为品质因子。
2.2 中心磁场、扫描宽度的选择
据0、、因子的计算关系[17],可计算出中心磁场0:

式中:0,磁场强度,单位为高斯(G);,测试时实际频率,单位为吉赫兹(GHz)。对于样品S1 ~ S6中低场峰,实际频率约为9.82 GHz,则可计算出中心磁场约为3 502 G。
图谱扫描宽度一般设置为检测峰宽的2 倍~ 3倍,即整峰宽占整张EPR图谱的1/2 ~ 1/3较为适宜,也可根据自己的实际需求进行调整。据表2,本研究样品峰宽在14.8 ~ 45.1 G范围,可设置扫描宽度为100 G。面对未知样品EPR图谱的中心磁场或因子的情况,可先以谱仪默认中心磁场为中心,设置较大扫宽进行扫描,初步确定峰信号后,再锁定小范围进行优选扫描。
2.3 微波功率的选择
由于化学结构的差异,各物质具有自身特征饱和功率,甚至在温度等测试条件变化时其值也会有所不同。只有谱仪微波功率设置未饱和值时,EPR信号强度才正比于微波功率的平方根。并且,最佳功率应设为略低于饱和功率[19]。可见,获取并掌握微波功率的饱和值尤为重要,常用方法有:微波功率饱和曲线法、相邻微波衰减6 dB信号比较法等[30]。
2.3.1 微波功率饱和曲线法 根据仪器使用指南[30],在确立峰中心磁场与扫描宽度的条件下,设置微波衰减为0 ~ 60 dB,步长为1 dB,可获得一组61张磁场-功率二维EPR图谱。对这组图谱进行基线校准、洛伦兹偏差线型拟合、线型与微波功率的函数创建,从0 mW起画一条直线与曲线的相切值,再开平方即为饱和功率。
参照上述步骤,可获得样品S1 ~ S8峰(=2.003 3)的微波功率饱和曲线图(图3)。从图中可读出直线与该曲线相切点约为0.473 ~ 1.939 mW,对应的微波衰减值约21 ~ 26 dB,趋向集中在23 ~ 24 dB范围内(表3)。显然,该方法可准确地实现微波功率的优选,但由于耗费仪器机时较长(不少于40 min),其广泛使用受到了限制。
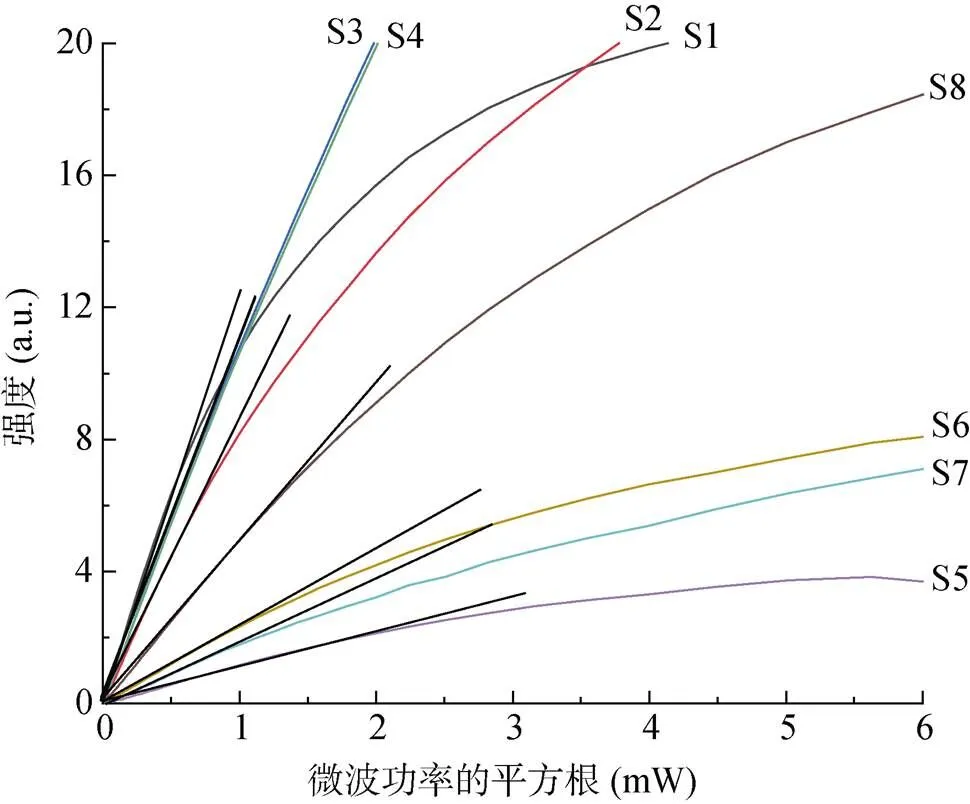
图3 土壤S1 ~ S8微波功率饱和曲线图

表3 两种方法对多类土壤EPFRs的微波功率优选结果对比
注:①微波功率饱和曲线法;②相邻微波衰减6 dB信号比较法。
2.3.2 相邻微波衰减6 dB信号比较法 以6 dB为步长,相邻两个未达饱和微波功率条件下EPFRs信号强度间存在2倍或1/2的关系。通过直接比较这两个相邻信号强度的大小可判断饱和范围值。不同微波功率下,S1 ~ S8中EPFRs低场峰实测信号与微波衰减的关系见图4。以S1为例,判定步骤:①从9 dB到27 dB,2倍较大微波衰减信号(如27 dB)均小于相邻较小者(21 dB),则其较小微波功率被判定为处于饱和状态;②2倍微波衰减33 dB信号约等于27 dB,可判断微波衰减的最佳选择在27 ~ 39 dB范围。据图2可知,土壤样品S2 ~ S8的响应结果尽管存在细微差异,但微波衰减值仍趋同于21 ~ 33 dB范围内。文献报道[2,4,26,31]中,微波衰减20、23、25、30 dB均有被采用,本文研究结论基本一致。在选用时,应基于实际样品峰强弱进行选择,较弱峰可选较高功率,即较低微波衰减值。值得注意的是,需定量的样品应谨慎选择高功率参数,比如,在20 dB时S1 ~ S8(除S2外)EPFRs其自旋浓度的值会受到不同程度的抑制已被证实(图4)。并且,由图4可知,与27 dB相比(除S2与21 dB比),在微波衰减≤15 dB时,所有样品由于微波功率饱和而被不同程度地抑制(3.5% ~ 98.3%),在微波衰减≥45 dB时,所有样品的减少可能是因电子未被低功率完全激发而引起的(24.0% ~ 58.1%)。参照略高于饱和曲线法微波衰减值,并且兼顾各类型土壤,本研究确立27 dB左右(25 ~ 30 dB)为较适宜值。
与微波功率曲线法相比,相邻微波衰减6 dB信号比较法耗时较少(2 ~ 5 min),操作步骤更容易。但是,由于该方法需要6 dB的步长,导致其判定结果范围跨度较大。实际测试过程中,建议以饱和功率曲线法为主,以相邻微波衰减6 dB信号比较法为补充,两者相结合的方式选用。
2.3.3 微波功率的影响 有研究表明,土壤中有机质、过渡金属与有机污染物可发生相互作用,并通过电子的传递与转移生成稳定的EPFRs[6,21,32]。本研究结果显示,土壤样品S5中Fe2O3、Cu、Zn等含量都较高,其谱仪的饱和曲线法与微波衰减法均对应了最小饱和衰减值,意味着检测中最易功率饱和。而其他土壤样品中某一个项目含量高并不会显著影响EPFRs微波衰减的优选值(表3),这一现象将在以后更多的样品检测中进行进一步验证。
由于不同未配对电子基团对微波功率的响应存在不同,调节微波功率常被作为区分自由基的有效方法之一。从图5可知,样品S1中除存在2.003 3峰外,高场还有另一EPFRs(=2.000 4)信号,并且两者对微波功率的响应完全不同。S2 ~ S8样品也存在相似的情况,当微波衰减至大于约16 dB时,这一峰才会被检测到,继续增大衰减,直至33 dB,高、低场两个因子的自由基可较明显同时出峰,并且当微波衰减≥45 dB时,高场自由基信号强度增加幅度明显强于低场信号。研究报道中,根据因子可判断低场峰来源于碳中心与含氧基团自由基或碳氧混合中心自由基[6,22],高场峰却为另一顺磁信号。可见,适宜的微波功率是确保样品自由基类型判定的可靠定性与自旋浓度定量的准确性的关键前提。

(S1 ~ S8图中,柱上方百分数为理论计算自旋浓度是实测值的相对标准偏差;0% 表示以此微波条件实际测定值为基准计算其他微波设置参数的理论值;百分数值前符号“+”“–”分别表示实测值较理论值的高与低)

图5 土壤S1中 EPFRs在不同微波衰减下EPR图谱
2.4 调制幅度与频率的选择
2.4.1 调制幅度 随着调制幅度从1 G增加至9 G,EPR图谱的信号强度也会相同倍数地增大。当调制幅度等于线宽时,记录信号最大,如果其值继续增大,EPR信号高度就开始下降,而且线宽被增宽,波谱图出现畸变[19](图6)。本研究样品S1 ~ S8的EPFRs信号中,较大(2.003 0 ~ 2.003 5)峰的线宽为3.28 ~ 6.91 G,另一高场峰(=2.000 4)为0.90 ~ 1.45 G,应视研究需求而选择合适的调制幅度。若只关注前一峰,则应选择小于3.28 G即可,若需兼顾较窄峰,则可选择1 G (表2)。文献报道[2,4,26,32],调制幅度1、2、4、5 G均有被采用,为了增强信号较弱实际样品的强度,可适当调高调制幅度,为了兼顾灵敏度与分辨率,调制幅度的设置值应小于或等于峰–峰线宽[18]。
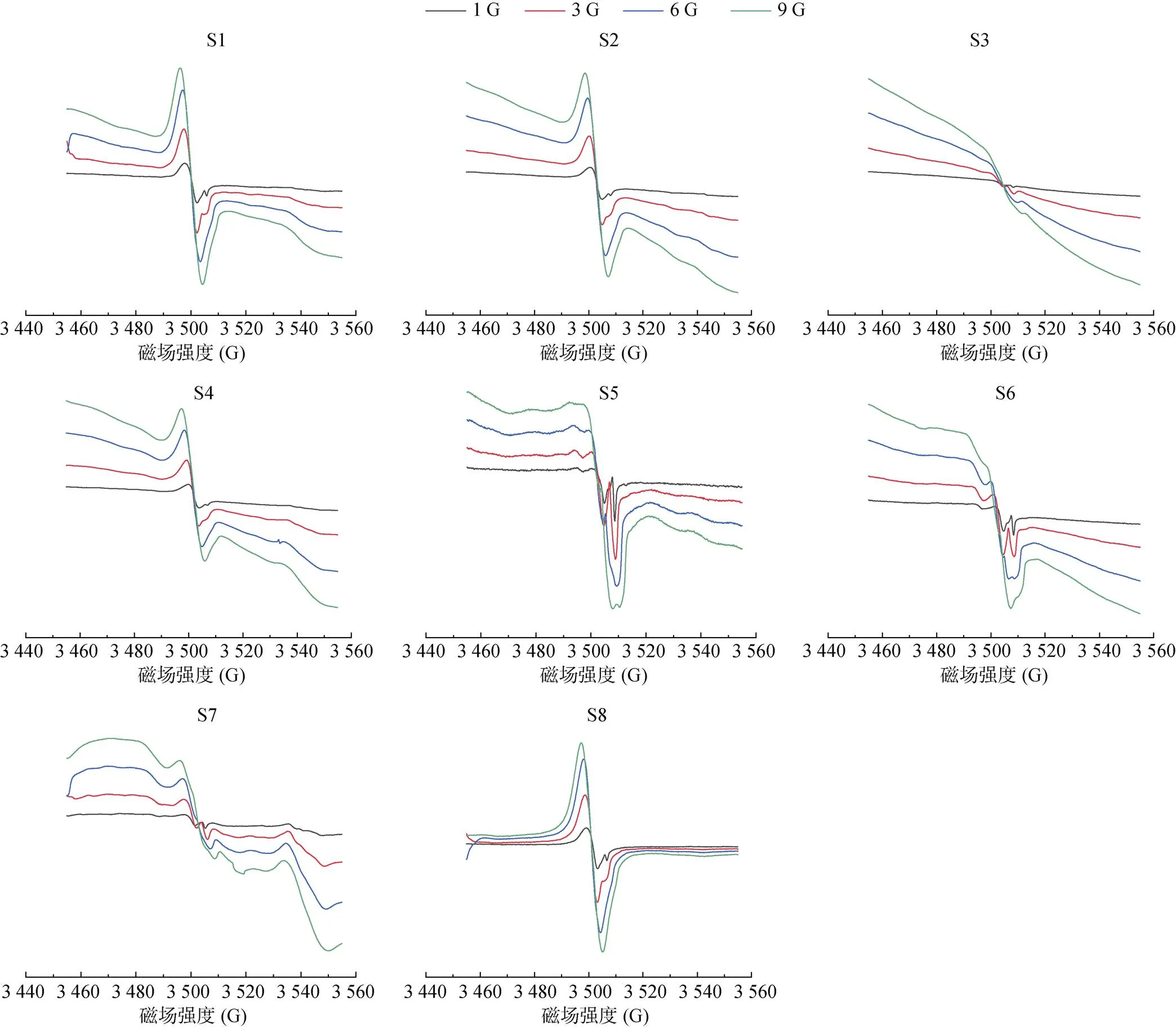
图6 不同调制幅度的响应
2.4.2 调制频率 由图7显示,分别设置10、20、50、100 kHz检测样品S1 ~ S8中EPFRs,其响应并无明显差异,建议选用X波段仪器默认调制频率值100 kHz即可。但是对于特别细的EPR信号,调制频率应调小,才能将所有的图谱峰都分辨出来。
2.5 扫描时间、次数的选择
EPR图谱扫描速度应尽量设置在1 ~ 2 G/s范围内,即在扩大扫描宽度时,应相应地增加扫描时间,这样才能控制因子在误差允许范围内。本文中扫描宽度设置为100 G,结合实际峰与测试效率,扫描时间可略调整至40 s左右。


图7 不同调制频率的响应

图8 不同扫描次数的响应
2.6 增益值的选择
增益值(receive gain)是信号接收端对信号的放大系数,单位dB,实质为放大倍数,其值越大谱线信号与噪声强度均被放大,过大会出现谱峰被切削的情况,应适当调低此值。对S1 ~ S8土壤样品EPFRs对不同增益值的响应进行测试,结果见图9。从图中可知,3、15、45、60 dB对其峰的响应并没有明显差异。但是,为了兼顾样品信号强度与峰型,一般不选用谱仪可设置的最大值60 dB,而选用稍低值,本研究中选用42 dB。
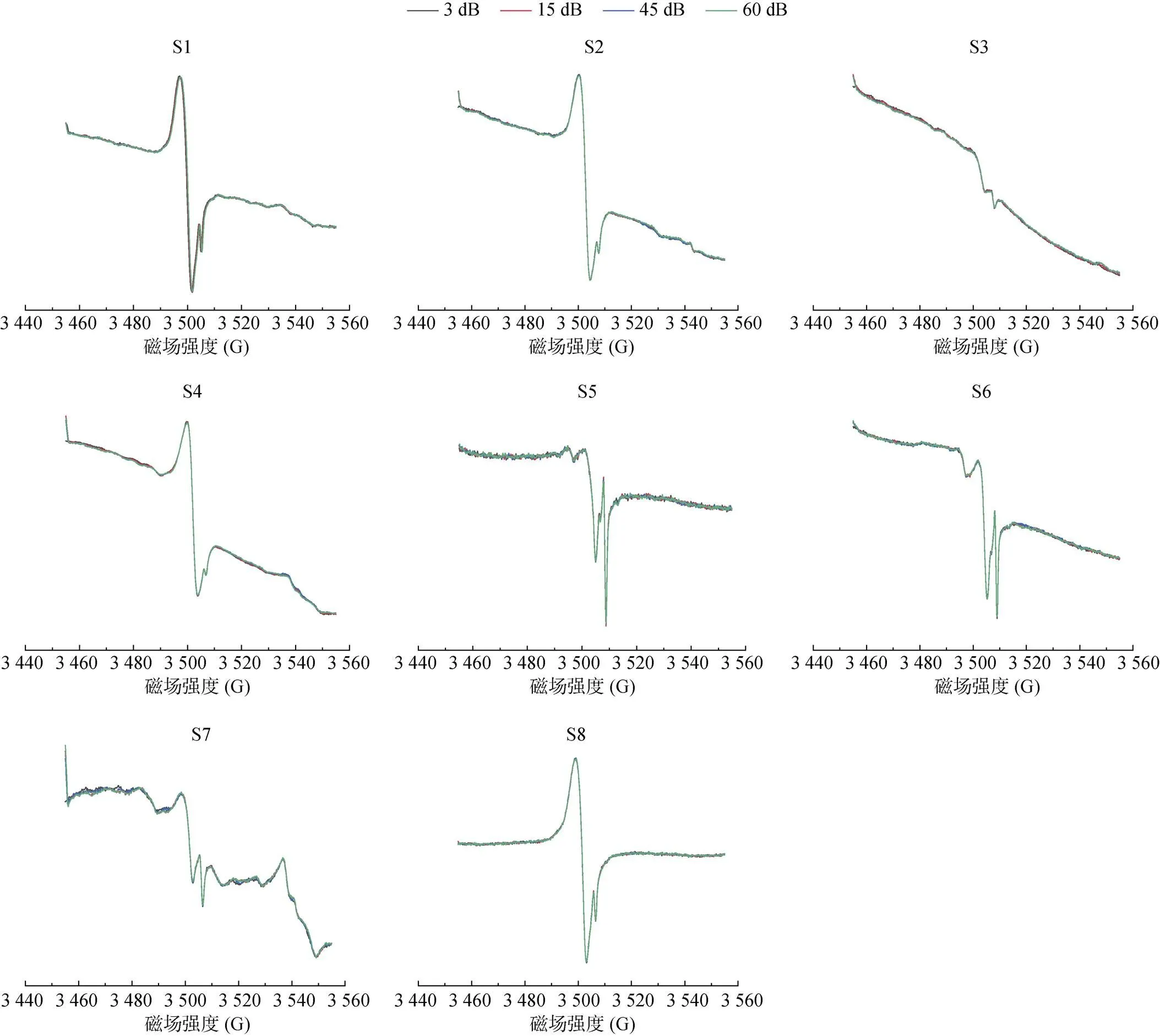
图9 不同增益值的响应
2.7 测试温度的选择
低温条件下谱仪的灵敏度会变高,从而获得更强的信号强度,但为了节约资源与成本,本研究样品中EPFRs在常温条件下进行测试。在具备条件时,可在低温条件下测试,应注意其频率与中心磁场的变化。随着温度降至100 K,微波频率下降至约为9.4 GHz,相对应中心磁场在3 350 G左右。
2.8 自旋浓度定量参数的选择
按照仪器操作步骤[29],本文采用谱仪可对已读取微波衰减至33 dB时谐振腔的品质因子Q时EPFRs峰进行定量。在仪器安装的软件xepr中点击定量EPR,选中峰的起止范围并进行二次积分,对应填入样品管内径4 mm、谐振腔的中心距离62.5 mm、样品高度15 mm、电子自旋数1/2,即可自动计算并显示EPFRs的电子自旋数,再与质量之比即为自旋质量浓度。本研究中仪器采用绝对定量法,其他设备可能会需选用比较法,具体方法可参见文献[28]。
3 数据质量控制与检出限
土壤EPFRs检测过程中,监测标准样品BDPA的值可对自由基的定性进行质量控制。参照仪器操作手册[29]设置检测参数,BDPA的值分别为2.002 61、2.002 60、2.002 54,均在标准物质范围2.002 22 ~ 2.002 87内,其图谱见图10。由此可判定仪器检测样品中自由基的因子准确、可靠。

图10 BDPA 标准样品图谱

图11 丙氨酸片标准样品图谱
当需对土壤EPFRs进行定量检测时,丙氨酸片可作为自由基电子自旋数数据质量的评估。在测试过程中,参照厂商证书参数检测丙氨酸片标样,结果见图11。3次电子自旋数定量值分别为1.43×1017、1.39×1017、1.40×1017,与证书标准参考值(1.43×1017)比,其定量结果在允许波动范围±10% 内。可见,谱仪检测样品中自由基自旋浓度准确、可靠。
据谱仪厂商提供,仪器最小检出绝对自旋数为1×109spins/G。实际样品的检出限应对应样品响应信号为基线信号的3倍(/=3)时的浓度值。
4 结论
土壤中EPFRs的EPR谱仪测试参数可设置为:中心磁场约3 502 G、微波频率9.82 GHz、调制幅度1 G、扫描宽度100 G、扫描时间40 s等。微波功率饱和曲线法确立微波功率的参考范围更窄,微波衰减相邻6 dB信号比较法耗时少,建议以前者为主,后者为补充,根据实际情况两者结合选用。本研究的土壤EPFRs低场峰(=2.003 0 ~ 2.003 5)较优的微波衰减值为27 dB左右(25 ~ 30 dB),实验中应根据实际样品信号强弱来决定选择较大或较小值。然而,另一高场峰(=2.000 4)在高微波衰减值信号更佳。本文优选方法及适宜值可为土壤与环境固态样品EPFRs的准确测定提供重要参考。
[1] Dellinger B, Lomnicki S, Khachatryan L, et al. Formation and stabilization of persistent free radicals[J]. Proceedings of the Combustion Institute, 2007, 31(1): 521–528.
[2] Saab S C, Martin-Neto L. Studies of semiquinone free radicals by ESR in the whole soil, HA, FA and humin substances[J]. Journal of the Brazilian Chemical Society, 2004, 15(1): 34–37.
[3] Aeschbacher M, Sander M, Schwarzenbach R P. Novel electrochemical approach to assess the redox properties of humic substances[J]. Environmental Science & Technology, 2010, 44(1): 87–93.
[4] dela Cruz A L N, Cook R L, Dellinger B, et al. Assessment of environmentally persistent free radicals in soils and sediments from three Superfund sites[J]. Environmental Science Processes & Impacts, 2014, 16(1): 44–52.
[5] dela Cruz A L N, Cook R L, Lomnicki S M, et al. Effect of low temperature thermal treatment on soils contaminated with pentachlorophenol and environmentally persistent free radicals[J]. Environmental Science & Technology, 2012, 46(11): 5971–5978.
[6] dela Cruz A L N, Gehling W, Lomnicki S, et al. Detection of environmentally persistent free radicals at a superfund wood treating site[J]. Environmental Science & Technology, 2011, 45(15): 6356–6365.
[7] Wang P, Pan B, Li H, et al. The overlooked occurrence of environmentally persistent free radicals in an area with low-rank coal burning, Xuanwei, China[J]. Environmental Science & Technology, 2018, 52(3): 1054–1061.
[8] Boyd S A, Mortland M M. Radical formation and polymerization of chlorophenols and chloroanisole on copper(II)-smectite[J]. Environmental Science & Technology, 1986, 20(10): 1056–1058.
[9] Jezierski A, Drozd J, Jerzykiewicz M, et al. EPR in the environmental control: Copper complexes and free radicals in soil and municipal solid waste compost[J]. Applied Magnetic Resonance, 1998, 14(2): 275–282.
[10] Jia H Z, Li L, Chen H X, et al. Exchangeable cations-mediated photodegradation of polycyclic aromatic hydrocarbons (PAHs) on smectite surface under visible light[J]. Journal of Hazardous Materials, 2015, 287: 16–23.
[11] Jia H Z, Zhao J C, Li L, et al. Transformation of polycyclic aromatic hydrocarbons (PAHs) on Fe(III)-modified clay minerals: Role of molecular chemistry and clay surface properties[J]. Applied Catalysis B: Environmental, 2014, 154/155: 238–245.
[12] Li H, Guo H Y, Pan B, et al. Catechol degradation on hematite/silica–gas interface as affected by gas composition and the formation of environmentally persistent free radicals[J]. Scientific Reports, 2016, 6(1): 1–9.
[13] Vejerano E P, Rao G Y, Khachatryan L, et al. Environmentally persistent free radicals: Insights on a new class of pollutants[J]. Environmental Science & Technology, 2018, 52(5): 2468–2481.
[14] Fang G D, Gao J, Liu C, et al. Key role of persistent free radicals in hydrogen peroxide activation by biochar: Implications to organic contaminant degradation[J]. Environmental Science & Technology, 2014, 48(3): 1902–1910.
[15] Fang G D, Liu C, Gao J, et al. New insights into the mechanism of the catalytic decomposition of hydrogen peroxide by activated carbon: Implications for degradation of diethyl phthalate[J]. Industrial & Engineering Chemistry Research, 2014, 53(51): 19925–19933.
[16] Fang G D, Zhu C Y, Dionysiou D D, et al. Mechanism of hydroxyl radical generation from biochar suspensions: Implications to diethyl phthalate degradation[J]. Bioresource Technology, 2015, 176: 210–217.
[17] 苏吉虎, 杜江峰. 电子顺磁共振波谱: 原理与应用[M]. 北京: 科学出版社, 2022.
[18] 卢景雰. 现代电子顺磁共振波谱学及其应用[M]. 北京: 北京大学医学出版社, 2012.
[19] 赵保路. 电子自旋共振技术在生物和医学中的应用[M]. 合肥: 中国科学技术大学出版社, 2009.
[20] Jia H Z, Zhao S, Shi Y F, et al. Transformation of polycyclic aromatic hydrocarbons and formation of environmentally persistent free radicals on modified montmorillonite: The role of surface metal ions and polycyclic aromatic hydrocarbon molecular properties[J]. Environmental Science & Technology, 2018, 52(10): 5725–5733.
[21] Jia H Z, Nulaji G, Gao H W, et al. Formation and stabilization of environmentally persistent free radicals induced by the interaction of anthracene with Fe(III)- modified clays[J]. Environmental Science & Technology, 2016, 50(12): 6310–6319.
[22] Fang G D, Liu C, Gao J, et al. Manipulation of persistent free radicals in biochar to activate persulfate for contaminant degradation[J]. Environmental Science & Technology, 2015, 49(9): 5645–5653.
[23] 卢超, 郑祥民, 周立旻, 等. 城市大气颗粒物表面半醌自由基的测定及特征分析[J]. 环境化学, 2013, 32(1): 1–6.
[24] Jia H Z, Zhao S, Shi Y F, et al. Formation of environmentally persistent free radicals during the transformation of anthracene in different soils: Roles of soil characteristics and ambient conditions[J]. Journal of Hazardous Materials, 2019, 362: 214–223.
[25] Vejerano E, Lomnicki S M, Dellinger B. Formation and stabilization of combustion-generated, environmentally persistent radicals on Ni(II)O supported on a silica surface[J]. Environmental Science & Technology, 2012, 46(17): 9406–9411.
[26] Yang L L, Liu G R, Zheng M H, et al. Pivotal roles of metal oxides in the formation of environmentally persistent free radicals[J]. Environmental Science & Technology, 2017, 51(21): 12329–12336.
[27] 鲁遥, 王朋, 尹梦楠, 等. 不同类型土壤胡敏酸提取物环境持久性自由基特征及影响因素[J]. 化工进展, 2021, 40(5): 2917–2927.
[28] 国家教育委员会. 电子顺磁共振谱方法通则: JY/T 0579-2020[S]. 北京: 科学技术文献出版社, 2020.
[29] Ralph T W. Elexsys II E 500 user’s guide[C]. MA USA: Bruker Bio Spin Corporation BILLERICA, 2013.
[30] 全国农业技术推广服务中心. 土壤分析技术规范[M]. 2版. 北京: 中国农业出版社, 2006.
[31] Vejerano E, Lomnicki S, Dellinger B. Formation and stabilization of combustion-generated environmentally persistent free radicals on an Fe(III)2O3/silica surface[J]. Environmental Science & Technology, 2011, 45(2): 589–594.
[32] Zhang Y, Guo X, Si X H, et al. Environmentally persistent free radical generation on contaminated soil and their potential biotoxicity to luminous bacteria[J]. Science of the Total Environment, 2019, 687: 348–354.
Study on Method of Environmental Persistent Free Radicals in Soils by Electron Paramagnetic Resonance Spectroscopy
JIANG Qian, TANG Haoye, LIU Yun, LU Guoxing, NI Jun, TU Yonghui, FAN Qiaojun, GONG Hua, MA Zuohao
(CASKey Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China)
A method for the determination of environmental persistent free radicals (EPFRs) in soil by electron paramagnetic/spin resonance spectroscopy (EPR/ESR) was established. In this paper, the central magnetic field, microwave power and modulation amplitude of the EPR spectrometer (x-band continuous wave) are tested and optimized. Based on the measured microwave frequency ν (9.82 GHz) and thefactor of the EPFRs, the central magnetic field of the spectrometer can be set to about 3 502 G. The microwave power saturation curve method and the microwave attenuation comparison method are used to optimize the microwave power. The two methods have their advantages and disadvantages, should be applied complementarily by both. Compared with 27 dB, microwave attenuation is set to ≤15 dB, and the peak (=2.003 0 ~ 2.003 5) is suppressed by more or less due to power saturation. Therefore, about 27 dB or 25-30 dB is considered to be the optimal microwave attenuation value of this peak. However, the response of the other peak of higher magnetic field (=2.000 4) is different, and the peak intensity is stronger at the higher attenuation value. In addition, the modulation amplitude should be smaller than the least peak-peak width (3.28 G), and 1 G is suitable if the narrower peak (1 G) is also studied. This method can be applied to the determination of EPFRs in soils and environmental solid samples, and it can ensure the accuracy offactor, the resolution and the reliability of superfine splitting of EPR spectra.
Electron paramagnetic resonance; Electron spin resonance; Spectroscopy; Environment persistent free radicals; Soils
O482.53;X53;S1
A
10.13758/j.cnki.tr.2023.02.019
蒋倩, 唐昊冶, 刘云, 等. 基于电子顺磁共振波谱法的土壤环境持久性自由基的检测方法研究. 土壤, 2023, 55(2): 379–389.
国家重点研发计划项目(2020YFC1807200,2018YFC1803100)资助。
蒋倩(1980—),女,贵州思南人,博士,高级工程师,主要从事仪器分析方法与功能的研发。E-mail: qjiang@issas.ac.cn

