EMS诱变对岷江百合种子萌发的影响
金 鸽, 张铭芳, 魏 蕾, 韩东洋, 杜运鹏, 杨凤萍, 薛 静, 陈绪清, 张秀海, 董 然
(1.吉林农业大学林学与草学学院, 长春 130118;2.北京市农林科学院,农业农村部华北都市农业重点实验室, 北京 100097)
百合为百合科(Liliaceae)百合属(Lilium)多年生草本植物,具地下鳞茎,是常见的观赏花卉,同时也具有食药用价值[1]。岷江百合(LiliumregaleWilson)别名王百合、千叶百合,天然分布于我国四川岷江流域海拔760~2 200 m气候变化剧烈的干旱河谷区域,对寒冷天气抵抗能力较强,同时对酸碱性土壤及石灰土也具有一定的抵抗能力,在土壤pH值达8.5的环境中仍能正常生长开花[2],具有抗病毒能力强的优点[3]。
甲基磺酸乙酯(Ethyl Methane Sulfonate,EMS)是典型的化学诱变剂,目前在许多植物的突变体育种研究及种质资源的创制中取得一定进展[4]。化学诱变育种具有使用方便、特异性较强和诱变后代较易稳定遗传的特点。通过化学诱变剂对农作物诱变后代进行多世代筛选、鉴定,已经培育出具有生产利用价值的农作物新品种。其中EMS化学诱变技术是创造新种质,改良农艺性状的常用方法,相比于其他诱变剂,EMS诱变剂应用效果较好。EMS直接作用于DNA鸟嘌呤部分引起点突变及染色体损伤。EMS诱变产生点突变的频率较高,而诱发染色体畸变相对较少,且诱变产生的突变体多为显性突变体,易于进行突变体的田间筛选。目前,EMS诱变已经广泛的应用于西兰花种子[5],刺梨种子[6],藜麦种子[7-9],高粱种子[10],党参种子[11],燕麦种子[12],木槿种子[13],醉鱼草种子[14],红豆草种子[15]等。王育川等[9]以自育白种藜麦种子为实验材料,设置5个浓度(0.5%,1.0%,1.5%、2.0%,2.5%)的EMS缓冲液和4个时间(8,10,12,14 h)进行诱变处理,来确定半致死剂量[9]。闫锋等[16]用EMS(0.3%,0.6%,0.9%,1.2%)处理(6,10,1,4 h)糜子种子,来筛选建立糜子突变体库的适宜条件。于震宇[17]以金花葵种子为实验材料,设置不同的EMS浓度(0.4%,0.8%,1.2%,1.6%,2.0%)来筛选出EMS最佳处理浓度。
但是目前关于对百合种子的EMS诱变研究较少,田鑫等[18]以湖北百合鳞片为试材,首先采用9种不同培养基接种,获得诱导愈伤组织最佳配方,然后以该配方诱导出的愈伤组织为诱变材料,用EMS(0.2%,0.4%,0.6%)处理(1,2,3 h)愈伤组织,对诱变处理的愈伤组织分化的不定芽用0.4%浓度的NaCl胁迫处理0~12 d进行盐胁迫筛选,获得复合诱变处理后的最佳耐盐浓度。刘艳妮等[19]用EMS对百合离体叶片进行处理,筛选出其半致死浓度为0.6%和处理3 h。利用筛选出来的EMS浓度和处理时间对离体叶片进行处理,在1%盐浓度胁迫下进行抗盐性突变体筛选,得到抗盐性诱变植株。其研究认为筛选出来的百合突变体比对照具有更强的抗盐性。
目前,关于百合的EMS处理,较多是应用于离体组织,没有对种子的处理。本研究利用不同浓度的EMS和不同处理时间对岷江百合种子进行诱变处理,目的是筛选出未经沙藏处理的种子以及经过沙藏处理的种子最佳的诱变浓度和诱变时间,为创新种质资源、选育百合新品种奠定基础。
1 材料与方法
1.1 材料与试剂
百合种子取于北京农林科学院百合种植基地。化学诱变剂EMS为Solarbio品牌,为无色透明的油状液体。
1.2 试验设计
处理分为干种子组和沙藏种子组,干种子为岷江百合自交种子,沙藏种子组为岷江百合自交种子经过一个月的沙藏处理。用不同浓度的EMS(0,0.4%,0.8%,1.2%)处理百合种子2 h,4 h,8 h,每个处理3个重复。
1.3 试验流程
挑选胚部成熟的种子进行实验处理,3次重复,每个重复30粒种子,将种子及溶液放于50 mL的离心管中,放于28 ℃,200 r/min,在处理过程中偶尔翻转离心管,以保证种子与诱变剂充分反应。处理完成后,用自来水晃洗10次,上下摇晃30次,将种子倒在筛网中,流水冲洗30 min,以终止反应。处理完成后,在EMS溶液中加入1 mol/L的NaOH溶液,对EMS溶液进行消毒。
将处理完成后的种子均匀地铺在垫有湿润滤纸的培养皿上,进行培养,然后不定期对种子进行浇水,浸湿滤纸即可。
1.4 指标测定
在种子萌发第9,13,17天分别测定种子的发芽势、发芽率、成活率以及种子诱变当天的电导率。其中发芽的标准为只要种子萌发,即为发芽。
发芽势/%=(第9天种子发芽数/供试种子数)×100%;
发芽率/%=(第13天种子发芽数/供试种子数)×100%;
成活率/%=(第17天幼苗成活数/供试种子数)×100%;
相对发芽率/%=(处理组的发芽率/对照组的发芽率)×100%。
电导率的测定:挑选饱满的种子,每组9粒,称重,进行EMS处理,冲洗30 min后,用滤纸将水吸干,于10 mL蒸馏水浸泡30 min,用电导仪测定浸出液的电导率,以静置0.5 h的蒸馏水电导率为空白(ck),3次重复。每克处理样品种子浸出液电导率[mS/(cm·g)]=(测定电导率-空白电导率)/样品重量。
1.5 数据处理
采用SPSS 20.0数据处理软件进行方差分析,实验数据采用Excel软件进行绘图。
2 结果与分析
2.1 不同处理对种子发芽势的影响
由图1可见,岷江百合干种子和经过沙藏处理的种子,其发芽势都显著受到EMS诱变剂处理时间及浓度的影响。
干种子在同一处理浓度下,各个处理的发芽势随着EMS处理时间的延长而逐渐降低,0.4%EMS浓度处理2 h时其发芽势接近于浓度为0处理的对照种子,而在处理4 h和8 h时,其发芽势显著低于对照组。在0.8%EMS浓度处理4 h时,有部分种子发芽,而随着处理时间延长到8 h,种子的发芽数量极少。在同一处理时间下,各个处理的发芽势随着处理浓度的增加而逐渐降低。当处理时间为2 h,处理浓度从0.8%增加到1.2%时,其发芽势从9%将至0,发芽势显著下降。可见当处理时间为2 h,4 h,8 h时,不同浓度的EMS溶液处理干种子发芽势依次为1.2%<0.8%<0.4%<0。
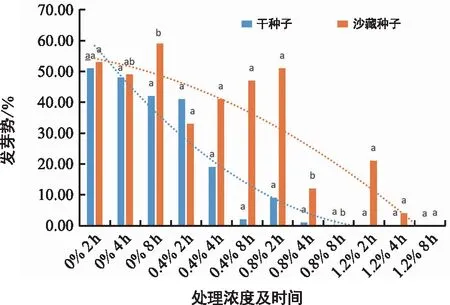
注:不同小写字母为同一类型种子在相同浓度,不同处理时间的多重比较标识,不同小写字母表示差异显著(p<0.05)。下同。图1 干种子及沙藏种子发芽势Fig.1 Germination potential of dry seeds and sandy storage seeds
当沙藏种子经0及0.4%浓度处理时,随着处理时间从2 h延长至8 h,其种子的发芽势逐渐升高,而在0.8%浓度处理2 h时,其发芽势开始随着处理时间的延长而逐渐降低,最终在0.8%浓度处理8 h时,发芽势由51%降至0。可见当处理时间为2 h,4 h,8 h时,不同浓度的EMS溶液处理干种子发芽势依次为1.2%<0.8%<0.4%<0。同时,图1也表明,在处理浓度为0时,经过沙藏处理种子的发芽势整体高于干种子的发芽势,说明种子在经过低温沙藏处理时,其胚开始发育。在种子经过0.4%,0.8%,1.2%处理时,也同样表明沙藏处理种子的发芽势高于干种子的发芽势,产生这种现象可能是由于种子在经过低温沙藏处理时,种子的活力增加,所以对于EMS诱变的抵抗能力也相应地增强。
2.2 不同处理对种子发芽率的影响
由图2可见,岷江百合干种子和经过沙藏处理的种子,其发芽率都显著受到EMS诱变剂处理时间及浓度的影响。

图2 干种子及沙藏种子发芽率Fig.2 Germination rate of dry seeds and sandy storage seeds
干种子在同一处理浓度下,各个处理的发芽率随着EMS处理时间的延长而逐渐降低,在0.4%EMS浓度处理2 h时其发芽率为71%,而随着EMS处理时间延长至8 h时,其发芽率降至13%。当种子由0.8%EMS浓度处理2 h,延长至8 h时,其发芽率由47%降至0。当种子由1.2%EMS浓度处理2 h,延长至8 h时,其发芽率由8%降至0。在同一处理时间下,各个处理的发芽率随着处理浓度的增加,而逐渐降低。在处理时间都为2 h时,种子发芽率随着处理浓度的增加而降低,发芽率分别为71%,57%,47%,8%。而当处理时间为8 h时,种子在0.8%、1.2%浓度时,发芽率都为0,可见浓度显著抑制了种子的萌发。沙藏种子的发芽率在0.4%浓度处理时,其发芽率随着处理时间的延长而增加,由42%逐渐增加至51%,而种子经0.8%、1.2%浓度处理时,其发芽率逐渐降低,最终其发芽率都为0。可见EMS显著抑制了种子的萌发,对种子造成了致死性的伤害,但是由图2可见,沙藏种子的发芽率整体上略高于干种子的发芽率。
2.3 不同处理对种子相对发芽率的影响
由图3可见,随着EMS浓度的升高,各个不同时间处理的相对发芽率逐渐降低。当EMS浓度为0.4%时,2 h处理的相对发芽率显著高于经过4 h和8 h处理的种子。可见时间的延长,对种子的生长起到了显著的抑制作用。但同时由于诱变剂作用的时间较短,所以浓度为0.4%,经过2 h处理时,其相对发芽率接近于对照组,说明此时对种子的毒害作用较弱。在4 h处理时,其相对发芽率为65.38%,接近半致死率,而当时间延长至8 h时,种子的相对发芽率约为对照组的1/4,这时对种子的发芽起到了显著的抑制作用。当EMS浓度为0.8%时,分别经2 h,4 h,8 h处理后,其发芽率分别为65.63%,23.08%,0。当EMS浓度在1.2%时,种子的相对发芽率显著低于对照组,经过2 h处理后,种子的相对发芽率为10.94%,而经过4 h和8 h处理后,种子的相对发芽率为0。综上所述,并且结合种子的生长情况,EMS浓度为0.4%,处理时间为4 h时,其相对发芽率接近半致死率,故岷江百合干种子的最佳诱变浓度和时间分别为0.4%,4 h。
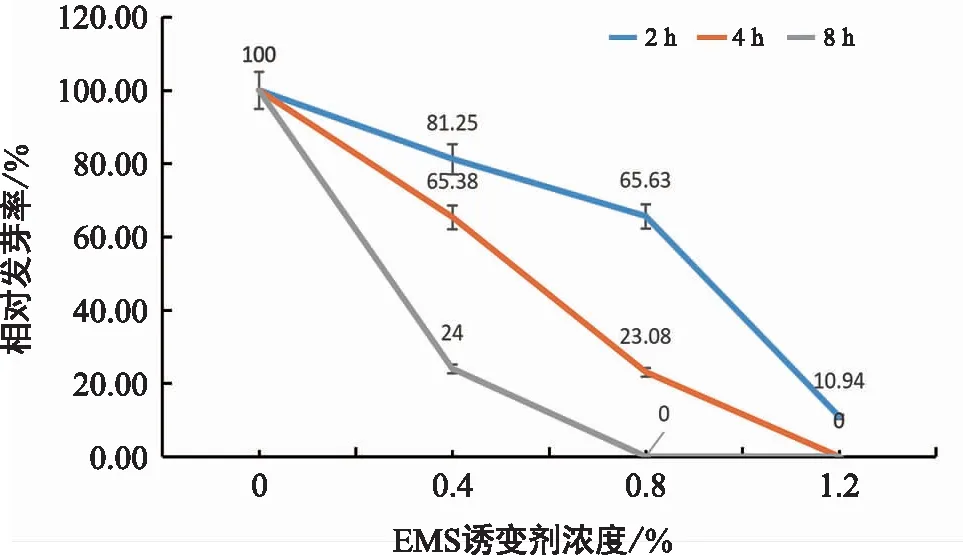
图3 干种子相对发芽率Fig.3 Relative germination rate of dry seeds
由图4可见,种子经0.4%浓度处理2 h时,其相对发芽率为62.3%,其较同样处理条件下的干种子的相对发芽率要低近20%,而经4 h处理的种子比经过8 h处理的种子相对发芽率要高,这与同样处理条件下的干种子相对发芽率趋势相同。在0.8%浓度处理时,种子的相对发芽率在经2 h,4 h,8 h处理时,其相对发芽率分别为85.25%,37.50%,0。在经1.2%浓度处理时,种子的相对发芽率都极低,综合比较,种子在经0.4%,2 h处理的相对发芽率接近半致死率,故岷江百合沙藏种子的最佳诱变浓度和时间分别为0.4%,2 h。

图4 沙藏种子相对发芽率Fig.4 Relative germination rate of sandy storage seeds
2.4 不同处理对种子成活率的影响
由图5可见,干种子在0,2 h处理时成活率为81%,此时生长状态良好,在0.4%,4 h时成活率达到56%。而沙藏处理的种子在0,2 h处理时成活率为72%,在0.4%,8 h处理时成活率达53%。在1.20%,2 h处理下,沙藏种子的成活率高于干种子的成活率,约为干种子成活率的3倍。可见随着EMS浓度的增加,百合种子的成活率逐渐降低,经过0.8%处理的种子,部分发生腐烂的情况,生长出来的幼苗整体偏小,而且有部分幼苗出现腐烂。经过1.2%浓度处理的种子,大部分存在腐烂坏死的现象,在芽尖处及种子表面发生腐烂现象。

图5 干种子及沙藏种子成活率Fig.5 Survival rate of dry seeds and sandy storage seeds
2.5 不同处理对种子浸泡液相对电导率的影响
由图6可见,种子浸泡液的电导率反映了细胞膜的受损程度,干种子在0.8%,2 h处理时,电导率最大,而后随着处理时间的延长和浓度的增加,电导率逐渐减小。沙藏种子在0.8%,4 h处理时,电导率达到最大,而后随着处理时间的延长和浓度的增加,电导率逐渐减小,而沙藏种子的电导率整体略高于干种子电导率。

图6 干种子及沙藏种子电导率Fig.6 Conductivity of dry seeds and sandy storage seeds

注:A,B,C,D分别为0,0.4%,0.8%,1.2%EMS浓度处理的种子,其中a代表处理2 h,第9天生长状况;b代表处理4 h,第9天生长状况;c代表处理8 h,第9天生长状况;d代表处理2 h,第13天生长状况;e代表处理4 h,第13天生长状况;f代表处理8 h,第13天生长状况;g代表处理2 h,第17天生长状况;h代表处理4 h,第17天生长状况;i代表处理8 h,第17天生长状况。图7 干种子生长状况Fig.7 Dry seed growth status
2.6 不同处理时种子胚长及根的生长状况
EMS浓度为0时,处理时间分别为2 h,4 h,8 h,在第9,13,17天时种子生长状况见图7。由图7可以看出,浓度为0处理的种子发芽速度及生长速度较快。EMS浓度为0.4%时,处理时间分别为2 h,4 h,8 h,在第9,13,17天时种子发芽速度比浓度为0处理的种子发芽及生长速度明显慢很多。尤其到生长第17天的时候,两者生长大小差异较大。这是由于EMS诱变剂对种子细胞造成了一定的伤害,对种子的发芽具有明显的抑制作用。EMS浓度为0.8%时,处理时间分别为2 h,4 h,8 h,在第9,13,17天时种子发芽速度比0.4%浓度处理的种子发芽及生长速度明显慢。且在0.8%浓度处理2 h及4 h的种子在第9天可以看见芽,而到了第13天,出现了腐烂。在第9天时,2 h,4 h,8 h芽生长的不明显,而到了第13天部分种子芽才可见。EMS浓度为1.2%时,处理时间分别为2 h,4 h,8 h,在第9,13,17天时种子的生长明显受到抑制,导致出芽率极低,甚至部分种子发生腐烂现象。
EMS浓度为0时,处理时间分别为2 h,4 h,8 h,在第9,13,17天时种子生长状况见图8,由图8可以看出,浓度为0处理的沙藏种子发芽速度比干种子发芽及生长速度快,主要是因为种子在经过低温沙藏过程中已经开始萌发,细胞内各种酶活性开始提升。EMS浓度为0.4%时,处理时间分别为2 h,4 h,8 h,在第9,13,17天时种子发芽速度比浓度为0处理的种子发芽及生长速度略慢,但是相比于干种子,生长较快。EMS浓度为0.8%时,处理时间分别为2 h,4 h,8 h,在第9,13,17天时种子发芽速度比0.4%浓度处理的种子发芽及生长速度明显减慢,而且在4 h和8 h处理的种子发芽不显著,可见EMS对种子发芽的抑制较为明显。EMS浓度为1.2%时,处理时间分别为2 h,4 h,8 h,在第9,13,17天时,沙藏种子和干种子一样,其生长明显受到抑制,导致出芽率极低,甚至部分种子发生腐烂现象。

图8 沙藏种子生长状况Fig.8 Growth status of sandy storage seeds
3 结论与讨论
在培育新品种上,经常使用EMS对种子或者植物组织等进行诱变处理,EMS诱发的突变主要通过两个步骤来完成,首先,鸟嘌呤的N-7位置被烷基化,成为一个带正电荷的季铵基团,从而发生两种遗传效应:一是烷化的鸟嘌呤与胸腺嘧啶配对,代替胞嘧啶,发生转换型的突变;二是由于鸟嘌呤的N-7烷基活化,糖苷键断裂造成脱嘌而后在DNA复制过程中,烷基化鸟嘌呤与胸腺嘧啶配对,导致碱基替换,即G∶C变为A∶T[20]。EMS诱变可以实现在短期内获得大量的突变体,构建突变体库,具有其他诱变育种方式所不具备的优点,因此常被现代育种学家用于大规模突变研究[21]。
本试验结果表明,干种子在0.4%,4 h处理时相对成活率达到65.38%,接近半致死剂量。而沙藏处理的种子在0.4%,2 h时相对成活率达62.3%,接近半致死剂量。因此,0.4%的EMS,处理4 h为EMS处理百合干种子的较适宜方式,0.4%浓度的EMS,处理2 h为EMS处理沙藏种子较适宜方式。马海新等[22]研究表明,4%浓度的EMS,2 h处理,对加工西红柿干种子处理的发芽率为45%,接近半致死剂量;3%浓度的EMS,12 h处理对加工西红柿湿种子处理的发芽率为61%,接近半致死剂量。安佰义等[23]研究表明,EMS诱变处理白桦种子的适宜条件为1.0%处理5 h或0.4%处理7 h。续言等[24]研究结果表明,4%浓度的EMS处理尾叶紫薇8 h和12 h后全部致死。2%浓度处理4 h的相对致死率为48.18%,接近半致死浓度。这说明不同种子对EMS的敏感性差异较大,诱变效果存在很大不同。并且随着EMS浓度的增加以及处理时间的延长,对种子的萌发及生长抑制作用就越来越显著。周厚成等[25]用不同浓度EMS对草莓愈伤组织进行诱变处理,结果表明,随着EMS处理浓度的增加和时间的延长,愈伤组织死亡率呈上升趋势;所以EMS处理种子及其他愈伤组织,均会起到抑制生长的作用。

