基于3D-STI评估家庭自主式康复训练对AMI病人PCI术后左心室重构及心功能的影响
王向杰,许青宗,贾博涵,王 笑,颜秉菊
急性心肌梗死(acute myocardial infarction,AMI)是冠状动脉缺血缺氧引起的心肌坏死,经皮冠状动脉介入(percutaneous coronary intervention,PCI)通过改善冠状动脉梗阻和心肌细胞,进而改善预后,是治疗AMI的有效手段[1-2]。PCI术后病人常发生左心室重构,可增加心力衰竭、心律失常等发生风险,进而影响病人病情转归,因此,早期识别PCI术后左心室重构并进行干预,对改善病人生命质量具有重要意义。超声心动图是临床常用的评价心脏形态及心功能的方法,但PCI术后心脏形态无明显变化,在左心室重构的早期评估中的应用价值有限[3-4]。随着超声技术的发展,三维斑点追踪技术(three-dimen-sional speckle tracking imaging,3D-STI)采用三维全容积成像全面追踪心肌运动轨迹,可全面准确地评定左心室功能,进而有助于左室重构的早期判断[5-6]。基于此,为明确3D-STI对PCI术后左室重构的评估价值,本研究以96例AMI病人为研究对象,分析其在PCI术后及训练康复前后3D-STI参数变化,进而为评估左室重构提供参考,进而指导临床干预措施的实施,提高病人生命质量。
1 资料与方法
1.1 一般资料 选取2019年10月—2020年10月我院收治的96例AMI并接受延迟PCI的病人。干预6个月后根据PCI术后和家庭自主式康复训练后左室收缩末期容积(LVESV)变化将病人分为左室重构组(53例)和无左室重构组(43例)。若康复训练后LVESV较PCI术后增加>15%提示发生左室重构;若康复训练后LVESV较PCI术后增加≤15%提示未发生左室重构。
1.2 纳入与排除标准 纳入标准:符合《中国急性ST段抬高型心肌梗死诊断和治疗指南》[7]中AMI诊断标准;年龄>18岁;心电图出现病理性Q波;心电图出现新的ST段改变或左束支传导阻滞;心肌活力丧失或区域性室壁运动异常;符合PCI手术指征;病人或家属知情且同意参与本研究。排除标准:合并严重心、肝、肾等重要脏器功能障碍;心脏室壁瘤或室壁变薄;合并冠状动脉夹层;存在活动障碍;主支血管近中段狭窄>85%。本研究获得我院伦理研究委员会批准。
1.3 方法
1.3.1 家庭自主式康复训练 PCI术后24 h内若未新发严重心律失常或心电图改变,无明显心力衰竭失代偿征兆,无新发或再发胸痛开始进行康复训练,出院后自我监测运动。训练强度由专业康复医师根据病人运动过程中自测心率、脉搏进行确定。康复训练内容,术后第1天~第2天:病人可在家属帮助下于床边椅子静坐30 min,每日3次;术后第3天:病人可在家属帮助下于扶床站立,并左右挪步,每次5~8 min,每日3次;术后第4天:可由家属搀扶在病房内缓慢行走,每次5~8 min,每日3次;术后第5天:可搀扶病人在走廊缓慢行走8~12 min,每日3次。术后第6天:可由家属搀扶慢登5阶楼梯,并到院内散步10~15 min,每日3次。术后第7天~第10天:病人日常生活可自理,每日坚持散步15~20 min,每日4次。术后第11天~第14天:在家属陪同下可登梯1层,并于室外散步20~30 min,每日4次。术后第15天~第21天:在家属陪同下可登梯2层,并于室外散步30~40 min,每日4次。术后第22天~第28天:病人可进行日常活动,重体力活动除外。术后第2个月~第3个月:病人身体恢复良好,可逐渐开始工作。出院1个月后每周1次电话康复指导运动训练,出院后1~6个月,每周3~5次有氧运动及阻抗运动,每次30~60 min。
1.3.2 超声检查 AMI病人分别于PCI术后1个月内及PCI术后6个月进行超声心动图检查和3D-STI超声检查,美国GE公司生产的彩色多普勒超声仪,二维探头M5S-D(1.5~4.5 MHz)获得左心室四腔心切面及二腔心切面后测量左心室舒张末期容积(LVEDV)、LVESV,计算左室射血分数(LVEF)、左心室质量(LVM)、左室室壁运动积分指数(LVWMSI)。完成超声心动图检查后更换为三维探头4V-D探头,获取清晰的左心室内膜全容积图像后,利用3D-STI软件分析并测定整体长轴应变(global longitudinal strain,GLS)、整体径向应变(global radial strain,GRS)、整体环形应变(global circumferential strain,GCS)、整体面积应变(global area strain,GAS)。
2 结 果
2.1 左室重构组和无左室重构组临床资料比较 左室重构组肌酸激酶同工酶、峰值肌钙蛋白I、PCI前ST段上抬、PCI 60 min后ST段上抬均高于无左室重构组,LVEF、GLS、GAS低于无左室重构组,差异有统计学意义(P<0.05)。详见表1。
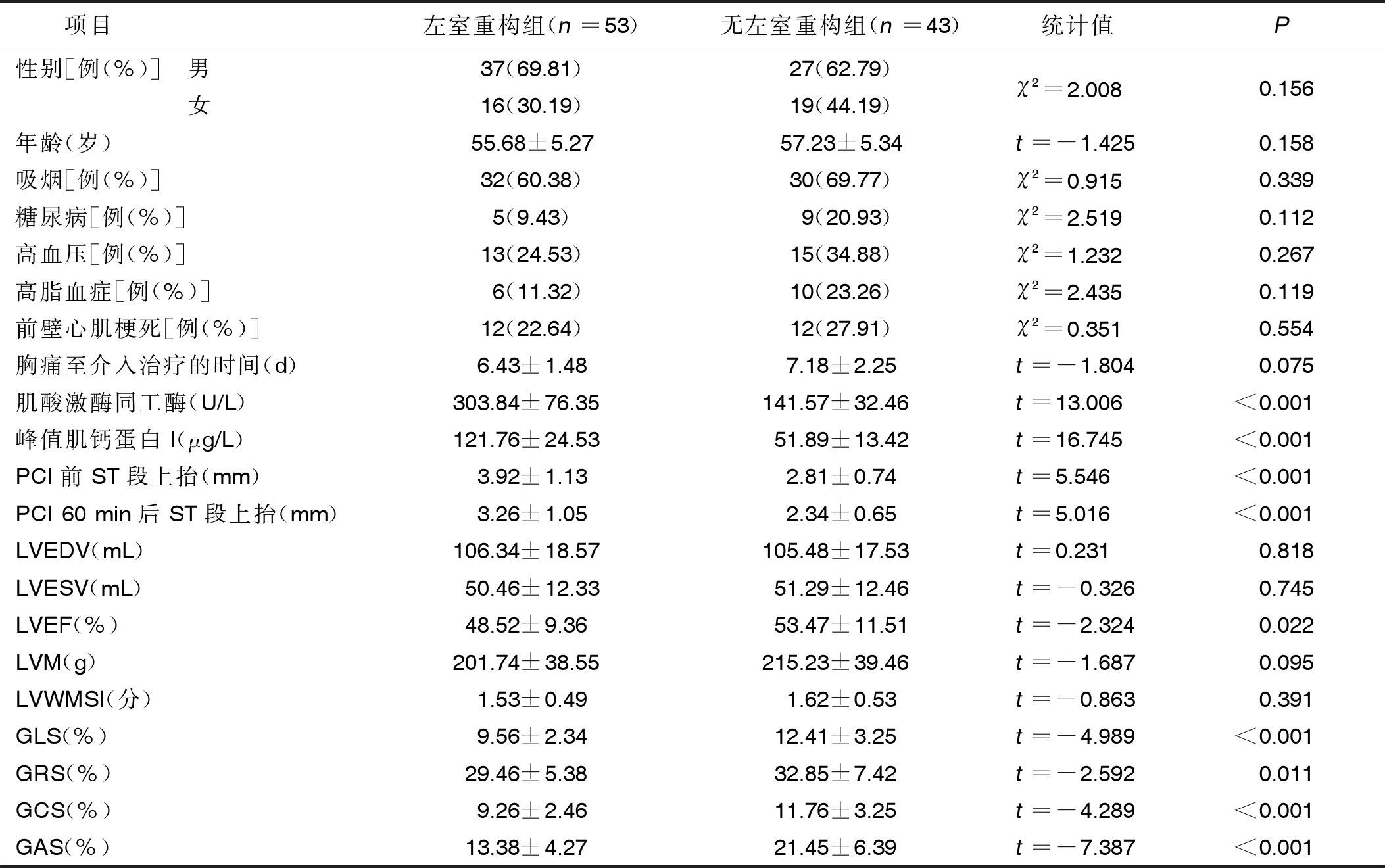
表1 左室重构组和无左室重构组临床资料比较
2.2 3D-STI预测AMI病人PCI术后家庭自主式康复训练后左室重构的临床价值 应用受试者工作特征(ROC)曲线计算GCS、GAS预测左室重构的临床价值,结果显示,GCS临界值为-10.85%时,ROC曲线下面积(AUC)为0.87,灵敏度为86.56%,特异度为83.43%;GAS临界值为28.46%时,AUC为0.81,灵敏度为84.49%,特异度为81.26%。详见图1。
2.3 3D-STI对AMI病人PCI术后家庭自主式康复训练后左室重构的影响因素分析 将影响左室重构的相关因素纳入各节段纵向应变达峰时间的标准差(Ts-SD)公式,结果显示,GCS(OR=3.466)、GAS(OR=3.384)是预测左室重构的独立影响因素(P<0.05)。详见表2。

图1 3D-STI预测心室重构的ROC曲线图

表2 3D-STI对AMI病人PCI术后家庭自主式康复训练后左室重构的影响因素分析
3 讨 论
AMI病人体内大量炎症细胞在缺血心肌及周围心肌内浸润,进而促进成纤维细胞增殖、胶原代谢紊乱,导致左室重构发生。PCI治疗虽然可有效改善心肌功能,但对疾病长期控制需有效的健康管理方式[8-9]。心脏康复训练是一种全面、综合的干预体系,对改善心血管危险因素,降低死亡率具有重要的临床意义。若能及时、准确评估心室重构指导康复训练,可提高病人生活质量[10-11]。本研究采用3D-STI评价PCI术后及康复训练后心室重构和心功能状态,结果显示,GCS、GAS是独立预测左室重构的重要指标,在心室重构早期评估中具有较好的预测价值。
本研究结果显示,左室重构组肌酸激酶同工酶、峰值肌钙蛋白I、PCI前ST段上抬、PCI 60 min后ST段上抬均高于无左室重构组,可能是由于家庭式自主康复训练中心脏运动康复通过有氧运动,促进冠状动脉血流恢复,缓解血管平滑肌痉挛,减少氧自由基产生,改善细胞缺血缺氧状态。相关研究显示,抑制交感神经过度激活,可增加肾小球滤过率,减轻肾脏慢性炎症反应,改善内皮功能、胰岛素抵抗等,减少心血管危险因素,减轻冠状动脉血管粥样硬化,最终降低病死率[12-13]。相关研究显示,冠心病病人PCI术后予以适当康复训练有助于改善预后[14-15]。PCI术后左室重构过程中,心室舒缩功能减弱、射血量减少、舒张末期容积明显增加,因此,左室重构病人心室功能参数升高,左心室心肌在各方向的运动幅度表明心肌应变能力,运动幅度越大,心肌应变能力越好[16-17]。因此,3D-STI中的相关参数可评定AMI病人左心室收缩功能,心室重构和无心室重构病人3D-STI参数存在显著差异,提示PCI术后进行3D-STI参数的测定有助于预测AMI病人PCI术后发生左室重构[18-19]。超声心动图测定LVESV变化可准确评价PCI术后左室重构,但常规超声在PCI术后无明显参数变化时无法进行有效评价。3D-STI可对心脏形态学进行三维重建并分析心脏长轴运动、径向运动、圆周运动变应性,进而反映心脏的整体功能。
将3D-STI相关参数纳入Ts-SD公式,结果显示,GCS、GAS是预测左室重构的独立影响因素,应用ROC曲线计算GCS、GAS预测左室重构的最佳界值显示,GCS临界值为-10.85%时,AUC为0.87,灵敏度为86.56%,特异度为83.43%;GAS临界值为28.46%时,AUC为0.81,灵敏度为84.49%,特异度为81.26%。说明GCS、GAS独立预测左室重构具有较好的临床价值,可为临床评价AMI病人左室重构提供可靠依据。心脏结构的复杂性和特殊性,准确评价心脏功能有助于评估心脏室壁运动,进而有助于早期评估左室重构[20]。超声心动图是基于二维平面,心脏搏动时可影响图像分析的准确性。3D-STI可连续获取心脏全容积图像进行分析,追踪心肌运动轨迹,心脏在长轴运动、径向运动和圆周运动上的应变值,通过数据计算获取其速度、位移、扭转等参数,进而评价心室重构。由于本研究样本量有限,未对AMI病人心肌梗死冠状动脉循环进行详细区分,因此,需扩大样本量进一步分析病人情况,提高3D-STI在AMI病人PCI术后心室重构的准确性及有效性,为临床应用提供可靠依据。
综上所述,基于3D-STI评估家庭自主式康复训练对AMI病人PCI术后左室重构及心功能具有较好的临床价值,GCS、GAS可独立预测左室重构,为临床评估AMI病人PCI术后左室重构提供可靠依据。

