TMAO通过PI3K/Akt/mTOR通路干预急性心肌梗死病人动脉斑块的作用机制
邵良发,鄢高亮,张启杰,杨宏飞
动脉粥样硬化性疾病包括急性心肌梗死(acute myocardial infarction,AMI)是发展中国家死亡和致残的主要原因[1]。除了动脉粥样硬化斑块大小外,斑块稳定性也是AMI的主要危险因素[2]。因此,寻找有效的方法提高颈动脉粥样硬化斑块稳定性是十分必要的。有研究表明,血浆三甲胺-N-氧化物(trimethylamine-N-oxide,TMAO)水平在动脉粥样硬化病人中升高,且与动脉粥样硬化加速有关[3]。有研究报道,载脂蛋白E基因敲除(ApoE-/-)小鼠中采用TMAO的斑块总面积增加了2倍[4]。上述研究提示降低TMAO水平可能是预防动脉粥样硬化进展的有效方法。然而,TMAO在动脉粥样硬化斑块稳定性中的作用及机制尚未明确。本研究通过光学相干断层扫描(optical coherence tomography,OCT)评估ST段抬高性心肌梗死(ST-segment elevation myocardial infarction,STEMI)病人的斑块形态,分析血浆TMAO水平与OCT检测到的易损斑块之间的关系,同时探讨了触发TMAO形成的黄素单加氧酶3抑制剂甲巯咪唑(methimazole,MMI)对动脉粥样硬化家兔模型斑块稳定性的影响。
1 资料与方法
1.1 一般资料 选取2019年3月—2021年2月205例接受OCT评估罪犯病变的STEMI病人。纳入标准:STEMI病人;年龄≥18岁;病人签署书面知情同意书。205例病人中,49例被排除,其中支架内血栓形成14例,大量血栓8例,图像质量差20例和其他病因7例。将156例病人分为易损组(54例)和非易损组(102例)。STEMI定义为持续性胸痛>30 min,ST段抬高>0.1 mV,至少两个相邻导联或18导联心电图(ECG)出现新的左束支传导阻滞,肌钙蛋白I水平升高。罪犯病变由心脏病专家和影像技术人员通过心电图、超声心动图、血管造影和OCT进行鉴定。
1.2 OCT图像分析 OCT图像由2名研究员在St Jude OCT离线审查工作站中分析,出现不一致结果时采用共同协商解决。易损和非易损斑块的观察者内Kappa系数分别为0.962和0.951,观察者间Kappa系数为0.813。根据相关标准[5],非易损斑块是通过破坏的纤维帽和清晰的空腔形成。易损斑块定义为罪犯病变处的斑块至少有一个不同光信号强度的异质信号丰富层位于管腔表面附近,并与下面的组织清楚区分,详见图1。图中白色箭头表示血栓。
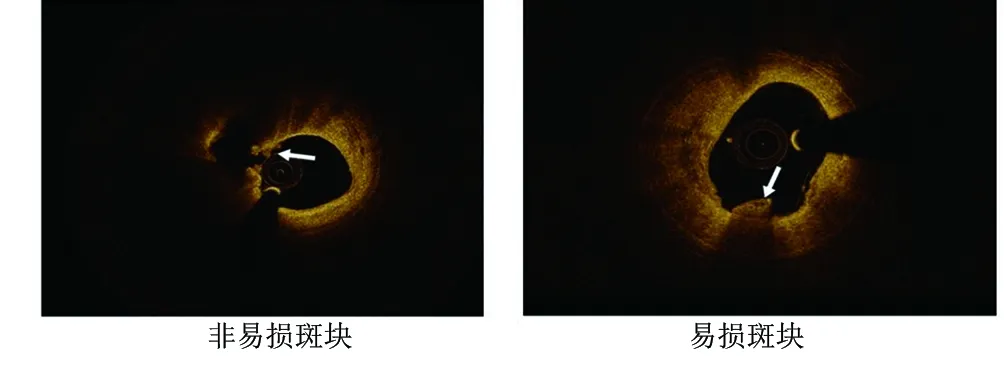
图1 典型OCT图像
1.3 测定血浆TMAO水平 肝素化前,通过桡骨或股骨通路采集血样,收集于含有乙二胺四乙酸(EDTA)的真空采集试管。样品置于-80 ℃环境中,进一步分析。采用稳定同位素稀释液相色谱-串联质谱法定量血浆TMAO水平。
1.4 实验动物及分组 将我院实验动物中心提供的24只无特定病原体(SPF)级新西兰雄性大白兔(8周龄)随机分为正常组(对照组)、动脉粥样硬化组(模型组)和动脉粥样硬化+MMI治疗组(干预组),每组8只家兔。对照组饲喂标准兔饲料,模型组和干预组饲喂高胆固醇高脂饲料(1%胆固醇、4%猪油、15%蛋黄粉)。喂养第13周,干预组家兔给予MMI灌胃给药(批号:HY-B0208,美国MedChemExpress公司),剂量为15 mg/kg,每日1次,连续给药4周。模型组家兔注射等量生理盐水。饲养过程中,每4周记录一次家兔体质量和血浆TMAO水平。第16周结束,所有家兔全身注射肝素抗凝,之后采用戊巴比妥钠处死。取出主动脉组织进行病理分析。
1.5 组织学分析 将主动脉组织置于4%多聚甲醛中固定24 h,蔗糖脱水后包埋于最佳切割温度(OCT)复合物中,连续冰冻切片厚7 μm。将冰冻切片用油红O(美国Sigma)、苏木精-伊红(HE)(美国Sigma)和Masson三色染色(北京Solarbio公司)染色观察斑块病变。选择覆盖坏死核心的连续纤维帽切片,绘制垂直于管腔的线测量纤维帽厚度。每个斑块随机选择3个位置测量纤维帽厚度和内膜-中层厚度,取平均值。内膜/中层比值为内膜面积(内部弹性层面积减去管腔面积)与中层面积(内部和外部弹性层之间的面积)比值。为了对主动脉区域的总粥样硬化斑块进行正面分析,每个主动脉沿着纵轴展开,之后固定在黑色背景板上。主动脉采用油红O染色,并使用高分辨率相机拍摄。
1.6 免疫印迹法(Western Blot)分析 模型组和干预组取斑块显著的组织进行检查。将100 mg组织加入1 mL RIPA裂解缓冲液中进行组织均质化以提取总组织蛋白。将等量的蛋白质加载到十二烷基酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上进行分离,并将分离的蛋白质转移到0.45 μm聚偏二氟乙烯(PVDF)膜上(美国Millipore公司)。使用5%脱脂奶粉封闭后,在膜上依次加入相应的一级抗体和二级抗体。本实验使用以下抗体:抗雷帕霉素靶蛋白(mTOR,1∶500,美国Santa Cruz公司),抗磷酸化mTOR(p-mTOR)(1∶500,Santa Cruz),抗磷脂酰肌醇3-激酶(PI3K,1∶1 000,美国Proteintech公司),抗磷酸化PI3K(p-PI3K)(1∶1 000,Proteintech),蛋白激酶B(Akt,1∶1 000,Proteintech),抗磷酸化Akt(p-Akt)(1∶1 000,Proteintech)和抗GAPDH(1∶2 000,Santa Cruz)。二级抗体为辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG(美国Servicebio公司)。使用化学发光试剂显示条带,Bio-Rad成像仪曝光和扫描。利用Quantity-One软件对免疫反应条带进行定量分析,并以GAPDH作为内参测定靶蛋白相对表达量。
2 结 果
2.1 病人临床资料 纳入病人的平均年龄57岁,男性占81.4%,高血压病人占55.1%,糖尿病病人占30.1%。易损组较非易损组年龄更大,体质指数更低,易损组斑块破裂和薄纤维帽粥样硬化斑块发生率高于非易损组(P<0.01)。易损组血浆TMAO水平高于非易损组(P<0.001),且纤维帽厚度降低(P<0.001)。相关性分析结果显示,TMAO与纤维帽厚度呈负相关(r=-0.418,P<0.001),详见图2。
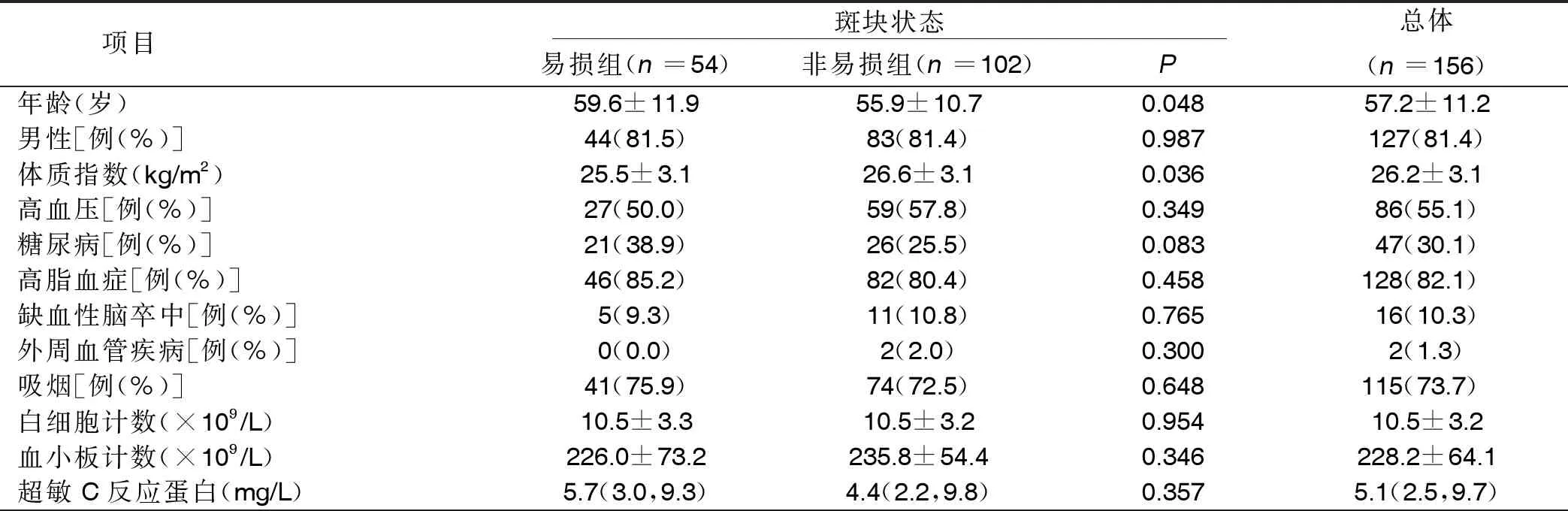
表1 易损组和非易损组临床资料比较
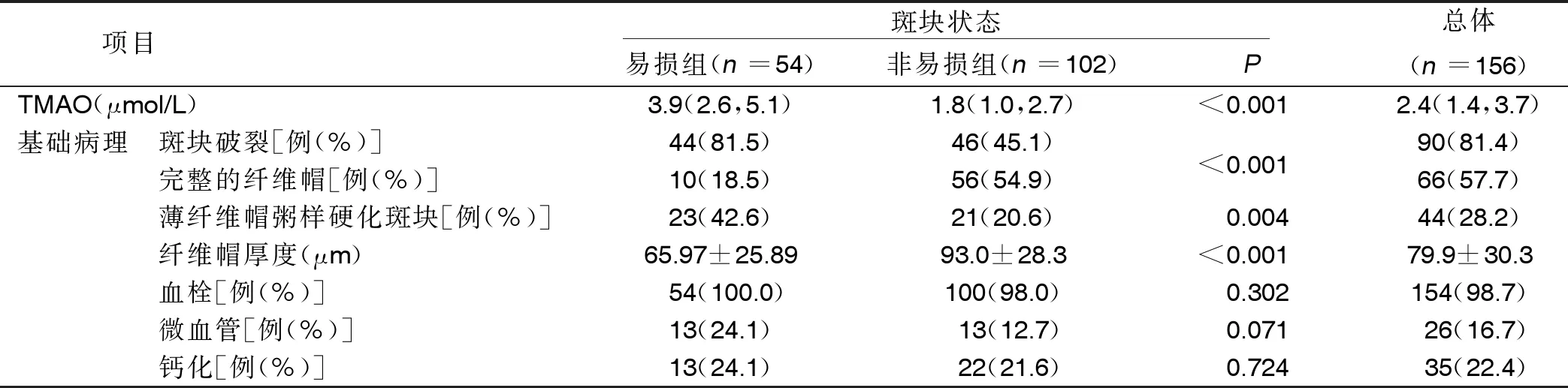
(续表)
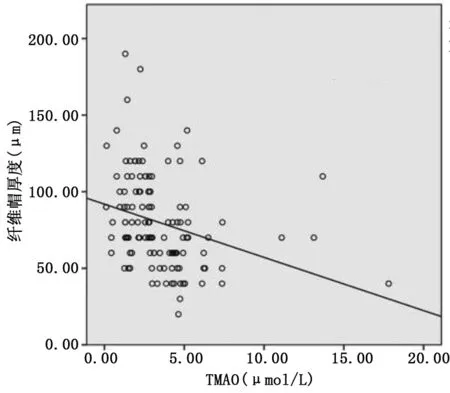
图2 TMAO和纤维帽厚度的相关性散点图
2.2 家兔的基本特征及血浆TMAO水平变化 实验过程中,对照组家兔一般情况良好,模型组和干预组家兔表现出食欲差、无精打采、毛发稀疏、行动迟缓等轻微症状。3组体质量继续稳定增长。高脂饲料喂养8~12周,模型组和干预组体质量增加均大于对照组,12周时差异显著,详见图3A。与对照组比较,4周时、8周时、12周时和16周时模型组血浆TMAO水平升高(P<0.05);16周时干预组血浆TMAO水平低于模型组(P<0.001)。详见图3B。
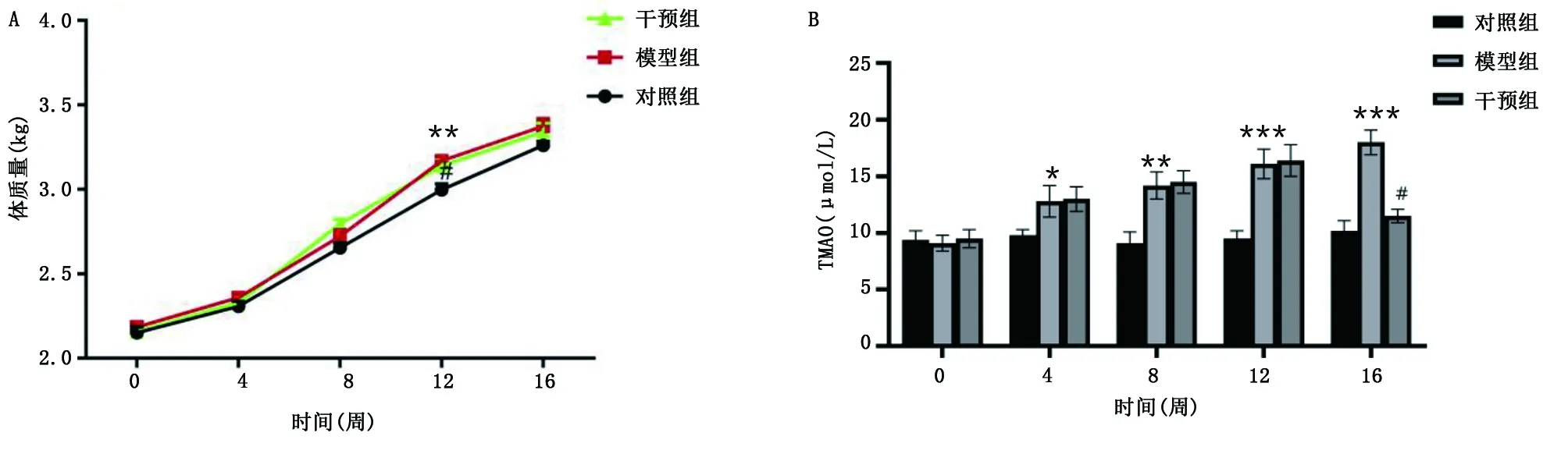
模型组与对照组比较,*P<0.05,**P<0.01,***P<0.001;干预组与模型组比较,#P<0.001。图3 各组家兔体质量和血浆TMAO水平变化(A为各组体质量折线图;B为各组血浆TMAO水平变化)
2.3 主动脉粥样硬化及斑块易损性情况 为进一步定量比较动脉粥样硬化病变,对3组家兔的主动脉进行病理染色分析。与对照组比较,模型组主动脉出现更多的红色脂质斑块,干预组显著降低了脂质斑块的比例,详见图4A。HE染色显示:对照组主动脉血管形态正常,模型组动脉管腔明显变窄,动脉内膜增厚,内膜下可见大量泡沫细胞和炎性细胞,中层平滑肌细胞排列紊乱,详见图4B。Masson染色显示:模型组主动脉粥样硬化斑块表面覆盖着弱纤维帽,甚至部分断裂;对照组主动脉内弹力膜连续和完整,但模型组中由于大量脂质侵入而严重受损,并在动脉粥样硬化斑块下破裂成碎片;干预组可减少脂质浸润,改善内膜完整性,详见图4C。干预组可减轻主动脉内膜增生,降低内膜-中层厚度和内膜/中层比值,同时增加斑块纤维帽厚度,详见图4D~图4F。

与模型组比较,*P<0.01。图4 各组主动脉粥样硬化斑块组织学特征和病理变化(A为动脉粥样硬化斑块主动脉胸腹段纵剖面的油红O染色图;B为主动脉HE染色图;C为主动脉Masson染色图;D为模型组与干预组动脉粥样硬化斑块纤维帽厚度比较的柱状图;E为模型组与干预组内膜-中层厚度比较的柱状图;F为模型组与干预组内膜/中层比值比较的柱状图)
2.4 MMI对动脉粥样硬化斑块中PI3K/Akt/mTOR信号分子蛋白表达的影响 模型组动脉粥样硬化斑块p-PI3K/PI3K、p-Akt/Akt和p-mTOR/mTOR蛋白表达高于对照组(P<0.001);干预组动脉粥样硬化斑块p-PI3K/PI3K、p-Akt/Akt和p-mTOR/mTOR蛋白表达低于模型组(P<0.05或P<0.01)。详见图5。
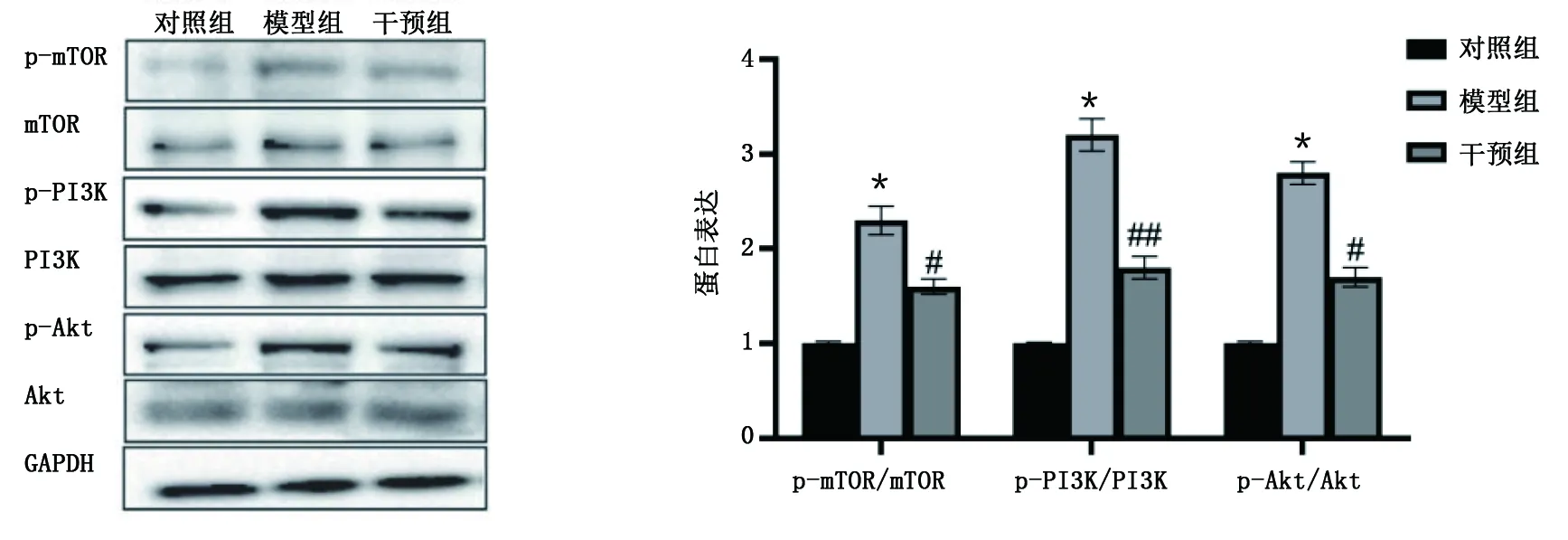
模型组与对照组比较,*P<0.001;干预组与模型组比较,#P<0.05,##P<0.01。图5 MMI对动脉粥样硬化斑块中PI3K/Akt/mTOR信号分子蛋白表达的影响(A为PI3K/Akt/mTOR信号分子蛋白条带图;B为PI3K/Akt/mTOR信号分子蛋白柱状图)
3 讨 论
易损斑块的形成通过将冠状动脉管腔逐渐狭窄缺血促进动脉粥样硬化斑块发展[6]。一项病理研究表明,复发性斑块破裂或侵蚀后愈合可能促进斑块生长和增加负担[7]。与非易损斑块的病人比较,罪犯部位易损斑块的病人管腔狭窄程度更高,病变更长、更复杂[8]。本研究纳入的34.6%STEMI病人罪犯斑块中发现了易损斑块,且易损斑块病人存在较多的斑块破裂和薄纤维帽粥样硬化斑块,增加了心血管事件风险。本研究结果显示,易损斑块病人血浆TMAO水平高于非易损斑块病人;相关性分析显示,TMAO与纤维帽厚度呈负相关。TMAO是膳食中胆碱和磷脂酰胆碱依赖肠道微生物群的副产物,来源于黄素单加氧酶3对三甲胺的氧化[9]。含三甲胺的营养素广泛存在于日常生活食物中,包括红肉、蛋黄和海鲜。TMAO可增强血小板反应性,减少胆固醇逆向转运,增加巨噬细胞泡沫细胞活化,并与冠状动脉疾病的进展和预后密切相关[10]。因此,TMAO可能参与STEMI病人罪犯病变斑块破裂。
为了进一步评估TMAO在斑块稳定性中的作用,采用新西兰家兔模拟动脉粥样硬化,由于家兔与人类病理学之间有较强的相似性;家兔对高胆固醇饮食敏感,高胆固醇饮食可导致显著的主动脉粥样硬化表型[11]。本研究结果显示,与对照组比较,模型组主动脉出现更多的红色脂质斑块,动脉管腔变窄,动脉内膜增厚,并在内膜下可见大量泡沫细胞和炎性细胞,中层平滑肌细胞排列紊乱。Masson染色显示,模型组主动脉粥样硬化斑块表面覆盖着弱纤维帽,甚至部分断裂。这些发现提示新西兰家兔成功模拟了动脉粥样硬化斑块易损模型。同时结果显示,模型组各时间血浆TMAO水平高于对照组;采用MMI降低血浆TMAO水平有助于减轻家兔主动脉粥样硬化模型主动脉内膜增生,降低内膜-中层厚度和内膜/中层比值,同时增加斑块纤维帽厚度。结果表明,降低血浆TMAO水平减轻了高脂喂养引起的兔动脉粥样硬化的发展,并一定程度降低了动脉粥样硬化斑块不稳定性。
目前,PI3K/Akt/mTOR通路认为是调节动脉粥样硬化斑块形成的关键通路,多项研究表明,抑制PI3K/Akt/mTOR通路能有效改善动脉粥样硬化[12-13]。有研究显示,miR-126通过抑制PI3K/Akt/mTOR通路恢复自噬通量,减轻低密度脂蛋白诱导的人脐静脉内皮细胞损伤[13]。相关研究显示,PI3K/Akt/mTOR通路是血管生成的关键通路,其下游血管内皮生长因子和基质金属蛋白酶细胞因子通过诱导血管生成,促进动脉粥样硬化斑块进展[14-15]。本研究结果显示,模型组动脉粥样硬化斑块中p-PI3K、p-Akt和p-mTOR表达显著高于对照组,表明PI3K/Akt/mTOR信号通路在动脉粥样硬化斑块形成过程中被激活。采用MMI处理后这些蛋白水平均降低,提示TMAO可能通过PI3K/Akt/mTOR信号通路参与斑块形成。
综上所述,TMAO在AMI病人罪犯病变斑块破裂中发挥着重要作用。STEMI病人和兔动脉粥样硬化模型血浆TMAO水平增加,可能通过激活PI3K/Akt/mTOR通路促进动脉粥样硬化进展和斑块易损,抑制血浆TMAO水平可能是预防AMI的一种新策略。

