长非编码 RNA 作为竞争性内源性 RNA 在骨肉瘤中的作用
姚金辉 白锐
骨肉瘤 (osteosarcoma,OS) 是常好发于青少年长骨干骺端的恶性骨肿瘤,是青少年癌症相关死亡的最主要原因,也是世界范围内最主要的骨原发恶性肿瘤[1]。OS 的特点是恶性类骨质的产生并对常规的治疗手段产生抵抗。尽管化疗结合手术治疗的方法使非转移性 OS 患者 5 年生存率大幅提高,但确诊时存在转移或复发的患者 10 年总生存率仍不到 20%[2]。虽然对 OS 的发病机制进行了大量的探索,但对 OS 发生的分子机制的了解却十分有限。OS 的治疗如手术切除、放疗、化疗等不断取得进展,但 OS 患者,特别是复发和转移患者的总生存率仍不尽如人意[3]。因此,探究 OS 的分子机制,找寻 OS 的基因靶点及生物标志物,对于攻克 OS 治疗瓶颈有着至关重要的作用。
非编码 RNA (non-coding RNA,ncRNA) 是指不被翻译成蛋白质的 RNA,主要包括微小 RNA (microRNA,miRNA)、长链非编码 RNA (long non-coding RNA,LncRNA)、环状 RNA (circular RNA,circRNA) 等。它们的共同特点是能从基因组上转录而来,但是不翻译成蛋白,并在 RNA 水平发挥各自的生物学功能。人类转录组中98% 是由 ncRNA 组成[4]。随着基因测序技术的迅猛发展,ncRNA 被证实在细胞的多种生理和病理过程中发挥重要作用。ncRNA 越来越被人们重视,并在生物学中的地位有了很大的提升[5]。其中 LncRNAs 参与多种过程:从组蛋白修饰、染色质重塑到转录和转录后过程的调节。其可作为增强剂、支架或通过海绵作用与其它 RNA 竞争结合位点,也可以作为某些 miRNAs 的前体。LncRNAs 的异常表达,特别是致癌的 LncRNAs,解除了细胞信号级联反应的调控,从而影响细胞增殖,促进肿瘤的进展和转移[6]。
竞争内源性 RNA (competing endogenous RNA,ceRNA)学说是近年来兴起的一种崭新的基因表达调控学说[5]。ceRNA 是一种 RNA 转录体,通过降低 miRNA 的靶向浓度与其它具有共同 miRNA 响应元件 (MREs) 的信使 RNA(mRNA) 的去抑制性来实现相互沟通,从而在转录后水平控制基因表达[7]。在 2007 年,ceRNA 就被人们发现并加以研究,Brown 等[8]在研究小鼠血友病 B 中发现了通过介导 miR-142-3p 的靶序列标记 hF.IX 转基因,可以在免疫功能正常的 B 型血友病小鼠中进行长期 LV 介导的递送,为血友病 B 提供了一种全新的治疗方法。随后 Ebert 等[9]报道了一种导入哺乳动物细胞的 miRNA 抑制剂,它具有像海绵一样的功能,可以像吸水一样吸附 miRNA,从而隔断 miRNA 对靶序列标记物产生的生物学功能,因此被称为“miRNA 海绵”。并于 2010 年,由 Bartel 等[10],将此理论进行了进一步的完善,发现有些蛋白编码基因及其假基因在 3’ 非翻译区 (3’UTR) 中包含相同的 miRNA 结合位点,可以通过竞争 miRNA 结合进而调控各自的表达水平。
ceRNA 学说自 2011 年提出至今虽然才短短 11 年,但已经成为 RNA 领域的研究热点之一,并已被证实在肝癌、结直肠癌、乳腺癌、黑色素瘤等常见恶性肿瘤的发生发展中起重要调控作用[11-14]。近年来,越来越多关于ceRNA 与 OS 的研究揭示了其在 OS 复杂分子调控网络中的作用。目前,OS 中 ceRNA 的研究主要集中在 LncRNA上,对 circRNA 或 mRNA 的研究相对较少。并且越来越多的数据表明,LncRNAs 通过 LncRNA-miRNA-mRNA 的机制参与 OS 的发病机制。
因此,LncRNA 作为 ceRNA,并在 OS 发生发展机制中的相互作用,揭示了 OS 复杂的分子调控网络,为 OS的基础研究及临床治疗方案指出新的方向,改善 OS 的临床治疗预后,提高患者生存率。
一、OS 的信号传导途径
Notch 信号通路调节成骨细胞的分化和干细胞的维持,在 OS 的发展中起着重要作用[15]。Notch 途径促进细胞迁移和侵袭,刺激 OS 细胞增殖。Notch 信号通路还增加了对化疗的抵抗力,同时抑制 Notch 信号通路减少了肿瘤体积并防止了转移[16-17]。
据推测 OS 细胞是从成骨细胞或其更具有多种功能的祖先细胞分化而来,这说明 OS 细胞依赖于在细胞增殖和分化中发挥核心作用的 Wnt 信号通路。Wnt 信号通路与增殖刺激癌基因 c-Myc 和 CCND1 的激活有关[18]。该途径可被 FOXO1 抑制,FOXO1 促进成骨细胞谱系中早期前体细胞的维持和分化,并且能够抑制前体细胞的增殖,因此FOXO1 抑制 OS 的发展[19]。而 FOXO 通路又通过 PI3K (磷脂酰肌醇-3-激酶) / AKT (丝氨酸 / 苏氨酸蛋白激酶) 信号通路被抑制[20]。典型的 Wnt / β-连环蛋白级联刺激 OS 发生发展。 Wnt / β-catenin 级联的一个重要部分是 β-catenin受 TCF-1 转录因子和 LEF 淋巴增强结合因子的调节[21]。蛋白 P53 和热休克蛋白 90 (HSP90) 参与 TCF-1 抑制和 OS细胞随后的凋亡;因此,其作用是抗癌的[21]。此外,P53通过抑制骨祖细胞在成骨初期所需的转录因子 Osterix 和Runx2[22],对成骨细胞的形成起负调控作用[23-24]。因此有研究发现,P53 通路在抑制 OS 的发展中发挥关键作用,其与 DNA 损伤、细胞周期停滞、细胞凋亡和肿瘤抑制有关。MDM2 是 P53 的负调控因子,在 OS 细胞中发现其表达通常增高,并且约 10% 的 OS 患者缺乏 MDM2 抑制剂CDKN2A,这可能是 OS 发生发展的作用机制之一[25]。
有研究表明 OS 患者基因检测中,有 20%~40% 的患者检测到 Rb1 突变。Rb 是一种肿瘤抑制蛋白,是细胞周期的负调控因子。但是通过间接作用激活 Rb 的 CDKN2A在 OS 细胞中经常缺失,而 RB 的负调节因子 CDK4 和CCND1 在一些侵袭性 OS 肿瘤中过表达[25]。
JNK 是一种参与调节级联反应的蛋白激酶,是一种在成骨细胞增殖、分化和凋亡中起关键作用的“主要蛋白激酶”。相应信号通路的抑制剂可以抑制 OS 细胞的增殖和转移。核转录因子 NF-κB 途径 (核因子 κB) 可调节多种基因的转录活性,以应对损伤因子和细胞因子的作用,促进细胞增殖,抑制细胞凋亡,这一信号通路通常可以通过不同的机制抑制 OS 的发生发展[26]。各种信号通路的激活(尤其是 PI3K / AKT 和 MAPK),并通过生长因子 (如IGF、TGF、CTGF 等) 影响细胞周期及细胞凋亡,这些机制参与了[27]OS 的发病。对 OS 生长至关重要的血管生成也与这些因素有关,其过程决定于 HIF-1 途径和促血管生成因子 VEGF 的激活,它与 ERK / NF-κB 和 PI3K / AKT 途径一起促进了抗凋亡蛋白 Bcl-2 和 survivin 的激活。VEGF的表达依赖于转录激活剂 STAT3,它在 OS 中的过度表达与 OS 患者的预后不良相关[27]。
二、OS 细胞中具有 ceRNA 活性的致癌基因
有研究发现,在包括 OS 在内的肿瘤中,表现出致癌特性的 LncRNAs 的数量显著高于肿瘤抑制基因 LncRNAs的数量,这些 LncRNAs 在 OS 的发生发展中起着促进的作用。
SNHGs (small nucleolar RNA host genes) 家族的成员:在 OS 细胞中,LncRNA 通过 LncRNA-miRNA-mRNA 发挥作用,这对于 SNHGs 家族中的许多成员都适用。例如 SNHG1 就被多篇文献报道通过海绵作用 miRNA,发挥调控作用。在 OS 细胞中 LncRNA SNHG1 的表达增加而 miR-577 的表达降低,并且 LncRNA SNHG1 通过海绵miR-577,与其竞争结合 WNT2B,从而上调 WNT2B[28]。同样 LncRNA SNHG1 还参与 SNHG1 / miR-326 / NOB1 轴[29]和 SNHG1 / miR101-3p / ROCK1 轴,并参与上皮 - 间质转化 (EMT) 的激活和 PI3K / AKT 途径的失活[30]。发挥同样作用的 SNHG 家族成员还有很多。
例如:LncRNA SNHG3 通过 SNHG3 / miRNA-151a-3p /RAB22A 轴调控 RAB22A 的表达,进而激活 OS 细胞的迁移和侵袭[31]。此外,OS 组织中 LncRNA SNHG3 的表达升高,还可以通过 SNHG3 / miR-196a-5p / HOXC8 轴促进mRNA HOXC8 的合成,mRNA HOXC8 的合成增多是患者预后不利的标志[32]。
LncRNA SNHG5 分别海绵作用 miR-212-3p 及miR-26a,并通过 SNHG5 / miR-212-3p / SGK3 轴[33]及SNHG5 / ROCK1 轴[34]在 OS 细胞中发挥致癌作用。
LncRNA SNHG7 在体内外都有促进肿瘤生长的作用。研究发现其通过海绵结合 miR-34a 并降低其水平,增加了 SMAD4[35]的表达水平和增殖相关的 Notch1、凋亡相关的 BCL-2、与细胞周期调节相关的 CDK6 以及 EMT 的表达水平。
与此相同的还有 LncRNA SNHG20,在 OS 中同样表现为致癌基因,并通过 SNHG20 / miR-139 / RUNX2 轴来促进OS 细胞的增殖和侵袭[36]。
LncRNA SNHG16 作为致癌因子,在 OS 细胞中作为 ceRNA 海绵结合多种 miRNA,现发现其与 miR-205结合作用于 mRNA ZEB1,与 miR-1301 结合作用于mRNA BCL9,通过 SNHG16 / miR-205 / ZEB1 和 SNHG16 /miR-1301 / BCL9,促进 OS 的进展[37-38]。还发现海绵作用miR-1285-3p,增高前 Caspase-3 和 Bcl-2 蛋白表达,抑制OS 细胞凋亡[39]。
LncRNA SNHG12 通过 SNHG12 / miR-195-5p / Notch2轴促成 OS 细胞的迁移和侵袭。另外 LncRNA SNHG12 还可以结合 miR-195-5p 靶点 mRNA IGF1R,通过 SNHG12 /miR-195-5p / IGF1R 途径刺激 OS 细胞的增殖和转移[40]。
以上 SNHGs (Small Nucleolar RNA Host Genes) 家族的成员在 OS 中作为 ceRNA 并影响 OS 发生发展,起到促进OS 细胞迁移及侵袭的作用 (图1)。
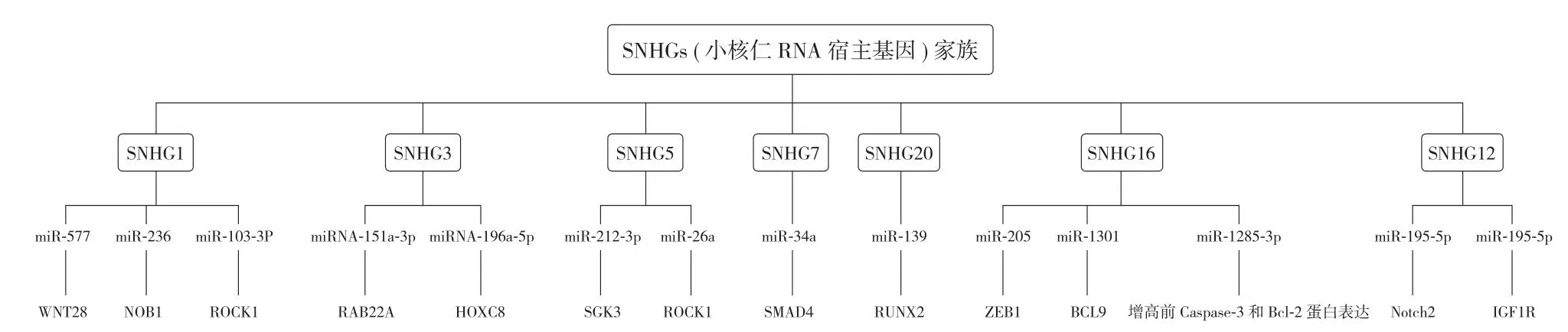
图1 SNHGs 家族在 OS 中涉及的调控轴Fig.1 The control axis involved in the OS of the SNHGs family
1.LncRNA NEAT1 (nuclear enriched abundant transcript 1) 在 OS 组织和细胞中同样有致癌特性。有文献报道发现,其作用通过 NEAT1 / miR-34c / bcl2 (CCND)轴[41]及 NEAT1 / miR-339-5p / TGF-β1[42]轴发挥,并促进OS 发生发展。
2.LncRNA APTR (alu-mediated p21 transcriptional regulator) 通过 APTR / miR-132-3p / YAP1 轴参与 OS 的进展[43]。
3.LncRNA MIR31HG [ (miR-31)-host gene ]在 OS 细胞、晚期疾病和远处转移患者的肿瘤组织中高度表达。MIR31HG 在体外和体内的表达升高,通过 MIR31HG /miR361 / VEGF (FOXM1,Twist) 轴,抑制 miR-361,增强VEGF、FOXM1 和 Twist 的表达,刺激 OS 细胞的生长[44]。
4.LncRNA DLEU1 (deleted in lymphocytic leukemia 1)在 OS 肿瘤组织和细胞中高表达;作为一个癌基因,它通过 DLEU1 / miR-671-5p / DDX5 轴与 miR-671-5p 直接竞争,激活 DDX5[45]。
5.LncRNA SND1-IT1 (SND1 intronic transcript 1) 通过SND1IT1 / miRNA-665 / POU2F1 轴直接与 miRNA-665 结合,激活 POU2F1 基因从而增强 OS 细胞的增殖和迁移[46]基因间 LncRNA LINC00858 通过 LINC00858 / miR-139 /CDK14 轴参与 OS 的发病[47]。基因间 LncRNA LINC00511通过 LINC00511 / miR-618 / MAEL 轴的直接相互作用,激活 MAEL 原癌基因而刺激 OS 的进展[48]。
反义 LncRNA 是 LncRNA 中具有代表性的一大类非编码 RNA 分子,广泛参与细胞内生理和病理的调控,在研究 OS 的分子机制过程中,有几个反义 LncRNA 被发现对OS 的发生发展过程起着促进的作用,并且通过 LncRNA-miRNA-mRNA 的机制参与 OS 的发病机制。例如,反义 LncRNA OIP5-AS1 (opa-interacting protein 5 antisense transcript 1) 在 OS 细胞中表达增加,且与 miR-200b-3p 竞争性结合并抑制其在 OS 细胞中的表达,通过 OIP5-AS1 /miR-223 / CDK14 轴促进 CDK14 的表达,这与 OS 细胞的凋亡抑制和增殖激活有关[49];反义 LncRNA HOXA11-AS (homeobox a11 antisense) 通过几个信号轴参与 OS 的发生和发展;目前,发现的两个信号轴是 HOXA11AS /miR-124-3p / ROCK1[50]和 HOXA11-AS / miR125a-5p /Rab3D[51];反义 LncRNA TP73-AS1 (tumor protein P73 antisense RNA 1) 也是原癌基因,它通过 TP73-AS1 /miR-142 / rac1 轴[52]促进 OS 进展;反义 LncRNA FEZF1-AS(antisense LncRNA of the FEZ zinc finger-1 gene) 通过FEZF1AS1 / miR-4443 / NUPR1 (核蛋白 1,转录调节因子)途径在体内外刺激 OS 细胞的增殖、迁移和侵袭[53];反义 LncRNA KCNQ1OT1 (KCNQ1 opposite strand / antisense transcript 1) 在 KCNQ1OT1 / miR-4458 / CCND2 轴中通过miR-4458 激活 CCND2,这也与 OS 进展有关[54]。反义LncRNA ILF3-AS1 (interleukin enhancer binding factor 3,Antisense RNA 1) 由 SP1 转录因子诱导。它通过 SP1-ILF3-AS1 / miR-212 / SOX5 轴与 miR-212 结合,激活转录因子SOX5,从而促进 OS 的进展[55]。反义 LncRNA ASMTLAS1 (ASMTL antisense RNA 1) 可以作为 miR-342-3p 的ceRNA,抑制其在 OS 细胞中的活性,从而导致 ADAM9水平的增加。抑制 miR-342-3p 或上调 ADAM9 可减弱 OS细胞中 ASMTL-AS1 诱导的抗肿瘤活性,以 ASMTL-AS1 /miR-342-3p / ADAM9 轴来实现对 OS 进展的正向调控[56]。
LncRNA TUG1 (taurine upregulated 1) 在 OS 细胞中,与众多 miRNA 发生海绵作用。目前研究发现,其通过 LncRNA-miRNA-mRNA 机制参与 OS 的发生发展的共有 9 个轴,分别为 TUG1 / miR9-5p / POU2F1[57],TUG1 /miRNA144-3p / EZH2[58],TUG1 / miR-3355p / ROCK1[59],TUG1 / miR-132-3p / Sox4[60],TUG1 / miR-212-3p / FOXA1[61],TUG1 / miR-143-5p / HIF-1α[62],TUG1 / miR-425-5p /CTNNB1[63]和 TUG1 / miR-140-5p / PFN2[64],TUG1 / miR-377-3p / Ezrin[65](图2)。
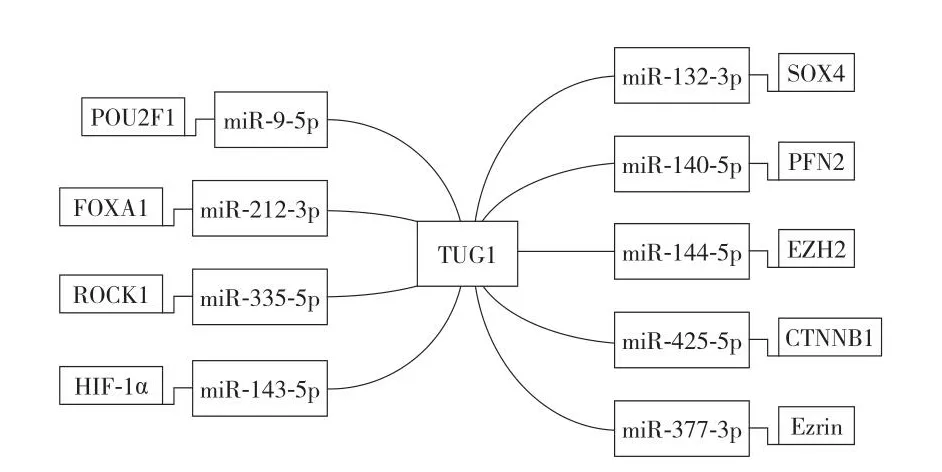
图2 OS 细胞中涉及 LncRNA TUG1 的 9 个轴Fig.2 Nine axes involving LncRNA TUG1 in OS cells
同样拥有多条调控轴的 LncRNA XIST (X inactivespecific transcript) 通过与不同的 miRNA 及其靶点的直接相互作用,参与了影响 OS 进展的 7 个轴。图3 为 XIST的六个促进 OS 细胞活性的轴。分别为 XIST / miR-320b /RAP2B[66],XIST / miR-193a-3p / RSF1[67],XIST / miR-195-5p / YAP[68],XIST / miR-375-3p / ATK / mTOR[69],XIST /miR137 / MMP2,MMP9[70]以及 XITS / miR-153 / SNAI1[71]。其中有一项研究发现,与 XIST 调控的其它轴的促进作用相比,LncRNA XIST 通过 XIST / miR-21-5p / PDCD4 轴,可以提高 PDCD4 肿瘤抑制因子的水平,并对 OS 的进展和转移起到抑制的作用 (图3) 产生相反的效果[72]。
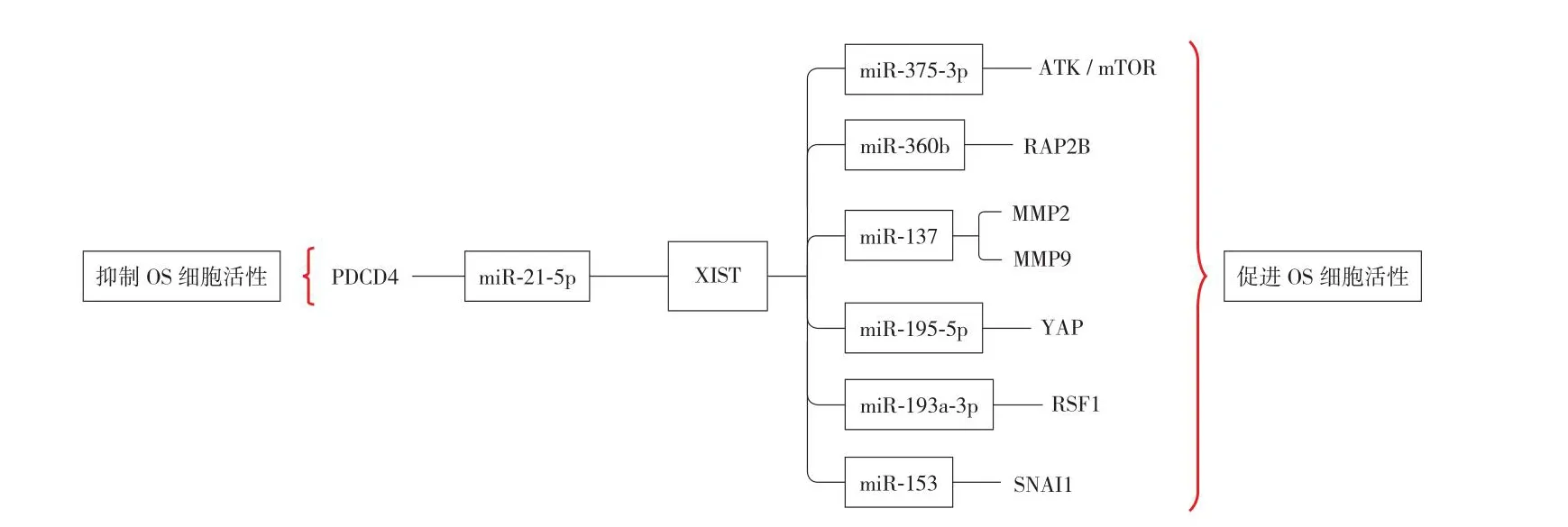
图3 骨肉瘤细胞中涉及致癌基因 LncRNA XIST 的调节轴Fig.3 Regulatory axis involving the oncogene LncRNA XIST in osteosarcoma cells
研究最充分的致癌 LncRNA 是 MALAT1 (metastasisassociated lung adenocarcinoma transcript 1) 被发现参与OS 细胞中 ceRNA 类型的基因调控轴的数量最多 (超过10 个),根据 ceRNA 模型,这些研究中有关 MALAT1 参与 OS 的基因调控的数据见表1。

表1 MALAT1 参与 OS 的基因调控轴Tab.1 MALAT1 participation in the gene regulatory axis of OS
表1 中可见,miR-142-3p 和 miR-129-5p 有共同的mRNA HMGB1[73],此外 MALAT1 还与 miR-129-5p 作用激活了原癌基因 RET,增强了 OS 细胞的干细胞样特性,并激活了 PI3K / AKT 途径[74]。MALAT1 所发挥的功能多样性还反映在 miR-34a / c-5p 和 miR449a / b 拥有共同的靶基因 c-Met 和 SOX4[78]。LncRNA MALAT1 与 miR-34a 结合,激活了 CCND1[80]。
有些文献提出 LncRNAs 通过一组 miRNAs 参与多个轴,并表明这些分子具有不同 miRNAs 的几个结合位点。因此,此类 LncRNA 具有多功能性。一些研究确定了介导 LncRNA 和 mRNA 之间调控的特定 miRNA 反应元件。例如,miR-144-3p 的 5’ 端有 7 个核苷酸与 MALAT1和 mRNA ROCK1 的 3’ 非翻译区 (3’-UTR) 中相同的7-nt 片段互补[74]。在 miR-140-5p 和 LncRNA MALAT1 和mRNA HDAC4 的 3’-UTR 中也发现 miRNA 反应元件[82]。LncRNA MALAT1 在 OS 细胞中过量表达与增殖、迁移、侵袭、EMT 和转移的增强有关。许多研究表明,LncRNA MALAT1 可能是 OS 患者疾病预后和治疗的一个有希望的基因靶点。总之,有文献证实 LncRNA MALAT1 在调节 OS细胞过程中涉及增殖、细胞周期、运动性、干性和转移的基因表达。最近又有研究发现了几个通过 LncRNA-miRNA-mRNA 轴对 OS 进展起到促进作用的 LncRNAs (表2)。
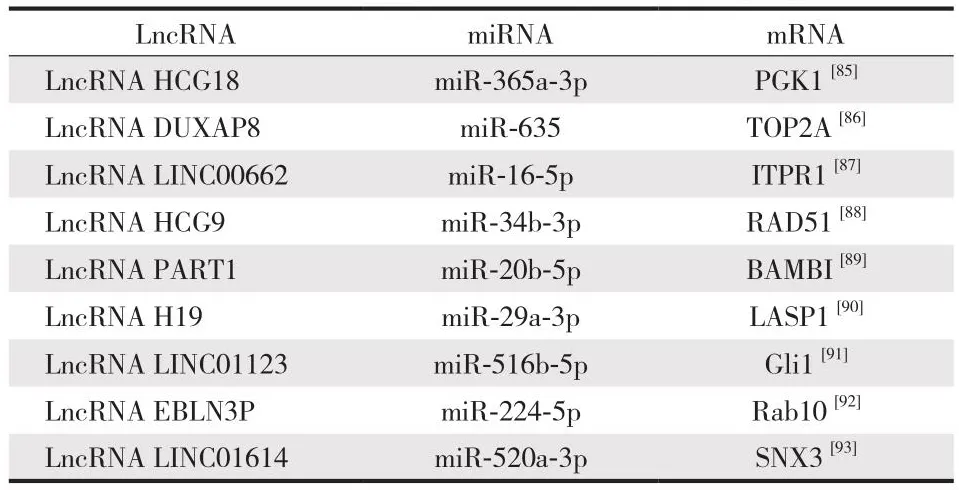
表2 最近发现的利用 ceRNA 机制促进 OS 生长和进展的 9 个致癌性 LncRNAs 轴Tab.1 Recently-discovered 9 carcinogenic LncRNAs axes that utilize ceRNA mechanisms to promote OS growth and progression
综上所述,上面讨论的所有 LncRNAs 都是通过涉及miRNAs 和 mRNAs 的 ceRNA 机制起作用,这些 LncRNA对 OS 的生长和进展主要是促进作用。
三、OS 细胞中具有 ceRNA 活性的抑癌基因
在 OS 细胞中,除了一些高表达促进 OS 细胞增殖和侵袭的 LncRNA 作为的 ceRNA 发挥生物学效应之外,有研究还发现一些 LncRNA 在 OS 中低表达可以抑制 OS 细胞增殖、侵袭和转移。这些 LncRNA 通过在 LncRNA /miRNA / mRNA 轴的直接结合机制对 OS 细胞的增殖、迁移和侵袭产生影响并抑制其活性。在这些情况下,低水平的 LncRNA 通常会导致相应的 miRNA 水平上升,从而导致靶 mRNA 的抑制。
有研究证明,LncRNA GAS5 (growth arrest-specific transcript 5) 可以控制非小细胞肺癌[94]、乳腺癌[95]和胃癌[96]在内的多种癌症的细胞增殖、细胞周期和凋亡,从而发挥抑癌作用。Ye 等[97]于 2017 年发现在 OS 细胞中GAS5 作为 miR-221 的 ceRNA 通过负调控使 miR-221 显著促进 ARHI 的表达,从而抑制 OS 细胞生长和上皮间质转化,并在体内和体外都显示出了抗癌活性。最近 Liu 等[98]发现 GAS5 在 OS 中作为竞争性内源性 RNA,通过海绵作用 miR-23a-3p,调节 PI3K / AKT 通路促进 PTEN 表达,抑制细胞生长和侵袭。Yao 等[99]还发现 GAS5 还可以通过海绵化 miR-663a 抑制 RHOB 来抑制 OS 细胞的增殖、侵袭和转移。
此外在 OS 细胞系和临床标本中,LncRNA CASC2(cancer susceptibility candidate 2) 的表达减少,且 CASC2低表达抑制了 OS 细胞的增殖、克隆形成和侵袭[100]。据文献报道,CASC2 在 OS 细胞中的低表达抑制了 miR-181a的表达,并且增强了 RASSF6、PTEN 和 ATM Ser / Thr 蛋白激酶的表达。RASSF6、PTEN 和 ATM mRNAs 被证实为 miR-181a 的直接靶基因。进而证明 RASSF6 为 LncRNA CASC2 的下游效应器,这也进一步证实了 CASC2 通过CASC2 / miR-181a / RASSF6 轴,对 OS 有负面调控作用。
1.LncRNA NBAT1 (neuroblastoma associated transcript 1)在包括 OS 在内的不同类型的恶性肿瘤中发挥抑制作用,是一种肿瘤因子。LncRNA NBAT1 通过直接结合 miR-21抑制体内和体外的生长和转移,导致其靶基因 PTEN、PDCD4、TPM1 和 RECK 的表达增加。所有这些转录出的蛋白质都显示出肿瘤抑制特性[101]。RECK 是 MMP9 的负调控因子,被认为是肿瘤转移的抑制因子。这些相互作用包括在 NBAT1 / miR-21 / PTEN (PDCD4、TPM1 和RECK) 轴。
2.LncRNA-p21 在 OS 组织中的表达降低,PTEN 是AKT 信号通路的一个众所周知的抑制剂,体外实验表明该 LncRNA 通过与 miR-130b 结合,即通过 LncRNA-p21 /miR-130b / PTEN 轴[102],提高 PTEN 的水平,以抑制 OS细胞系的增殖。
3.LncRNA FER1L4 (fer-1-like protein 4) 通过 FER1L4 /miR-18a-5p / SOCS5 轴抑制 OS 细胞进展,LncRNA FER1L4直接结合并抑制 miR-18a-5p,并激活 SOCS5,从而诱导细胞凋亡,并抑制 EMT 标志物和 PI3K / AKT 信号的表达[103]。
有文献证明 LncRNA LINC00588 可以抑制 OS 细胞的增殖、迁移和侵袭,但不能抑制细胞凋亡。LINC00588 作为 ceRNA 抑制 miR-1972,通过 LINC00588 / miR-1972 /P53 链激活 miR1972 的直接靶点 mRNA P53。虽然 LncRNA LINC00588 在 OS 中表达减少,但在肺转移瘤中表达增加[104]。这反映了 LncRNA 在 OS 细胞发生的过程的影响的多样性。
Liu 等[105]还发现 OS 细胞中 LncRNA NR-136400 表达下调,并且证明 LncRNA NR_136400 通过海绵作用与miR-8081 竞争性结合,进而上调抑癌基因 TUSC5 的表达,通过 miR-8081 / TUSC5Z 轴,抑制 OS 细胞的增殖和侵袭。
到目前为止,发现了大约 100 000 个 LncRNA 分子,它们发挥着不同的功能,主要功能表现为调节作用,这些LncRNA 参与了对基因表达的微调,它们被赋予了细胞信号级联的“主调节器 ”的角色。据推测,miRNAs 可以调节多达 50% 的蛋白编码基因的表达,并可以调节细胞功能的许多方面,尤其与肿瘤细胞极其相关的增殖、分化、凋亡、黏附、EMT 和转移。在近几年中,这些 LncRNA 成为研究人员关注的焦点。
LncRNAs 作为 ceRNA 与 miRNAs 结合,并且与编码蛋白质的 mRNAs 竞争的机制日益被广泛接受,并已在包括 OS 在内的不同来源的肿瘤中得到了相当令人信服的成果。在 OS 细胞中,一些 LncRNA 的表达升高导致具有致癌潜力的蛋白质被激活并促进肿瘤进展。目前,在 OS 中发现,呈高表达且具有致癌作用的 LncRNA 的数目要比抑癌作用的 LncRNA 的数量高几倍。就当前研究进展而言,无法确定这是否为 LncRNAs 的特性,抑或是研究人员的研究偏好,更侧重于致癌基因的研究。
目前,已经发现大量的 LncRNAs,其中值得注意的是它们能在多大程度上通过竞争性相互作用影响细胞过程的可逆性和动态性。众所周知,miRNAs 的影响是模糊的,根据细胞环境,它们可能同时表现出致癌和抑癌的特性。在一些 LncRNA 身上,如 XIST、MEG3 和 LINC00588,也观察到了行为的模糊性。这扩大了对细胞过程影响的可逆性和动态性特征的概念。在 OS 的研究中,发现了一些 LncRNAs (MALAT1、PVT1、SNHG 家族成员、TUG1、XIST、NEAT1、HOXA11-AS 等) 参与了众多的调控轴,这证实了这些 LncRNAs 具有与各种 miRNAs 结合的位点,这一现象解释了 LncRNA 在 OS 中功能的多样性。
研究发现 OS 细胞中 LncRNA-miRNA-mRNA 调控轴涉及参与染色质重塑、细胞骨架转化、细胞与细胞外基质相互作用的转录因子、蛋白的 mRNA 以及包括细胞周期在内的多个过程的主要调控因子,这表明这些 LncRNA 在 OS发病机制中发挥着核心作用。
OS 是青少年中最常见和最具侵略性的骨恶性肿瘤,因此 LncRNA 的研究和鉴定以及对其在基因表达调控中功能的研究发现,为 OS 的发病和进展提供新的见解。现有发现的 LncRNA 已经为 OS 的诊断及诊疗提出新的思路与想法。这些 LncRNA 都可能成为治疗 OS 的新靶点,这为今后的 OS 治疗提供了新机制、新思路。
各种内源性 RNA,包括 mRNAs、miRNAs 和LncRNAs 之间的竞争性相互作用代表了一种新的基因调控形式,在 OS 的发病机制中发挥着重要作用。

