中国滇南地区莲雾炭疽病病原菌的形态学和分子生物学鉴定
李维峰, 何鹏搏, 陈红梅, 夭莹云, 李晶萍,于龙凤, 曲鹏, 葛宇, 谭万忠
1. 云南农业大学 热带作物学院,云南 普洱 665099;2. 云南农业大学 植物保护学院,昆明 650210;3. 滇西科技师范学院 生物科学与技术学院,云南 临沧 677000
莲雾Syzygiumsamarangense又名洋蒲桃, 为桃金娘科Myrtaceae常绿乔木植物, 原产地为马来西亚及印度, 在东南亚各国广泛栽培, 于17世纪后期被引入中国台湾省, 20世纪30年代引入中国内地, 现在海南、 广东、 广西、 福建和云南等地作为水果和绿化植物广泛种植, 面积大且产量高, 每公顷可收获果实达13 t以上[1-2], 属经济效益高、 生态效益好且发展前景广阔的热带常绿果树[3-10]. 然而, 莲雾果树的病害较多, 影响果实产量与品质, 已报道的主要有炭疽病、 果腐病、 斑点病、 煤污病和藻斑病等10多种重要病害[11-15]. 炭疽病是莲雾植株上普遍发生和为害严重的病害, 在我国莲雾栽培省区都有发生, 主要为害叶片和储藏期果实. 李杨秀等[16]采用形态学和分子生物学方法将广西莲雾炭疽病的病原菌鉴定为果生刺盘孢菌Colletotrichumfructicola; Obaidi等[17]鉴定了马来西亚莲雾炭疽病的病原菌为盘长孢刺盘孢C.gloeosporioides; Udayanga等[18]鉴定了引起泰国莲雾炭疽病的病原菌为莲雾刺盘孢C.syzygicola. 可见, 不同地区莲雾炭疽病病原菌均为刺盘孢属Colletotrichum真菌, 但具有物种多样性.
2021年, 课题组在调查云南省普洱市和西双版纳州热带果树病虫害时, 发现莲雾炭疽病在各区、 县果园均严重发生, 但该地炭疽病病原菌种类迄今尚无报道. 本研究从该地区不同果园采集炭疽病病叶进行病原菌分离纯化、 柯赫氏证病试验、 形态学和ITS(Internal Jranscribed Spacer)序列分子鉴定, 以明确该地炭疽病菌归属, 为病害的有效控制提供科学依据.
1 材料和方法
1.1 材料
1.1.1 莲雾叶样品
于2021年6月从普洱市、 7月从西双版纳州不同区、 县采集具有典型炭疽病症状的叶片标本, 带回实验室用于病原菌分离和纯化. 另外, 在普洱市思茅区倚象镇果园采集健康莲雾叶片, 用于菌株致病性测试.
1.1.2 培养基
采用北京三药科技开发公司生产的马铃薯葡萄糖琼脂培养基(PDA), 使用时按1 000 mL培养液中含37 g PDA粉制作平板和斜面培养基, 用于菌种的分离纯化和保存.
1.1.3 引物
采用通用引物ITS1/ITS2扩增病菌的基因组rDNA-ITS片段, 引物序列为(5’-TCCGTAGGTGAACCTGCGG-3’/(5’-TCCTCCGCTTATTGATATGC-3’)[19], 由昆明硕擎生物技术有限公司合成.
1.2 方法
1.2.1 病原菌的分离纯化
对两个地区采集的病样, 分别采用病斑组织培养分离法分离和纯化病原真菌菌株处理[20]. 消毒过的染病组织置于直径15 cm的培养皿平板上, 放入25 ℃恒温箱中培养72 h, 从菌落边缘挑取尖端菌丝到新的PDA平板培养基中央, 在25 ℃恒温箱中培养96 h, 得到纯化培养菌株, 再将其转移到PDA试管斜面上培养48 h后, 于-4 ℃冰箱中保存备用.
1.2.2 病害症状记述
结合野外调查和后续室内接种试验观察, 记述不同时期的病害症状变化.
1.2.3 致病性试验
按照柯赫氏证病法则进行试验[21-22]. 在每个15 cm培养皿底部垫一层湿滤纸, 滤纸上放入1片健康莲雾叶片, 用针尖轻轻刺伤叶片两侧适当位点后分别接种3个约4×4 mm的菌饼, 然后盖上培养皿, 在室温(16~26 ℃)和避光下保湿(RH>90%)48 h后, 移去菌丝饼, 再继续培养20 d, 每天定时观察记录发病情况. 每个菌株接种处理5片叶(重复). 取接种10 d后的病斑做再分离和菌株纯化, 每个菌株分离5个病斑. 将得到的新分离纯化菌株与原接种菌株做形态比较, 确定其为同一性.
1.2.4 病原菌形态学观察和鉴定
经柯赫氏证病试验确认为病原菌的菌株, 在PDA平板培养基上25 ℃培养至14 d, 在此期间定时观察拍摄记录菌落的形态; 待病菌产孢后制作临时玻片, 在显微镜下观察拍摄分生孢子形态, 并在放大400×状态下测量50个孢子的长和宽. 根据病菌主要形态学特征参考有关文献[23-30]进行初步鉴定.
1.2.5 病原菌的聚合酶链式反应(PCR)鉴定
收取PDA平板培养基上培养7 d的病菌菌丝体, 用CTAB法[31]分别提取DNA, 用ITS1/ITS4引物对作为PCR扩增引物. PCR反应体系(25 μL)配方为: 2×EasyTaq PCR SuperMix 12 μL、 引物各1 μL、 模板DNA 1 μL、 ddH2O 10 μL. PCR扩增程序设置为: 94 ℃预变性5 min; (94 ℃变性1 min, 55 ℃退火1 min)循环32次; 最后72 ℃延伸4 min. PCR产物经1.5%琼脂糖凝胶电泳确认后送昆明硕擎生物技术有限公司回收和测序. 将获得的病原菌rDNA-ITS序列上传到美国国家生物技术信息中心(NCBI) GenBank数据库获得登录号, 在线(https: //blast.ncbi.nlm.nih.gov/Blast.cgi)进行Blast-n比对, 并用MEGA6.0软件[32]做系统演化树进一步分析, 从GenBank中已注册的刺盘孢属选择下载12种真菌菌株的ITS序列和1种非刺盘孢属真菌菌株ITS序列作为外源菌株绘制系统演化树, 结合形态学鉴定结果、 演化树聚集分枝位置及其置信限确定新分离菌株的分类学种名.
2 结果与分析
2.1 病害症状
该病害在莲雾果园发病普遍, 植株中、 下部老叶片受害较重. 发病初期叶片上形成黄色斑纹, 或形成一些浅黄白色、 圆形或椭圆形的小病斑. 典型病斑呈椭圆形或不规则形, 中央区域灰白色, 周围有褐色带、 黄色带晕圈, 中部坏死组织干枯后脱落形成穿孔(图1a,b,c). 在适合的条件下, 叶片上的病斑扩大、 联合形成不规则较大病斑或大面积枯死(图1b,d,e). 发病严重时, 病树可见枯枝和落叶, 生长发育明显受阻, 结果少、 果小或不结果. 病菌在果实成熟期侵染, 果实表面形成不同大小的圆形、 浅褐色至黑褐色病斑, 均匀地轮纹状下陷, 越是病斑中央下陷越深. 病斑周缘为淡灰黄色带, 若遇阴雨天气或空气湿度较高时, 病部果肉腐烂, 可引起大量落果, 病果在运输途中或储藏期间很容易发生腐烂变质.
2.2 菌株的致病性
通过分离纯化, 从普洱市和西双版纳州采集的病样中各得到3个纯化真菌菌株(分别编码为LWTJ 1,2,3和LB4,5,6), 其中分离自普洱市的LWTJ2和来自西双版纳州的LB4基本相同, 它们与刺盘孢属真菌的菌落形态近似. 用LWTJ2和LB4离体接种健康莲雾叶片后症状相似, 48 h后菌饼下叶片组织呈水浸状坏死, 6 d后形成近圆形病斑, 其中央呈灰白色, 周围黑褐色, 褐色坏死部分外围有黄色晕圈, 与田间自然发病叶片上典型病斑相似. 在5片叶(重复)上6个接种点全部发病, 发病率为100%. 接种10 d后, 切取病斑组织10块进行再分离纯化, 均成功分离到与原接种菌株菌落形态相同的纯培养物(图2d). 在相同条件下, 其他4个菌株菌落与刺盘孢属真菌菌落有差异, 接种后未引起莲雾叶片发病, 为污染的杂菌. 因此, 根据柯赫氏证病法则确定LWTJ2和LB4菌株为莲雾炭疽病病原菌.

a. &b. 叶片上的典型病斑; c.& d. 扩展的叶斑或枯斑; e. 室内接种6 d后的叶片病斑.图1 莲雾炭疽病自然和接种发病叶片症状
2.3 病菌的形态特征与鉴定
LWTJ2和LB4两个致病菌株在PDA培养基上的培养特征基本相同. 在25 ℃恒温箱中培养6 d后, 菌落呈圆形, 粉白或鹅黄色, 边缘光滑齐整, 表面呈绒毛状, 气生菌丝发达(图2a); 后期(12 d)菌落颜色稍加深, 中央区域变成灰黑色, 并产生大量蛋黄色分生孢子团(图2b). 在显微镜下观察, 菌丝透明, 分隔, 呈近直角分枝. 分生孢子无色, 呈长椭圆形或柱状, 两端盾圆, 绝大多数细胞中间部位有一个油球, 孢子大小为9.8~18.0(平均13.9±2.1) μm × 4.5~6.0(平均5.5 ±1.0) μm(图2c). 在实验室较长期地培养和多次采集莲雾果园自然发病叶片观察, 均未发现病菌有性时期的子囊壳及子囊孢子. 病菌的这些形态特征, 与Li等[33]描述的暹罗刺盘孢Colletotrichumsiamense非常接近.
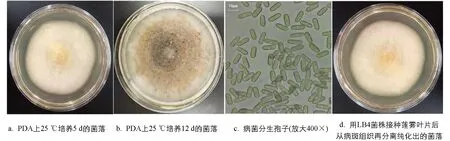
图2 引起莲雾炭疽病菌菌落和分生孢子形态特征
2.4 病菌的分子生物学鉴定
通过PCR扩增获得LWTJ2和LB4两个菌株的基因组rDNA-ITS片段长度均为545 bp, 在NCBI GenBank的登录号分别为OL413460和OL963924. Blast-n分析表明这两个菌株ITS序列的最大相似率为100%, 它们与C.siamenseWZ-365菌株ITS(Acc. No. MN856443)的最大相似率和覆盖率分别为99.08%和99%, 与C.kahawae(卡哈瓦刺盘孢)的覆盖率和最大相似率分别为98%和99.63%(图3a); 用MEGA6.0软件[32]绘制LWTJ2和LB4两个菌株ITS与刺盘孢属12种真菌菌株ITS的系统演化树图(图3b). 图3b显示, 两个菌株与C.siamenseWZ-365菌株的ITS(Acc. No. MN856443)聚集在同一末端分枝上; LWTJ2和LB4为同一种真菌(置信度为100%), 二者与暹罗刺盘孢为同一物种(置信度为96%). 因此, 综合形态特征、 ITS序列Blast-n和演化树分析确定, 引起莲雾炭疽病的病原菌为暹罗刺盘孢(C.siamense).

a. LB4和LWTJ2两个菌株的ITS序列Blast-n对比分析结果, 从NCBI GenBank在线分析结果表截图; b. 基于rDNA-ITS序列的LB4和LWTJ2与近缘真菌菌株的系统演化树, 用MEGA6.0软件绘制, 图3b中显示LWTJ2和LB4(粗体字显示的莲雾炭疽病菌菌株)与暹罗刺盘孢菌株(WZ-365)处于演化树的同一末端分枝上. 相关ITS序列从NCBI GenBank下载而得, 括号内为各菌株ITS序列在NCBI GenBank的登录号.图3 莲雾炭疽病菌的分子鉴定
3 讨论与结论
莲雾是一种被广泛栽培的重要果树, 目前文献记载的莲雾病害有近60种, 其中炭疽病是发生最普遍和危害最严重的一种病害. 莲雾炭疽病是由刺盘孢属Colletotrichum真菌侵染所致, 现已报道的有盘长孢刺盘孢C.gloeosporioides、 果生刺盘孢C.fructicola和莲雾刺盘C.syzygicola[16-18]. 本研究通过形态学和分子生物学鉴定方法确定, 发生在我国云南南部地区的莲雾炭疽病由暹罗刺盘孢C.siamense引起, 这与其他国家和地区报道的刺盘孢种类不同, 属于莲雾炭疽病的一种新病原真菌.
暹罗刺盘孢异名有C.melancaulon,C.dianesei,C.communis,C.endomangiferae,C.hymencallidis及C.jasmini-sambac, 这些异名来源于不同地区的寄主植物[34-38], 均为该真菌的无性型(Anamotph), 在早期的分类系统中属于真菌界, 半知菌门, 腔孢纲, 黑盘菌目, 黑盘孢科, 刺盘孢属. 其有性型(Teleomorph)文献尚无报道, 本研究在室内较长时间反复培养及自然发病果树上多次观察寻找均未发现子囊壳和子囊孢子, 说明该真菌可能很难产生有性型. 但依据Sutton[39]文献记载, 刺盘孢属中很多种类的有性型均属于小丛赤壳属Glomerella, 由此推论暹罗刺盘孢的有性型应该是暹罗小丛壳Glomerellasiamense, 在较新的分类系统中属于真核域、 真菌界, 双核菌亚界, 子囊菌门, 子囊菌纲, 小丛赤壳目, 小丛赤壳科, 小丛赤壳属. 此推论将对今后研究或探索暹罗刺盘孢生活史中的有性型阶段和病害循环等具有重要参考作用.
暹罗刺盘孢是一种寄主范围很广的植物病原真菌, 现有文献记载约有60多种炭疽病是由暹罗刺盘孢侵染所致, 国外报道的有菠萝蜜、 枇杷、 无花果、 薄荷、 胡椒、 迷迭香、 草莓、 辣椒、 柑桔、 火龙果、 芦荟、 柿子和美国山核桃等作物的炭疽病[40-45]; 我国发生的有柑橘、 苹果、 核桃、 番木瓜、 荔枝、 胡椒、 假苹婆、 白兰花、 鳄梨和越南槐等[46-52]. 本研究鉴定的莲雾炭疽病也由暹罗刺盘孢所致, 表明莲雾是暹罗刺盘孢的一个新寄主, 在其他莲雾种植国家和地区未曾见报道.
据课题组2021年的调查结果, 莲雾炭疽病在云南省普洱市和西双版纳州各地果园发生普遍, 危害较重, 明显降低了莲雾果实产量、 品质及果农的经济效益. 本研究较详细地观察描述了莲雾炭疽病的症状及其病原的形态特征, 鉴定确认了病原菌为暹罗刺盘孢, 不仅对该病害田间诊断识别、 监测和防控有重要的实用参考价值, 而且丰富了莲雾炭疽病病原菌的多样性. 然而, 不同植物炭疽病寄主、 病原菌及其发生环境条件各有不同, 它们的流行规律必然存在较大差异, 因此对它们的防控技术措施也会有所不同. 为了减轻或避免莲雾危害和经济损失, 促进产业发展, 对于莲雾炭疽病流行规律、 病原菌生物学特性及其综合防控技术等方面仍有待进一步研究.
本研究较详细地观察记载了滇南地区莲雾炭疽病症状及其病原菌形态特征, 根据形态学与rDNA-ITS序列的Blast-n对比和演化树分析鉴定获得的LWTJ2和LB4两个菌株均属于暹罗刺盘孢C.siamense, 这是莲雾炭疽病的一种新病原真菌. 研究结果进一步证明了莲雾炭疽病病原菌的多样性, 也为该病害的诊断监测和有效控制提供了科学依据.

