胸骨孤立性浆细胞瘤1例并文献复习
周攀,程玲玲,苏丽,朱杰,吴中权,舒圣,张宇霄
作者单位:武汉科技大学附属汉阳医院胸外科,湖北 武汉430050
孤立性浆细胞瘤(SP)系浆细胞源性肿瘤,临床较为罕见。SP主要包括孤立性骨浆细胞瘤(SPB)以及髓外浆细胞瘤(EMP)[1]。SPB 是源于骨骼的、单个孤立的浆细胞瘤,约占全部恶性浆细胞瘤的3%[2]。胸骨SP是一类少见疾病,有较高风险进展为多发性骨髓瘤(MM),且存在较高的误诊率。故本研究对该例胸骨SP进行报道。
1 资料与方法
1.1 一般资料男,63 岁,因发现前胸部肿物2 月,进行增大伴疼痛1 月,于2020 年9 月4 日入院。查体:胸骨体部可触及大小约10 cm×12 cm 肿物(见图1),明显隆起,质硬,活动度差,与周围组织界限清楚,无波动感,局部皮温不高,表面无红肿与破溃,压痛阳性,浅表淋巴结未触及肿大。心肺查体未见明显阳性体征。入院时血常规、肝肾功能、肿瘤标志物、结核抗体、尿本周蛋白检查呈阴性。血沉45 mm∕h。心电图、腹部彩超、心脏彩超正常。胸部CT+三维重建示胸骨体可见肿块影,较大层面约为5.2 cm×6.0 cm×9.0 cm,呈膨胀性增长,并伴有骨质破坏,边缘较清,周围软组织未见异常改变(见图2)。全身常规X线摄片检查未见其他病灶。以上检查均经过病人知情同意。
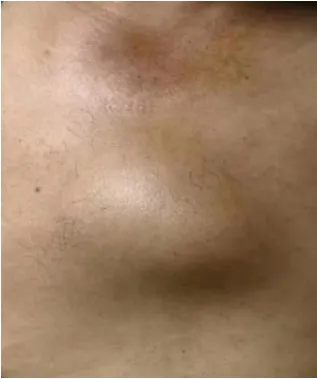
图1 前胸壁肿物(术后病理确诊为胸骨孤立浆细胞瘤)外观
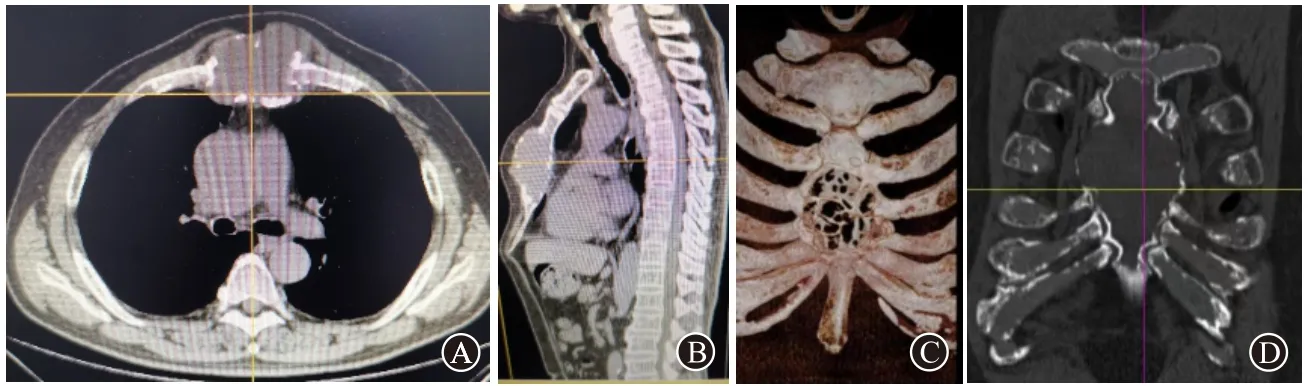
图2 胸骨孤立浆细胞瘤的胸部CT影像:A为纵隔窗前面观;B为纵隔窗侧面观;C为瘤体的胸部CT影像三维重建;D为纵隔窗上面观
1.2 方法病人于2020 年9 月20 日在气管插管全麻下行“胸骨肿瘤切除[3,7]+胸壁缺损修复术[4-7]”。采用胸骨正中切口,探查见肿瘤位于胸骨体处,质硬,骨膜血供异常丰富,囊性,包膜尚完整,胸骨骨皮质易碎且略硬,察看骨髓腔,其中可见膨胀性软组织肿块,侵及双侧部分肋骨。切除范围包括胸骨体、双侧第2~6 肋软骨。胸壁缺损约25 cm×15 cm,植入3D 打印胸骨重建钛板固定(见图3)。此病人术后胸壁缺损范围大,对修补材料强度、耐久度和可塑性等要求高,故重建时选择使用钛合金板[8-9]。
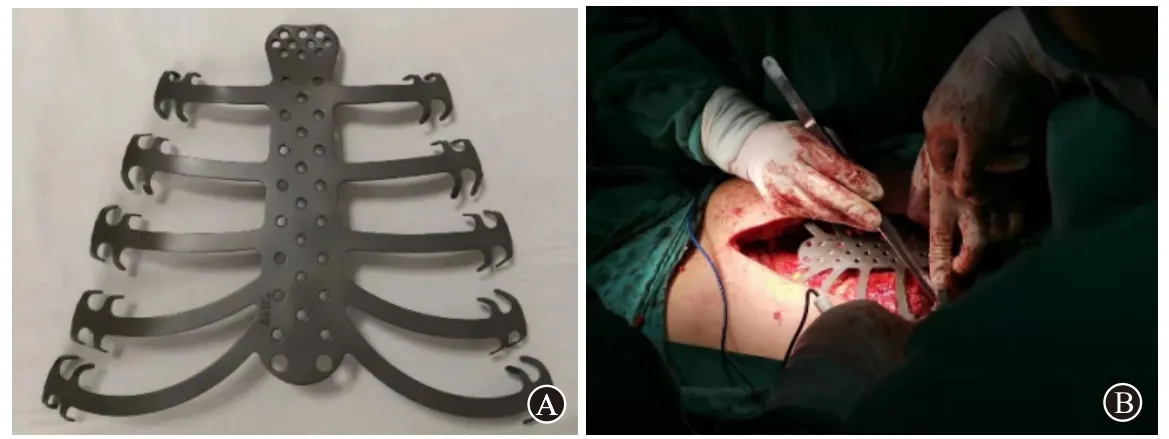
图3 胸骨肿瘤切除术+胸壁缺损修复术术中植入3D打印胸骨重建钛板固定:A为3D打印胸骨重建钛板;B为术中胸骨肿瘤切除+胸壁缺损修复,植入3D打印胸骨重建钛板固定
1.3 病理
1.3.1肉眼观 大小13 cm×13 cm×6 cm,灰褐色不整形组织,中间见胸骨,两边各带5 根肋骨残端,沿胸骨中线锯开,切面见9×6 cm,界限较清,质软肿块,灰白黏冻样物为主,部分区域灰褐(见图4)。
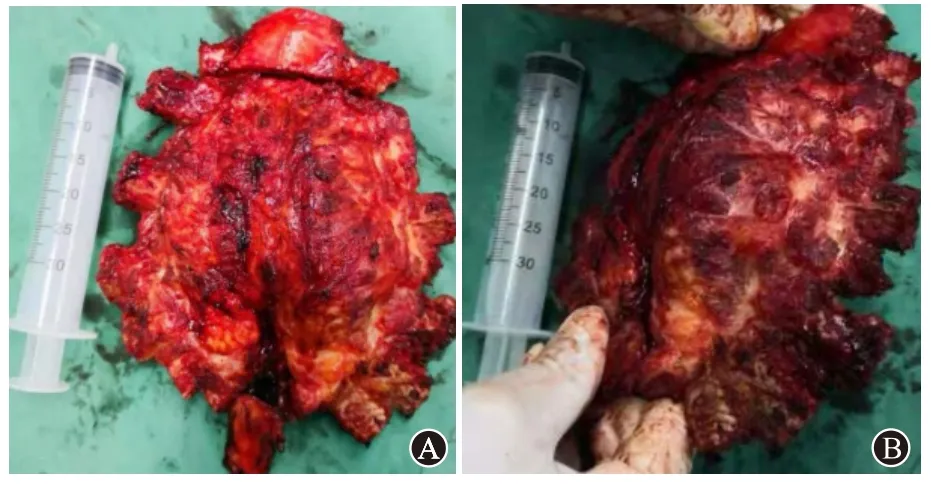
图4 前胸壁肿物(术后病理确诊为胸骨孤立浆细胞瘤)手术切除标本:大小约6 cm×10 cm×12 cm,质硬,胸骨骨皮质已受侵,其质脆易碎,骨膜血供丰富,其骨髓腔内存在膨胀性软组织肿块;A为手术切除标本正面观;B为手术切除标本侧面观
1.3.2镜检 镜下见肿瘤组织中存在大量小圆细胞,细胞均匀,大小一致,成分单一,细胞核偏位,胞质红染,核染色深,少量细胞核染色质呈车辐样排列,细胞异型性不明显,核分裂象少见(见图5)。
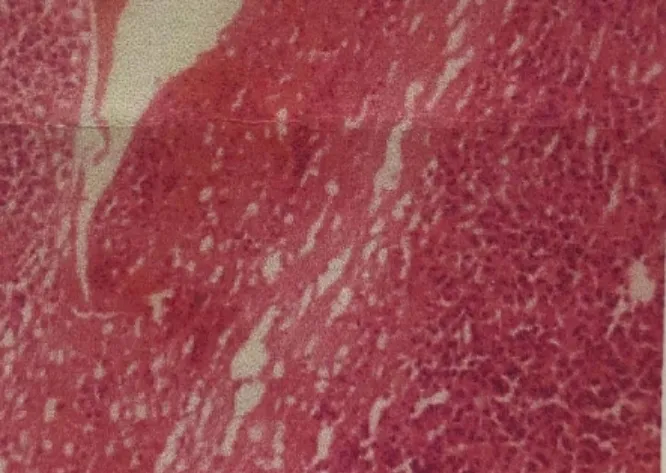
图5 胸骨浆细胞瘤的细胞学形态特征(HE染色×50)
1.3.3免疫表型 B 淋巴细胞分化抗原20(CD20)(-),B 淋巴细胞分化抗原79a(CD79α)(+),浆细胞分化抗原38(CD38)(+),多聚体蛋白多糖I(CD138)(+),淋巴细胞特异性转录因子(Mum-1)(-),神经细胞黏附分子(CD56)(-),B 细胞特异性激活蛋白(PAX5)(-),T 细胞分化抗原3(CD3)(-),原癌基因(C-myc)(-),细胞增殖指数(Ki67Li):>20%。
1.3.4病理诊断 胸骨SP。灶性区域突破骨皮质微侵犯骨膜。肿块最长径9 cm,两侧肋骨未见明显侵犯。
2 结果
术后再查免疫球蛋白均在正常范围。骨髓细胞学:浆细胞比值占3.2%。临床诊断为胸骨SP。术后出现肺部感染,经调整抗菌药物、加用激素、多次床边纤支镜吸痰,加强胸部物理治疗、肺功能训练,顺利康复出院(术后影像见图6)。因个人原因,术后未行放化疗。术后随访至2021 年10 月,胸部CT(图7)发现左侧第9 肋骨骨质破坏,周围软组织肿块,因病人拒绝进一步骨髓细胞学等检查,未能进一步确诊,但仍积极考虑进展为多发性骨髓瘤可能。
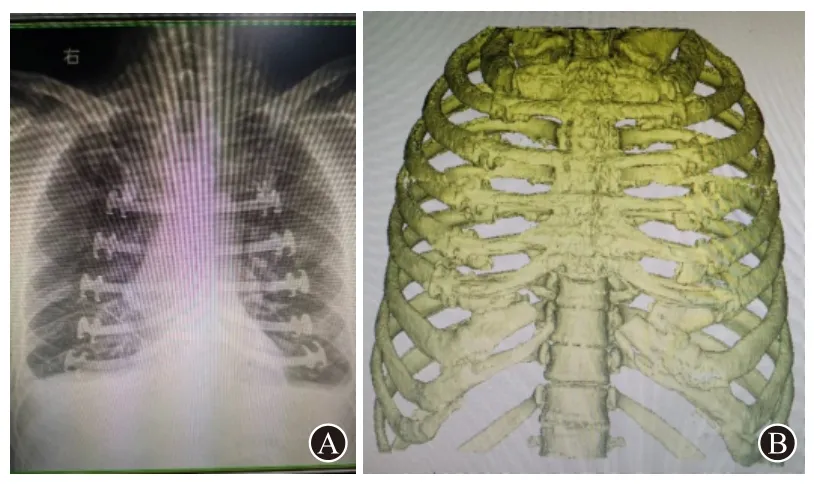
图6 前胸壁肿物(术后病理确诊为胸骨孤立浆细胞瘤):A为术后第2天胸片;B为术后2个月胸部CT
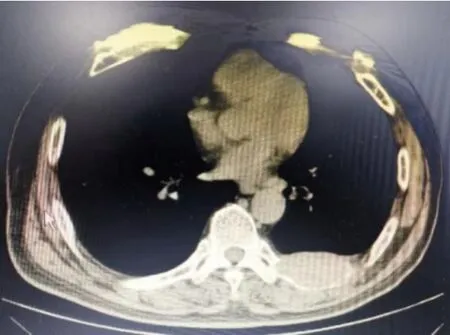
图7 前胸壁肿物(术后病理确诊为胸骨孤立浆细胞瘤)手术1年后的2021年10月复查胸部CT影像
3 讨论
3.1 流行病学孤立性骨浆细胞瘤少见。Dimoplouls等[10]总结了276例病例发现,发病年龄范围多为50~60 岁,平均55 岁,男女比例2∶1,脊柱的SP 发生率高达72%,而胸骨SP 发生率极低。Dotes 等[11]研究发现,男女发病比为2∶1,其发病率由低到高为:太平洋地区及亚洲人种、白色人种、黑色人种。我国对SPB的流行病学研究少,据现有资料来看,我国SPB 的发病年龄与欧美国家大致相当。罗雯、黄韵红[12]分析了12例SPB病例,12例病人中位年龄为52.5 岁,男女比为1∶1,其中单发于脊柱的占比50%,无一例发病于胸骨。康娅等[13]分析了11 例SPB 病人,男女比为2.7∶1.0,中位年龄53 岁,胸骨发病为18.2%,脊柱单发为54.5%。而该病例男性,年龄63岁,发病于胸骨,符合流行病学特点。
3.2 病因与发病机制胸骨SP 病因目前尚不明确。病毒感染、遗传因素、慢性抗原刺激、辐射及长期接触某些化学产品等均不能肯定是否与其有关。但目前认为SPB 与MM 具有相似的发病机制[14]。该病人未发现明确病因。
3.3 临床表现起病比较隐匿,以胸骨局部骨痛和(或)伴有局部肿块为主要临床表现,同时可伴有体虚、消瘦或贫血等,持续时间较长,从数月到数年不等,往往容易被忽视。该病例有局部肿块,呈渐进性增大,并伴有骨痛,符合胸骨SP的临床表现。
3.4 实验室检查实验室检查一般无异常,如血尿常规、血沉、电解质以及肝肾功能等均正常。约有半数病人的血和(或)尿中可检测到M 成分,阳性率为24%~72%,但含量远低于多发性骨髓瘤,而且除了M 成分外,其他类型的免疫球蛋白均在正常范围。对怀疑浆细胞瘤的病人应常规行血清和尿的免疫电泳和免疫固定电泳。
血清乳酸脱氢酶和β2 微球蛋白水平一般均在正常范围,这也说明骨孤立浆细胞瘤的荷瘤量明显低于多发性骨髓瘤。骨髓穿刺细胞学:多次多部位骨髓穿刺均为正常骨髓象,浆细胞数少于5%。骨髓活检正常。该病例各项实验室检查均阴性,术后骨髓细胞学检查亦符合胸骨SP表现。
3.5 病理特点组织病理学及免疫组织化学是诊断SPB的金标准[15]。组织病理活检符合浆细胞瘤形态特征;骨髓穿刺细胞学骨髓像正常,浆细胞比例<5%。国内外多位学者[13,15-18]分析SPB 的病理特点,显示CD79α、CD38、CD138 的免疫组织化学染色具有较高特异性。该病例符合胸骨SP 的病理学及免疫组织学特点。
3.6 影像特点胸骨SP 的X 线表现为边界欠清晰,局部呈程度不同溶骨性骨质破坏,周围存在部分增生硬化,骨膜反应不可见,周围骨皮质呈穿凿样虫或噬样,不光整、变薄[19-21]。但其不能发现早期病变。CT 和磁共振成像(MRI)检查可以更加清晰第显示病损范围和性质以及周围软组织情况,是胸骨SPB 的重要检查手段。CT 表现为骨质膨胀,骨质的破坏区完全被软组织肿块所代替,骨质膨胀,边界清晰,常突破骨皮质并在附近形成软组织肿块影[21-22]。MRI 示T1WI 呈稍低信号,T2WI 呈稍高信号,增强后病灶呈明显均匀强化[1,19,23]。该病例胸部CT及重建提示胸骨肿块呈膨胀性生长,并伴有骨质破坏,边缘较清,周围软组织未见异常改变;符合胸骨SP的影像学表现。
3.7 诊断胸骨SP 目前并无统一的诊断标准。其诊断金标准为临床病理诊断,其内容主要有穿刺活检、免疫组化检查、肿瘤切取活检及术后病理标本伊红(HE)染色。目前多采用的诊断标准[10,24-27]如下:①穿刺活检存在克隆性浆细胞增生导致的局部骨骼损害;②骨髓活检及骨髓细胞形态学诊断无异常(浆细胞<5%);③影像学诊断无其他部位病变;④没有浆细胞病变引发肾脏损害、高血钙或贫血;⑤尿液或血清检查可见M 蛋白水平低下或缺乏。本病例基本符合该诊断标准。
本病起病隐袭,病程较长,无特征性临床症状和体征,容易造成误诊或漏诊。对于长期骨痛并伴有肿块,X 线或CT 表现有单一部位的溶骨性改变,血清单克隆免疫球蛋白升高不明显者应高度怀疑本病。组织病理活检证实为浆细胞瘤及影像学表现为单一部位溶骨性损害是确诊本病的关键。
多数病人因病变处疼痛及肿块来院就诊,早期若无病理诊断,极容易误诊。由于该病少见,我科对该病相关认识不足,未能完善肿瘤穿刺活检、骨髓穿刺活检等,除外多发骨髓瘤或其他,术前明确诊断不足,所幸该病人术后病理确定为胸骨SP。因此,若病人存在胸骨肿块且存在疼痛者,胸外科医生需考虑病人存在胸骨SP的可能。
3.8 鉴别诊断与之需要鉴别的疾病是:①MM:骨痛和骨骼病变是本病特征之一;表现为多灶性病变,可同时存在贫血、高钙血症和肾功能受损;骨髓中浆细胞>0.15%,并有形态异常的浆细胞出现,或组织活检证实为骨髓瘤;血清中出现大量M 蛋白或尿中本周蛋白>1.0 g∕24 h,少数病例出现双克隆或三克隆性免疫球蛋白;除外其他原因的溶骨性病变和(或)广泛性骨质疏松。两者通过全身影像学检查和血、尿生化检查以及骨髓活检较易鉴别[17]。②骨转移瘤:可见原发病灶体征及症状,存在显著溶骨性骨质破坏,且周边无硬化,边界不明显,周围软组织存在较为明显肿块[19]。肿瘤病理活检可资鉴别。③其他浆细胞疾病:如意义未明单克隆免疫球蛋白症(MGUS)、髓外浆细胞瘤等,这些疾病都伴有单克隆免疫球蛋白增多,但都具有各自的临床特征,且无骨质破坏。
3.9 治疗与预后骨SP 是一种对放射治疗相当敏感的恶性肿瘤,因此多数学者认为放疗是主要的治疗手段[28-30]。2022 年3 版美国国立综合癌症网络(NCCN)指南推荐放疗剂量[40~50 Gy,1.8~2.0 Gy∕次(总计20~25次)]。化疗目前存在争议,原则上不采用化疗,但有学者研究发现,化疗联合放疗可改善疾病无进展生存及进展为MM 的时间[31]。Dagan等[32]的研究表明,放疗局部控制率可达80%以上,且长期的无瘤生存率达35%。康娅等[13]的研究认为,骨SP多行手术+放疗,化疗为辅;若疾病进展快,肿瘤直径大,化疗也可延长生命,但临床仍推荐行手术+放疗。亦有研究认为,对于SPB 的治疗主要以手术、放射治疗为主。
罗雯、黄韵红[12]对12 例SPB 病人研究发现,经手术+放疗治疗后达完全缓解(CR)7 例,部分缓解(PR)4 例,总有效率为92%,有其较好的近期疗效,而病人1、3、5 年OS 率为67%、25%、17%。文献[33-34]报道SPB 的2 年总生存期(OS)率为87.5%,5年及10年OS率分别为78%和54%。而张翠翠等[35]研究发现手术后进行放疗,可以改善总生存期,提高生活质量。本病可发展为MM,一般在3~5 年内发生,但部分病人可迟至10 余年,甚至20 余年后。有研究认为,SPB 部分可转化为MM。武太勇等[1]认为,符合病人实际的治疗方案不但能够缓解病人痛苦、抑制疾病进展,对于延长病人生命也具有重要价值。若治疗不当会进展为MM,影响病人生存[36]。研究认为骨SP 生存预测最重要因素是之后MM 的发展。
本例病人术后疼痛缓解,提示病灶切除后症状明显缓解。但由于其术后放弃放化疗等,手术1 年后,2021 年10 月复查胸部CT 发现左侧第9 肋骨骨质破坏,周围见软组织团块,考虑进展为MM可能。
由于胸骨属胸廓重要组成部分,胸骨巨大肿瘤切除后,必然影响病人的呼吸功能及胸廓稳定性,切除后胸壁缺损重建显得尤为重要。胸骨切除重建术后恢复期,因胸壁软化,而出现反常呼吸,影响呼吸功能。而该病例术后出现了肺部感染。因此,术前督促病人进行胸腹式呼吸功能训练,术后密切关注病人胸廓形态及生命体征,纠正低氧血症,开展肺康复护理,以减少术后并发症,促进病人康复[37]。
由于胸骨的孤立SP 病例少,缺乏大宗资料总结,故尽早明确诊断是关键。胸骨孤立SP的确诊有赖于对影像学、实验室、病理等检查结果及临床表现进行综合分析。目前临床治疗方案不统一,但仍应积极手术治疗,手术结合适当的放疗是其治疗的最佳手段,同时可辅以化疗。另外,该类病人需长期随访,积极进行检查,以排除MM。
(本文图1~7见插图6-7)

