鼻咽部节细胞胶质瘤1例报告及文献复习
王茂鑫,张清怡,徐珊珊,马贤,王彬,王运帷
(1.中国人民解放军第940医院 耳鼻咽喉科,甘肃 兰州 730050;2.空军军医大学第一附属医院 烧伤与皮肤外科,陕西 西安 710032;3.空军军医大学基础医学院,陕西 西安 710032)
节细胞胶质瘤多发生于颅内,中国人民解放军第940医院收治1例节细胞胶质瘤发生于鼻咽部且临床症状不明显患者,实属罕见。本文回顾性分析该患者的临床表现、组织病理学、影像学特点、鉴别诊断及治疗,结合相关文献复习总结。
1 临床资料
患者,男,3岁5个月余。因咽部肿物3个月余家人携领前来就诊。入院前3个月家属无意间发现患儿咽部蚕豆大小灰白色肿物,无咽痛、发热、无吞咽障碍及呼吸困难等症状,未及时就诊。此后发现患儿肿物逐渐增大,亦无发热、吞咽障碍及咳嗽、咯血等不适。患者既往无脑部特殊病史,家族成员无类似疾病。体格检查发育正常。门诊电子喉镜提示:鼻咽右侧与口咽侧壁交界处可见灰白色肿物,基底部无法窥清(图1)。鼻咽部CT显示:颅底骨质完整无缺损和骨畸形,鼻咽右侧壁及右侧扁桃体交界区见大小约0.9 cm×0.7 cm的软组织密度结节影,突入咽腔内(图2);其他常规检查及检验未见明显异常。拟诊:鼻咽部肿物、血管瘤?在全麻下行手术治疗,术中置开口器见肿瘤位于口咽、鼻咽交界处,右侧咽鼓管咽口旁灰白色带蒂新生物,质硬,表面光滑,呈游离状态,大小约1.5 cm×1.5 cm,使用直角钳夹住新生物远端,用等离子刀将肿物蒂部完整切除,彻底止血,术中出血量约5 mL。切开基质见肿物呈灰红色,质韧。术后病理:鼻咽部形态学改变结合免疫组化结果,符合节细胞胶质瘤(图3)。EnVision法免疫组织化学:CD56(+++)、GFAP(+++)、Ki67>2%、Nestin(++)、 NeuN大细胞(+)、S100(+++)。见图4。术后5 d观察患者无咽部出血及吞咽障碍后出院。术后14 d复查电子喉镜:鼻咽右侧壁及口咽右侧壁创面假膜脱落,表面光滑,无肿物生长。术后1年复查电子喉镜:鼻咽部黏膜光滑,未见肿物复发(图5),术后5年MRI随访,鼻咽部周围组织结构清晰,未见明显肿物残留(图6)。
2 讨论
2.1 概述
先天性鼻肿瘤发病率为1∶(20 000~40 000)[1],节细胞胶质瘤占中枢神经系统肿瘤的0.3%~3.8%[2],异位生长在鼻咽部的节细胞胶质瘤更为少见。节细胞胶质瘤无家族遗传性,多在20岁以前确诊,男女比例为(1.1~1.9)∶1[3-4]。小儿鼻咽部新生物堵塞鼻咽部,可引起呼吸不畅、进食呛咳等上呼吸道梗阻症状[5]。节细胞胶质瘤是一种罕见的先天畸形,可能是出生时残留的原始外胚层细胞异位分化为神经细胞胶质瘤,而并非真正的肿瘤。此病变常为良性,不呈浸润性生长,但可形成肿块压迫周围组织。
2.2 影像学
鼻咽部节细胞胶质瘤的影像学检查有助于确定肿块大小、范围、形态以及与颅内的联系,鼻咽部CT、MRI可发现鼻腔内的软组织肿块,判断有无颅内肿块及颅底的骨组织缺失。CT常提示鼻咽部内有软组织病灶,密度均匀,无骨质破坏。MRI 提示肿块与脑实质密度相等,在T1加权呈低信号,肿块因胶质化在T2加权呈高信号[6],强化后信号不均匀,周围组织间隙无侵犯,脑实质内无明显异常信号[7]。临床可将MRI作为婴幼儿首选检查,结合患者临床表现及扩散加权成像信号、强化情况、弥散系数值等信息为临床诊治提供指导[6,8]。
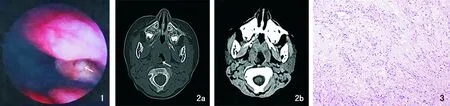

图1 术前电子喉镜检查基底部无法窥清(箭头所示) 图2 术前鼻咽部CT 2a:软组织窗示鼻咽右侧壁及右侧扁桃体交界区软组织突入咽腔内(箭头所示); 2b:骨窗示颅底骨质完整无缺失与骨畸形 图3 组织病理检查提示节细胞胶质瘤 (HE ×100) 图4 免疫组织化学检查(EnVision ×200) 4a: CD56 (+++); 4b: GFAP(+++); 4c: Ki67 (>2%); 4d: Nestin (++); 4e: NeuN大细胞(+); 4f:S100 (+++) 图5 术后1年电子喉镜检查 图6 术后5年MRI复查
2.3 组织病理学及免疫组织化学特点
鼻咽部节细胞胶质瘤组织病理特征为混合性神经元和胶质细胞成分,无脉络组织成分,并表现出明显的异质性[1, 5]。免疫组化是确诊该疾病的关键,本病例免疫组化结果与文献报道相符,其中Syn和 NeuN有助于对胶质瘤中神经节细胞成分的判定[9];Nestin、GFAP 与S100有助于瘤中胶质成分的判断[1-2],其中Nestin的低表达提示预后良好[10]。CD56是神经细胞黏附分子,在胶质细胞膜上大量存在,表达量增加提示肿瘤侵袭性减弱,可以作为节细胞胶质瘤组织病理学评估、预后判定的辅助指标[11]。Ki67是一种细胞周期相关蛋白,可标记细胞周期中除G0期以外的细胞,阳性率越低,说明处于增殖期的细胞越少,肿瘤生长越慢,复发可能性越小[12]。
3 鉴别诊断
临床上鼻咽部节细胞胶质瘤表现与先天性鼻脑膜脑膨出相似,鼻脑膜脑膨出即是脑膜内脑疝,通过颅骨的缺损区与颅内神经系统和蛛网膜下腔有沟通。临床表现为鼻持续或间断流清水,反复发作脑膜炎及鼻塞等。鼻咽部CT提示颅骨缺损及肿物含脑脊液或脑组织为确诊鼻脑膜脑膨出的关键[13],MRI可见肿物与蛛网膜下腔相通,有完整包膜,可有同脉搏或呼吸的搏动[14]。颅内压增加时,脑膜脑膨出会因颅内扩张而扩大,节细胞胶质瘤则不会[6]。脑膜脑膨出的组织病理学检查可见肿物由脑膜组织与脑组织共同组成,易与节细胞胶质瘤区分。
4 治疗及预后
手术彻底切除是节细胞胶质瘤的首选治疗方法,早期手术可避免肿块压迫导致的鼻中隔变形、吞咽困难、呼吸道阻塞和反复感染等不良症状。鼻咽肿瘤常使用微创内镜手术切除[15-16],具有视野好、创伤小等优点,在避免了鼻面部切口的同时降低了术后并发症的发生,较传统术式显示出明显的优势,对于大范围的病变可联合鼻内镜图像引导技术进行治疗[5, 16],复杂部位病变的治疗则可以在实时影像导航的辅助下开展[17]。小儿鼻咽部新生物可采用低温等离子射频消融术治疗,具有简便、安全、微创的优点[16]。对于可能存在的鼻外肿物常采用鼻外切除术,为了达到美观的目的,手术可沿着鼻轮廓进行切口,瘢痕处形成的投射阴影可模拟正常的鼻影,具有良好的隐藏效果[18],鼻外手术如有大块皮损可通过移植全厚皮片或者额部皮瓣进行修复以减少瘢痕形成[4-5]。
有学者研究表明,节细胞胶质瘤单纯手术治疗与手术联合放/化疗的患者,其预后的差异无统计学意义[19]。患者一般预后良好,5年内的复发率低于3%[20]。瘤体与皮肤粘连者不易切净,切除不完整可复发,需要定期随访,如有复发应及时加以放疗等辅助治疗[21]。
随着基因测序的发展,现研究发现节细胞胶质瘤的发生常伴随有BRAFV600E基因突变,肿瘤的高复发率与MGMT基因高表达密切相关[22-23]。对基因和分子层面的研究有望明确该疾病的发病机制,从根源上阻止其发生发展。本文仅1例报道,有必要进一步积累临床资料,为此类肿瘤患者提供更合理的治疗方法。

