血流感染金黄色葡萄球菌毒力基因、agr分型及生物膜形成能力调查*
贾佳,纪玥玥,高硕,张燕,周万青,沈瀚
(南京大学医学院附属鼓楼医院检验科,南京210000)
金黄色葡萄球菌是一种定植于人类上呼吸道的机会致病菌,可引起脓毒血症、心内膜炎等[1]。耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)定植或携带会增加感染的风险,是人群间传播的一个重要来源,并可造成院内流行性传播[2]。金黄色葡萄球菌血流感染的致病性与其可产生多种毒力因子、受到辅助基因调控因子(accessory gene regulator,agr)系统的调节等密切相关[3]。金黄色葡萄球菌的毒力基因包括表面相关因子、溶血素、酶、超抗原毒素等[4]。各毒力因子具有不同的致病机制,不同的毒力因素组合可形成菌株不同的流行病学特征[1]。agr系统是最常见且研究最多的毒力调节系统,基于agr基因可变区的多态性可分为4个组别(agrⅠ~Ⅳ),不同agr型别对金黄色葡萄球菌毒力因子表达及感染严重程度具有一定的影响[1,5]。此外,金黄色葡萄球菌可以在各种医疗设备、组织表面形成生物膜,导致细菌抵抗吞噬细胞的杀伤和抗菌药物渗透,从而造成疾病的持久性和难治性[6]。本研究旨在分析临床血液来源金黄色葡萄球菌的耐药性、毒力基因谱、agr分布、生物膜形成能力特征,并比较MRSA菌株与上述因素的关系,从而为临床治疗和医院感染防控提供一定的理论依据。
1 材料与方法
1.1菌株来源 收集2019年1月—2020年12月南京鼓楼医院临床患者血液培养连续分离的非重复金黄色葡萄球菌102株。所有菌株采用Vitek MS质谱鉴定系统进行菌种鉴定,采用Vitek 2 Compact及配套GP67卡进行药物敏感性检测。金黄色葡萄球菌ATCC 29213、粪肠球菌ATCC 29212为药敏试验质控菌株;表皮葡萄球菌ATCC 35984和ATCC 12228分别为生物膜形成阳性和阴性对照菌株,上述菌株均为本实验室保存菌株。
1.2主要试剂和仪器 胰酪大豆胨琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB)(青岛海博生物公司);2×Taq Master Mix(近岸蛋白质科技有限公司);琼脂粉AGAROSE G-10(西班牙BIOWEST公司);GoldView DNA(北京索莱宝科技公司);引物由上海生工生物公司合成。Vitek 2 Compact全自动细菌鉴定仪、Vitek MS(法国生物梅里埃公司);T00型PCR扩增仪、凝胶电泳仪(美国Bio-Rad公司);2500型凝胶成像系统(上海Tanon公司);MB-580酶标仪(深圳市汇松科技公司)。
1.3菌株复苏及核酸提取 常规复苏菌株接种于血平板,置35 ℃、5% CO2培养24 h。挑单克隆菌落于200 μL无菌生理盐水中,100 ℃加热10 min,冰上静置5 min,3个循环后,12 000 r/min离心5 min,取上清液作为DNA模板,-20 ℃冻存备用。
1.4生物膜表型分析 参照O′Toole[7]报道进行生物膜形成试验。挑取菌落转种于TSA培养基,35 ℃、5% CO2培养24 h。挑取菌落至1 mL生理盐水并调节菌液浊度为3麦氏浊度单位,吸取10 μL上述菌液至1 mL TSB培养基中,混匀后,每孔200 μL加入96孔板中。每个菌株设3个重复孔。96孔板置35 ℃培养24 h,弃上清液,PBS洗3遍后,每孔加入200 μL 5 g/L结晶紫水溶液并静置15 min。PBS洗3遍,拍干。每孔加入200 μL无水乙醇,室温20 min,使用酶标仪在570 nm处测量每孔吸光度(A)值。表皮葡萄球菌ATCC 35984和ATCC 12228分别作为生物膜形成阳性和阴性对照,TSB为空白对照。判断标准:以阴性对照平均A值的3个标准差为cut-off值(Ac)。根据Ac和待测菌株平均A值分为4类:强生物膜(A>4Ac);中等生物膜(A>2Ac,A≤4Ac);弱生物膜(A>Ac,A≤2Ac);无生物膜(A≤Ac)。
1.5agr基因多态性分析 参照文献[8],采用多重PCR检测agr基因多态性。agr基因分型扩增引物见表1。多重PCR反应体系为20 μL,包括10 μmol/L上、下游引物各1 μL,2×Taq Master Mix 10 μL,DNA模板1 μL,DEPC水4 μL。多重PCR反应条件:95 ℃ 5 min;94 ℃ 1 min,45 ℃ 1 min,72 ℃ 1 min,5个循环;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 5 min。PCR产物经15 g/L琼脂糖凝胶电泳,用GoldView DNA染色后观察。
1.6毒力基因检测 参考文献[9],采用PCR检测金黄色葡萄球菌葡萄黄质蛋白基因(crtN)、溶血素基因(hla、hlb和hld)、CP8合成酶基因(cap8H)、中毒性休克综合征毒素-1基因(tst),引物信息见表2。PCR反应体系为20 μL,包括10 μmol/L上、下游引物各1 μL,2×Taq Master Mix 10 μL,DNA 1 μL,DEPC水7 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,在不同温度下退火1 min,72 ℃ 1 min,35个循环;72 ℃ 5 min。PCR产物经15 g/L琼脂糖凝胶电泳,用GoldView DNA染色观察。

表1 agr分型多重PCR反应引物和产物长度

表2 毒力基因引物序列、退火温度和扩增产物长度
1.7统计学分析 使用GraphPad 8.0软件进行数据统计,计数资料以百分率表示,组间比较采用卡方检验或Fisher精确概率法进行统计分析,P<0.05为差异有统计学意义。分离菌株药敏数据采用Whonet 5.6软件进行统计。
2 结果
2.1药敏结果 102株金黄色葡萄球菌中苯唑西林耐药43株(占42.2%),敏感59株(占57.8%)。所有菌株对万古霉素、利奈唑胺和替加环素均敏感;对利福平、甲氧苄氨嘧啶-磺胺甲噁唑和庆大霉素耐药率低,分别为1.0%、2.0%和4.9%;对克林霉素、环丙沙星、四环素、莫西沙星和左氧氟沙星耐药率中等,分别为19.6%、28.4%、28.6%、30.4%和33.3%;大部分菌株对青霉素和红霉素耐药,分别为96.1%和53.9%。
2.2毒力基因表达情况 102株菌株中101株(占99.0%)至少携带6个毒力基因中的1种。各基因检出率如下:crtN为99.0%,溶血素基因hla、hlb和hld分别为97.1%、98.0%和96.1%,表面因子基因cap8H为34.3%,tst为21.6%。其中,以同时携带crtN、hla、hlb、hld4种毒力基因的组合最多。见表3。

表3 102株金黄色葡萄球菌毒力基因携带情况
2.3agr基因多态性及不同agr分型菌株耐药性和毒力基因携带情况 102株分离株中99株(占97.1%)agr位点阳性,其中58株检测为agrⅠ型(占56.9%),37株检测为agrⅡ型(占36.3%),5株检测为agrⅢ型(占4.9%),未检测到agrⅣ型,另有3株未获分型。
比较不同agr分型菌株间抗菌药物耐药性和毒力基因携带情况发现,agrⅡ型分离株对红霉素、四环素、左氧氟沙星、苯唑西林、环丙沙星、莫西沙星的耐药性较agrⅠ型强,差异有统计学意义(P<0.05)。agrⅡ型分离株tst基因携带率显著高于agrⅠ型分离株,差异有统计学意义(8.8% vs 40.5%,χ2=13.519,P<0.001)。agrⅡ型分离株cap8H基因携带率低于agrⅠ型分离株,差异无统计学意义(38.6% vs 21.6%,χ2=2.975,P=0.085)。crtN和溶血素基因在两组之间普遍分布。见表4。
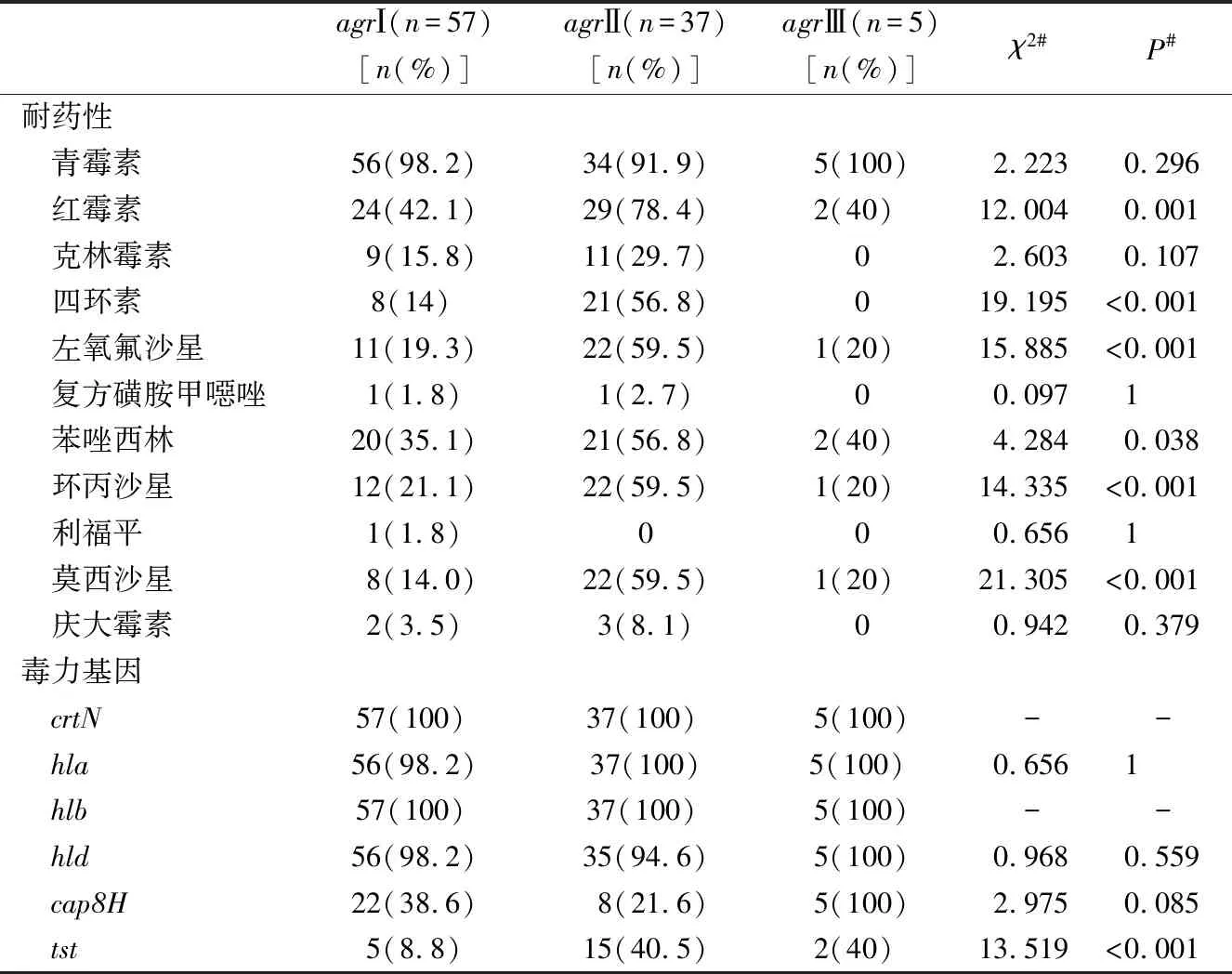
表4 agr不同分型菌株毒力基因和抗菌药物耐药性分布
2.4生物膜形成能力 102株分离株中28株生物膜形成阳性,其中12株为强生物膜,16株为非强生物膜(11株为弱生物膜,5株为中等生物膜)。强生物膜形成株携带毒力基因的数量更多,其中cap8H基因携带率高于非强生物膜株(66.7% vs 25.0%),但差异无统计学意义(χ2=4.861,P=0.053)。强生物膜形成株和非强生物膜形成株均主要分布在agrⅠ型,分别为10株(占83.33%)和11株(占68.75%)。
2.5MRSA与MSSA菌株耐药性、毒力基因、agr分布及生物膜形成能力比较分析 MRSA菌株对多种药物耐药率高于MSSA,分别为庆大霉素、环丙沙星、左氧氟沙星、莫西沙星、红霉素、克林霉素、四环素,差异有统计学意义。见表5。
43株MRSA菌株中crtN、hla、hlb、hld基因检出率均为100%;59株MSSA菌株中crtN、hla、hlb、hld基因检出分别为58株(98.31%)、56株(94.92%)、57株(96.61%)和55株(93.22%),两组之间各基因检出率差异无统计学意义。MRSA菌株cap8H基因携带率较MSSA菌株低(20.9% vs 40.7%,χ2=4.432,P=0.035),tst基因携带率较MSSA菌株高(34.88% vs 11.86%,χ2=7.791,P=0.005),差异有统计学意义。见表5。
43株MRSA菌株中agrⅠ、agrⅡ、agrⅢ型检出率分别为46.51%(20株)、48.84%(21株)和4.65%(2株);59株MSSA菌株中agrⅠ、agrⅡ、agrⅢ型菌株检出率分别为62.71%(37株)、27.12%(16株)和5.08%(3株)。agrⅡ分型中MRSA菌株占比高于MSSA菌株(48.84% vs 27.12%,χ2=5.075,P=0.024),差异有统计学意义。见表5。
43株MRSA菌株中强生物膜4株(9.30%),非强生物膜10株(23.26%);59株MSSA菌株中强生物膜7株(11.86%),非强生物膜6株(10.17%)。MRSA和MSSA菌株在生物膜形成能力上差异无统计学意义。见表5。
3 讨论
结果显示,我院血液分离金黄色葡萄球菌对多种抗菌药物的敏感性较高,但MRSA检出率达42.2%,高于国内部分同级别医院[10-11],与江苏省2020年度平均水平相似[12],且MRSA菌株对环丙沙星、四环素、红霉素、克林霉素、左氧氟沙星、莫西沙星耐药率均高于MSSA。
本研究发现,血流感染来源金黄色葡萄球菌普遍携带crtN、hla、hlb、hld基因,且以同时携带crtN/hla/hlb/hld4种毒力基因的组合最多,提示葡萄黄质和溶血素可能在金黄色葡萄球菌血流感染中起关键作用。葡萄黄质crtN是金黄色葡萄球菌重要毒力因子,既具有抗氧化性,增加金黄色葡萄球菌的毒力和抵抗中性粒细胞杀伤作用,又具有增加细胞膜的韧性来增强抵抗阳离子抗菌肽介导的非氧化型宿主的防御,从而抵抗宿主先天免疫防御[13]。本研究发现crtN检出率达99.0%,与Derakhshan等[9]报道不同来源金黄色葡萄球菌89.4%的crtN携带率相似,由此可见,crtN基因与金黄色葡萄球菌致病密切相关。溶血素是金黄色葡萄球菌另一重要细胞毒性分子,主要作用于红细胞、吞噬细胞,hla、hlb和hld基因分别编码α溶血素、β溶血素和δ溶血素[4]。本研究中hla、hlb和hld基因携带率分别为97.1%、98.0%和96.1%,且在MRSA和MSSA菌株中无差异。此结果与Wang等[14]报道山东地区血流感染金黄色葡萄球菌结果不同,是否存在地区差异尚待进一步研究。同时,本结果高于Derakhshan等[9]对不同来源金黄色葡萄球菌溶血素基因携带率的调查结果(hla39%,hlb67.5%,hld75.6%),说明在造成血流感染的金黄色葡萄球菌中溶血素基因可能在致病性中发挥重要作用。荚膜是细菌最重要的表面因子,对黏附和感染的初始阶段至关重要,并可与各种非生物表面结合[15]。本研究中有65.7%的菌株不携带cap8H基因,与Wang等[14]研究结果一致,CP8表达的缺失可能会增强金黄色葡萄球菌在感染宿主中的持久性。本研究还发现,与MSSA相比,MRSA菌株cap8H基因携带率更低,由此推测,cap8H缺失可能是MRSA菌株在体内持续感染的一个重要因素。超抗原中毒性休克综合征毒素-1(TSST-1)可以引起食物中毒和中毒性休克,激活T淋巴细胞,并产生大量的细胞因子和趋化因子[16]。本研究中tst基因携带率为21.6%,较Wang等[14]报道的tst基因携带率(5%)高。与MSSA相比,MRSA菌株tst基因携带率更高。由此可见,血液分离MRSA菌株较MSSA菌株在表面因子和超抗原携带上的差异性可能是导致MRSA更具持久性和致病性的原因。
Agr群体感应系统是最早被发现参与金黄色葡萄球菌血流感染过程中毒力表达的重要调控系统并参与致病性[1]。本研究中agr检出率达92.7%,其中agrⅠ型占56.9%,agrⅡ型占36.3%,agrⅢ型占4.9%,未检测出agrⅣ型。这与文献[9]报道不同来源金黄色葡萄球菌agr阴性株占35%,未检出agrⅡ型和agrⅣ型的结果不同。Painter等[5]报道金黄色葡萄球菌菌血症患者大多由agr缺陷分离株引起,与本研究结果不同,可能与菌株分离的地区性差异有关。对agrⅠ和agrⅡ组间耐药性和毒力基因的相关性比较发现,agrⅡ型菌株对抗菌药物的耐药性更高,更易表现为cap8H基因缺失和高tst基因携带。与国内多家医院菌血症患者分离金黄色葡萄球菌结果一致[17]。此外,本研究中MRSA菌株中agrⅠ型和agrⅡ型占比相当,且与MSSA菌株相比,agrⅡ型占比更高。
本研究中,102株菌株中28株具有生物膜成膜能力,其中12株强生物膜形成株,16株非强生物膜形成株。血液分离金黄色葡萄球菌生物膜形成能力明显低于不同来源金黄色葡萄球菌生物膜形成能力[9]。MRSA菌株中强生物膜5株(占11.6%)、非强生物膜9株(占20.9%);MSSA菌株中强生物膜7株(占11.9%)、非强生物膜7株(占11.9%)。虽然上述菌株间生物膜形成能力差异无统计学意义,但MRSA菌株更倾向于形成非强生物膜。另外,还发现强生物膜菌株携带毒力基因数高于非强生物膜菌株,且cap8H基因携带率高于非强生物膜株,但差异无统计学意义,考虑到本研究中样本量较少,cap8H基因在金黄色葡萄球菌生物膜形成中的作用仍需进一步研究。

