胶体金免疫层析法在产碳青霉烯酶肠杆菌目细菌检测中的应用评价*
陈善建,郑芷怡,林宇岚,陈艳淑,张维清,陈守涛,江丽,罗成烁,杨滨
(1.福建医科大学附属第一医院检验科,福州 350005;2.福建省检验医学重点实验室,福州 350005;3.福建医科大学基因诊断研究中心,福州 350005)
碳青霉烯类耐药肠杆菌目细菌(carbapenem-resistantEnterobacterales, CRE)的感染与传播是全球共同关注的问题[1]。产碳青霉烯酶是CRE主要的耐药机制,其中以A类丝氨酸酶中的KPC酶、B类金属酶中VIM、IMP、NDM酶和D类丝氨酸酶中的OXA-48-like酶最为常见[2]。针对不同酶型的CRE,用于治疗的抗菌药物可能不同,如头孢他啶-阿维巴坦对产丝氨酸酶的菌株具有较强的生物学活性,而对产金属酶的菌株无效[3]。因此,产碳青霉烯酶肠杆菌目细菌(carbapenemase-producingEnterobacterales, CPE)的酶型分析对CRE的流行病学调查以及临床治疗的选择有着重要的意义。
CRE血流感染可选择的抗菌药物有限,这类感染往往死亡率较高,医疗资源投入更大[4]。传统CRE血流感染的诊断方法耗时较长,无法满足临床CRE快速诊疗的需要。基于KPC、NDM、VIM、IMP和OXA-48 5种常见碳青霉烯酶开发的胶体金免疫层析法操作简便,可于15 min内进行碳青霉烯酶的分型检测,并且具有较高的敏感性与特异性[5]。更重要的是,即使不对血培养阳性标本进行转种培养,只要提取到足够的细菌蛋白质,该方法也可对碳青霉烯酶进行分型检测,这为CPE血流感染的快速诊断提供了新的思路。本研究旨在评估胶体金免疫层析法对CPE临床分离株及血培养阳性标本中碳青霉烯酶的检测及分型能力,从而为临床CPE感染的快速诊断提供实验室依据。
1 材料与方法
1.1菌株来源 收集2018年6月至12月福建医科大学附属第一医院临床样本分离的非重复肠杆菌目细菌,所有菌株均分别由基质辅助激光解吸电离飞行时间质谱仪及Vitek 2全自动细菌药敏分析仪进行鉴定与药敏分析。通过筛选,纳入其中41株对亚胺培南和/或美罗培南最低抑菌浓度(minimal inhibitory concentration, MIC)值≥4 μg/mL且PCR扩增发现携带碳青霉烯类耐药基因的CRE菌株与24株碳青霉烯类敏感(亚胺培南和美罗培南MIC值≤1 μg/mL)的肠杆菌目细菌作为研究对象。肺炎克雷伯菌ATCC BAA-1705与大肠埃希菌ATCC 25922为质控菌株。
1.2主要仪器及试剂 Microflex LT/SH基质辅助激光解吸电离飞行时间质谱仪(德国布鲁克公司),Vitek 2全自动细菌药敏分析仪(法国生物梅里埃公司),VeritiTMDx PCR扩增仪(美国ABI公司),DYY-7C转印电泳仪、WD-9413B凝胶成像分析系统(北京六一生物科技有限公司),BACTECTMFX全自动血培养仪(美国BD公司)。Taq酶、DNA Marker(上海生工生物公司),美罗培南药敏纸片(英国Oxoid公司),NG-Test CARBA 5碳青霉烯酶检测试剂盒(胶体金免疫层析法,上海复星医药股份有限公司),血培养样本释放剂NG-Test®Blood Culture Prep(长沙中生众捷生物技术有限公司)。
1.3PCR法扩增碳青霉烯类耐药基因 采用煮沸法提取细菌DNA,并根据文献[6]合成blaKPC、blaIMP、blaVIM、blaOXA-48-like、blaNDM的引物。PCR反应总体系共25 μL,包括Taq PCR Mix预混液(2×)12.5 μL,10 μmol/L上、下游引物各1 μL,DNA模板1 μL,以灭菌去离子水补足至25 μL。PCR扩增条件为:95 ℃预变性5 min;95 ℃ 30 s,56 ℃退火30 s,72 ℃ 1 min,共30个循环;72 ℃延伸7 min。PCR反应产物行20 g/L琼脂糖凝胶电泳并观察条带,挑选部分阳性产物送上海生工生物公司在ABI 3730XL测序仪上进行Sanger测序并分析基因型。
1.4改良碳青霉烯类失活法(mCIM)和EDTA碳青霉烯类失活法(eCIM)联合试验 以1 μL接种环挑取一环菌落悬浮于2支装有2 mL TSB肉汤的试管中,其中1支试管加入20 μL 0.5 mol/L EDTA溶液,另外1支不加。分别取1片美罗培南纸片(10 μg)浸入2支试管中,置于35 ℃的环境中温育4 h±15 min。然后,取出美罗培南纸片贴于已涂布大肠埃希菌ATCC 25922悬液的MH平板上,35 ℃温箱中温育18~24 h后量取抑菌圈直径。结果判读根据2020版美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)M100指南标准进行。
1.5胶体金免疫层析法检测碳青霉烯酶 EP管中滴入5滴(约150 μL)提取缓冲液,用1 μL接种环挑取一环细菌样本置于EP管中并混匀。然后用一次性移液管吸取100 μL制备好的混合液加入NG-Test CARBA 5检测板的样本孔中,15 min后根据试剂盒说明书读取结果。
1.6血培养阳性建模及胶体金免疫层析法检测 挑取待测菌落配制成0.5麦氏浓度单位的菌悬液,随后稀释至菌液浓度为104CFU/mL[7]。取1 mL菌悬液注入BD BACTECTM血培养瓶中,然后置于血培养仪中培养,直至报阳。报阳后的血培养以NG-Test®Blood Culture Prep商品化样本释放剂进行预处理。预处理步骤根据说明书进行:向EP管中加入1 mL报阳血培养样本与1 mL裂解缓冲液,涡旋仪混匀20 s,然后15 000 r/min离心1 min,弃上清液。以1 mL洗涤缓冲液重悬沉淀,涡旋混匀20 s后15 000 r/min离心1 min,弃上清液,得到细菌蛋白质样本。然后以胶体金免疫层析法检测血培养样品中的碳青霉烯酶。
1.7统计学分析 用SPSS 22.0软件进行。以PCR结果为金标准,分别计算胶体金免疫层析法及mCIM与eCIM联合试验的敏感性和特异性、阳性预测值和阴性预测值,并与PCR方法检测结果进行一致性分析:Kappa值<0.4,说明一致性程度较差;Kappa值在0.4~0.75之间,说明一致性程度尚可;Kappa值>0.75,说明一致性程度较好。
2 结果
2.1PCR法检测5种碳青霉烯类耐药基因结果 PCR扩增结果发现41株CRE中有24株肺炎克雷伯菌与1株大肠埃希菌携带blaKPC基因;2株肺炎克雷伯菌、2株为大肠埃希菌、1株阴沟肠杆菌、1株弗劳地枸橼酸杆菌与1株变栖克雷伯菌携带blaNDM基因;4株肺炎克雷伯菌携带blaIMP基因;4株肺炎克雷伯菌同时携带blaKPC+NDM基因,1株阴沟肠杆菌同时携带blaKPC+NDM+IMP基因;24株碳青霉烯类敏感的肠杆菌目细菌均未检出碳青霉烯类耐药基因。部分PCR扩增产物琼脂糖凝胶电泳结果见图1。
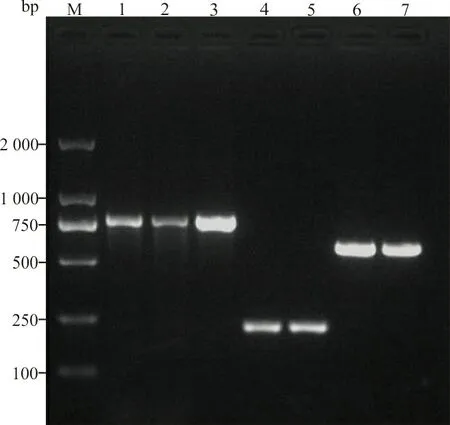
注:M,DNA marker(100~2 000 bp);1~3,blaKPC基因(798 bp);4~5,blaIMP基因(232 bp);6~7,blaNDM基因(621 bp)。
分别随机挑取2个blaKPC基因、2个blaNDM基因以及2个blaIMP基因的扩增产物进行测序,测序结果通过网址https://blast.ncbi.nlm.nih.gov/Blast.cgi进行比对分析,发现测序结果与琼脂糖凝胶电泳结果一致。
2.2临床分离株的表型检测及胶体金免疫层析法检测结果 41株CRE菌株的mCIM试验结果均为阳性,其中有11株eCIM试验结果阳性,30株eCIM试验结果为阴性。见表1。胶体金免疫层析法检测结果与PCR扩增结果完全一致。24株碳青霉烯类敏感菌株的mCIM试验结果与胶体金免疫层析法检测结果均为阴性。因此,mCIM试验的敏感性、特异性、阳性预测值及阴性预测值均为100.0%,与PCR方法结果的一致性较好,Kappa值为1.0。mCIM和eCIM联合试验检测丝氨酸酶的敏感性、特异性、阳性预测值及阴性预测值均为100.0%,与PCR方法结果的一致性较好,Kappa值为1.00;检测金属酶的敏感性为68.8%,特异性为100.0%,阳性预测值为100.0%,阴性预测值为82.8%,与PCR方法结果的一致性尚可,Kappa值为0.73。胶体金免疫层析法的敏感性、特异性和阳性预测值、阴性预测值均为100.0%,与PCR结果完全一致,Kappa值为1.000。

表1 41株CRE的耐药基因分型与表型检测结果分析
2.3阳性血培养样本的分型检测结果 从65株肠杆菌目细菌中挑选53株菌株(见表2)构建模拟血培养瓶并以胶体金免疫层析法进行分型检测,结果发现胶体金免疫层析法分型结果与PCR分型结果完全一致。胶体金免疫层析法的敏感性、特异性、阳性预测值与阴性预测值均为100%,与PCR方法的一致性程度好,Kappa值为1.000。
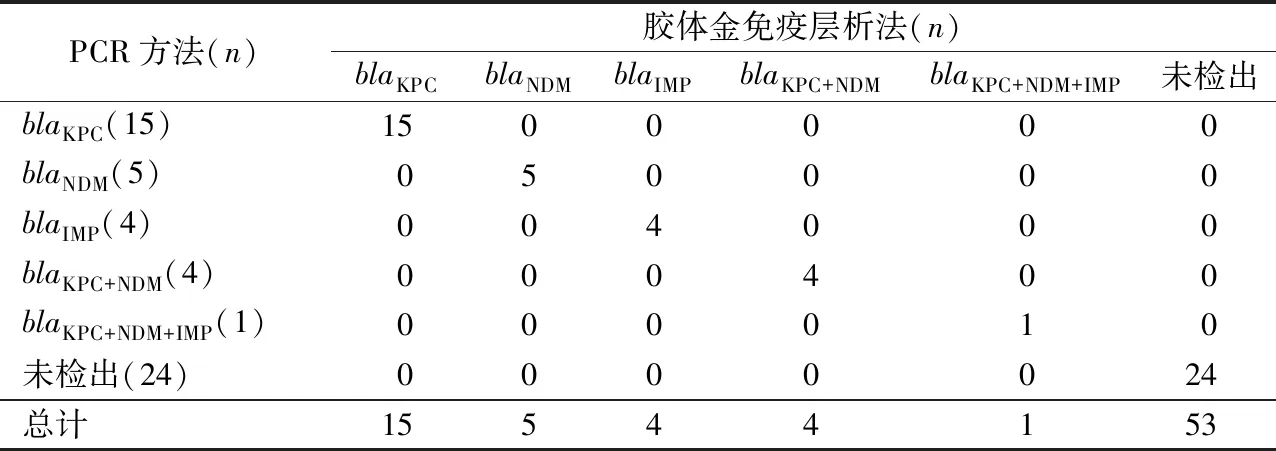
表2 53例血培养阳性模拟标本的胶体金免疫层析法和PCR法结果对比分析
3 讨论
本研究以PCR法为参考标准,分别评估mCIM和eCIM联合试验以及胶体金免疫层析法对CPE的分型检测能力。研究结果发现mCIM和eCIM联合试验能够准确区分单产丝氨酸酶或金属酶,与Zhu等[8]的结果较为一致。然而,本研究中有5株同时携带blaKPC和blaNDM基因的CRE菌株被mCIM和eCIM联合试验判断为产丝氨酸酶,而金属酶结果出现了漏检。这表明mCIM与eCIM联合试验对于同时产金属酶和丝氨酸酶菌株的分型结果并不准确,虽然温育过程中EDTA能够抑制金属酶,但共存的丝氨酸酶仍然可以水解美罗培南,导致2个药敏纸片抑菌圈的直径相差≤4 mm,从而最终结果判定为产丝氨酸酶。此外,虽然mCIM和eCIM联合试验操作简便、成本较低,但其过程耗时较长,且随着同时产金属酶和丝氨酸酶菌株分离率的增加,该方法在临床上的应用将表现出一定的局限性。
既往研究发现,胶体金免疫层析法对5种主要碳青霉烯酶的检测均有较高的敏感性与特异性[8-10]。本研究中该方法检测结果与PCR法结果完全一致,与mCIM和eCIM联合试验相比,该方法不仅能准确区分丝氨酸酶与金属酶,还能分析碳青霉烯酶的具体分型。对于同时携带2种及以上基因型的菌株,该方法也具有更高的准确性。Yoon等[11]还比较了胶体金免疫层析法与Xpert Carba-R方法的检测性能,发现2种方法对KPC、NDM、IMP以及OXA-48-like酶的敏感性与特异性一致,但胶体金免疫层析法的平均检测时限明显短于Xpert Carba-R方法(24 min vs 7 min)。此外,与Rapidec Carba NP方法及改良Hodge试验相比,胶体金免疫层析法不仅操作简便,检测时限更短,且对OXA-48-like酶拥有更高的敏感性[12-13]。
传统CRE血流感染的诊断常需要24~48 h甚至更久,无法满足临床快速诊疗的需要。胶体金免疫层析法可以直接分析预处理后的阳性血培养样本,从而判断血流感染的病原菌是否产生5种主要的碳青霉烯酶。本研究发现胶体金免疫层析法对血培养阳性标本碳青霉烯酶分型检测的敏感性、特异性、阳性预测值和阴性预测值均为100%,与Jenkins等的研究结果大致相同[10]。但本研究中的敏感性略高于部分研究[14-15],这可能是由于不同研究中菌株的构成比不同造成的,也有可能是不同研究中阳性血培养标本预处理的方法不同导致。
本研究存在以下不足。首先,未纳入blaVIM和blaOXA-48-like基因阳性的菌株,且blaIMP基因阳性菌株也较少,因此无法准确评估胶体金免疫层析法对这些基因型的检测能力。但国内CRE的流行株也主要以blaPKC与blaNDM基因为主[16],因此本研究结果仍可为国内临床微生物实验室方法学的选择提供一定的参考。其次,本研究主要评估胶体金免疫层析法在CPE检测中的应用价值,而临床上铜绿假单胞菌、鲍曼不动杆菌对碳青霉烯类的耐药情况也不容忽视,后续研究需要扩大样本的收集范围,进一步评估该方法的分型检测能力。

