叶面喷施壳聚糖缓解低温处理对丝瓜幼苗的影响*
练华山,周艾玲,梁 乐,李焕秀,唐 懿
(1.成都农业科技职业学院 农学园艺学院,四川 成都 611130;2.成都农业科技职业学院 园艺研究所,四川 成都 611130;3.四川农业大学 园艺学院,四川 成都 611130;4.四川农业大学 果蔬研究所,四川 成都 611130)
低温是影响植物地理分布的主要因素之一,也会影响作物的生长发育和产量,威胁作物的生产和粮食安全[1]。低温胁迫(0~15 ℃)可刺激植物质膜中的冷受体触发细胞反应,对细胞、代谢和分子功能造成慢性或长期损伤[2-3];可对植物叶片叶绿素含量的积累造成影响,从而影响植物对光的吸收,降低光合作用[4];还会打破植物体内活性氧的动态平衡,积累过量的活性氧和丙二醛(MDA),导致植物受到低温损伤甚至死亡。为了适应低温环境,植物通过多种因子的调节作用重塑植物代谢系统和抗氧化系统。渗透调节是植物对低温环境的适应性,植物通过控制渗透调节物质 (如可溶性糖、可溶性蛋白质和游离脯氨酸等)保持细胞正常代谢和维持细胞膨压,缓解低温对植物的伤害[5]。在长期环境适应中,植物可以通过多种途径清除活性氧自由基,其中,超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是植物体内自由基清除剂,它们共同作用使植物体内自由基维持正常水平,从而防止自由基对植物造成氧化损伤[6]。矿质元素是影响植物生长的主要因素之一,其中氮(N)和磷(P)是植物体内许多重要有机化合物的主要组成部分,如蛋白质、核酸、叶绿素、酶以及一些植物激素,低温会限制植物对矿质元素的吸收,进而影响植物的耐冷性[7]。另外,钾(K)是植物细胞内重要的阳离子,也参与维持细胞内外的渗透压和酸碱平衡。目前,已经发现多种提高植物耐冷性的方法,其中,外源喷施植物激素或植物生物刺激素是简单可行的方法之一。
植物生物刺激素是一种不同于其他肥料的物质,低剂量应用可以促进植物生长,为植物体内许多复杂的生化反应提供有益元素或有机化合物,并且通过影响多种代谢途径直接调控植物的生命进程[8-9]。植物刺激素是缓解生物[10]和非生物胁迫[11-13]及提高作物品质[14]的物质或微生物,主要包含腐植酸、壳聚糖、几丁质及其衍生物和海藻提取物等。壳聚糖具有溶解性、低毒性、可被生物降解性、诱导抗病性和食用性等特性,被广泛应用于工业、农业和医药等[8]。壳聚糖可通过增加植物细胞渗透性来提高营养物质吸收,促进根系发育、提高植物光合作用、调节作物生长和诱导植物抗逆性[8]。在辣椒[15]、黄瓜[12,16]、水稻[11]和草莓[13]的研究中发现:外源壳聚糖能够诱导植物的防御反应,提高植株耐冷性,促进植物生长。外源壳聚糖通过增加光合作用速率、调节可溶性糖和脯氨酸含量、提高抗氧化酶活性和相关基因的表达量等途径降低活性氧含量[17]。壳聚糖处理一方面可以促进光合色素和蛋白质等合成;另一方面,能够增加MDA 含量、提高抗氧化酶以及与氮代谢有关的酶活性,提高植物对非生物胁迫的抗逆性[18-19]。此外,壳聚糖在许多植物中通过叶面施用而被用作防潮剂,从而减少了用水量并确保免受其他不利影响,基于这种有益特性,壳聚糖被用于可持续农业实践中[20]。
丝瓜(Luffa cylindrical)是葫芦科(Cucurbitaceae)丝瓜属(Luffa)一年生攀缘草本植物,又名布瓜、天罗等,根系发达,且再生能力较强[21],具有顺气健脾、清凉解毒和润肤美容等功效,是一种具有良好保健功效的蔬菜[22]。丝瓜原产于印度,广泛栽培于热带和温带地区,不耐低温[23]。在实际生产过程中,春季提早栽培会遭遇“倒春寒”,不仅影响丝瓜幼苗生长发育,也会影响其后期的产量和品质。因此,本研究以丝瓜幼苗为材料,探讨低温处理下叶面喷施不同质量浓度壳聚糖对丝瓜幼苗光合色素、渗透调节物质含量、抗氧化酶活性以及矿质元素吸收的影响,以期筛选出提高丝瓜幼苗耐冷性的最适壳聚糖质量浓度,并为壳聚糖的实践应用提供理论基础。
1 材料与方法
1.1 试验材料
以四川省内江市威远县地方品种铁丝瓜为试验材料,其果肉不易褐变,品质佳,种子由成都农业科技职业学院提供。壳聚糖购自成都市科隆化学品有限公司。
1.2 试验设计
试验于2021 年9—11 月在四川农业大学成都校区进行。2021 年9 月,选择籽粒饱满的丝瓜种子,在质量分数为10%的过氧化氢溶液中消毒10 min,随后用超纯水洗净,均匀放置于垫有滤纸的培养皿中,保持充足水分,于28 ℃人工培养箱中进行催芽,露白后种植于装有基质(V珍珠岩∶V蛭石=1∶1)的55 孔穴盘中,待幼苗长至两叶一心时,挑选长势一致的幼苗移栽至装有上述基质的营养钵中(直径9 cm,高7.5 cm),每盆1 株,放入平底穴盘中,每个平盘18 盆幼苗。移栽后进行常规管理,每2 d 用改良Hoagland 营养液浇灌1 次,每次每个穴盘1 L。改良Hoagland 营养液配方为:四水硝酸钙945.000 mg/L、硝酸钾506.000 mg/L、硝酸铵80.000 mg/L、磷酸二氢钾136.000 mg/L、七水硫酸镁493.000 mg/L、铁盐溶液2.500 mg/L、碘化钾0.830 mg/L、硼酸6.200 mg/L、硫酸锰22.300 mg/L、硫酸锌8.600 mg/L、钼酸钠0.250 mg/L、硫酸铜0.025 mg/L、氯化钴0.025 mg/L。待丝瓜幼苗长到4~5 片真叶时,叶片均匀喷施不同质量浓度(0、25、50、100 和200 mg/L)的壳聚糖溶液,直至叶面形成水滴而不滴落,每盆喷施约25 mL。每2 d 喷施1 次,连续喷3 次,喷施处理后自然生长48 h 进行低温处理。
低温处理前,将丝瓜幼苗置于人工智能气候箱中进行预培养(培养期间每2 d 浇灌1 次改良Hoagland 营养液),环境条件为:昼/夜温度25 ℃/18 ℃,光照周期12 h/12 h (昼/夜),光照强度300 μmol/(m2·s),相对湿度75%。预培养24 h 后进行低温处理,环境条件为:昼/夜温度8 ℃/8 ℃,光照周期、光照强度和相对湿度同预培养。丝瓜幼苗在智能人工培养箱内随机排列,低温处理24 h后取样进行指标测定。试验同时设置不喷施壳聚糖溶液的常温对照处理。每个处理6 盆,每盆设置3 个重复。
1.3 指标测定
1.3.1 光合色素含量
称取叶片0.2 g,采用浸泡法(V乙醇∶V丙酮=1∶1)测定并分别计算叶绿素a、叶绿素b、类胡萝卜素和总叶绿素的含量[24]。
1.3.2 相对电导率和渗透调节物质含量
称取0.1 g 用0.5 cm 直径打孔器打孔的叶片,放入50 mL 离心管中,加入去离子水30 mL,放在摇床上150 r/min 遮光摇6 h。用电导仪测定去离子水电导率(S0)和浸泡液电导率(S1),再将浸泡液沸水浴30 min,冷却至室温后测定溶液电导率(S2),并计算相对电导率:相对电导率=(S1-S0)/(S2-S0)×100%。可溶性糖含量采用蒽酮比色法测定;可溶性蛋白含量采用考马斯G-250 法测定;脯氨酸含量采用酸性茚三酮法测定;MDA含量采用硫代巴比妥酸法测定[25]。
1.3.3 抗氧化酶活性
取叶片1.0 g,加入预冷的50 mmol/L 磷酸缓冲液(pH 7.8 含有聚乙烯吡咯烷酮1.0 g、2 mmol/L二硫苏糖醇和0.1 mmol/L 乙二胺四乙酸)于冰上研磨,定容至8 mL。在10 000 r/min 下低温离心10 min,取上清液进行酶活性测定。SOD 活性采用氮蓝四唑光化还原法测定;POD 活性采用愈创木酚法测定,以每分钟内A470 变化0.1 为1 个酶活单位;CAT 活性采用高锰酸钾滴定法测定,以每克鲜质量样品1 min 内分解H2O2的毫克数表示[25]。
1.3.4 N、P、K 含量
取烘干、粉碎并过筛的幼苗叶片0.2 g,加少量水和浓H2SO4溶液5 mL,摇匀过夜,采用硫酸—过氧化氢消煮法进行消煮,过滤后定容至100 mL。分别用凯氏定氮法、钼锑抗比色法和火焰分光光度法测定N、P、K 含量[26]。
1.4 数据处理
采用Excel 2010 绘图,用SPSS 22.0 进行数据处理,并进行Duncan’s 差异显著性分析。数据均以“平均值±标准差”表示。
2 结果与分析
2.1 壳聚糖对低温处理下丝瓜幼苗光合色素含量的影响
由图1 可知:与常温对照相比,低温处理后丝瓜幼苗叶片中的叶绿素a 和类胡萝卜素含量显著降低,叶绿素b 和总叶绿素含量也降低,但差异未达到显著水平;与常温和低温对照相比,叶面喷施25 mg/L 壳聚糖可显著提高丝瓜幼苗叶片的光合色素含量,较低温对照分别增加23.90%、40.30% 和 30.80%;当叶面喷施 50、100 和 200 mg/L壳聚糖时,丝瓜幼苗叶片的光合色素含量较常温和低温对照无显著变化或显著降低,且均低于25 mg/L 壳聚糖处理。
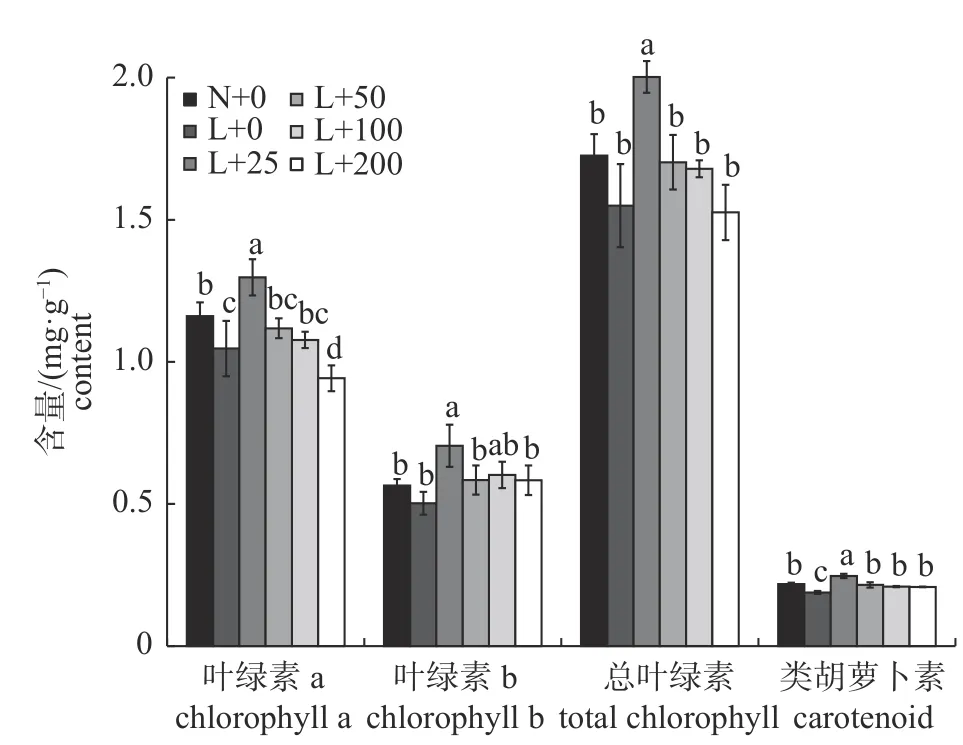
图1 壳聚糖对低温处理下丝瓜幼苗光合色素含量的影响Fig.1 Effects of chitosan on the photosynthetic pigment content of loofah seedlings under low temperature treatments
2.2 壳聚糖对低温处理下丝瓜幼苗相对电导率的影响
由图2 可知:低温处理后,丝瓜幼苗的相对电导率较常温对照显著提高72.10%;叶面喷施不同质量浓度壳聚糖后,丝瓜幼苗的相对电导率均较低温对照下降,但均显著高于常温对照。其中,与低温对照相比,叶面喷施25 mg/L 壳聚糖的丝瓜幼苗相对电导率显著降低24.60%,但随着壳聚糖质量浓度的升高,其相对电导率呈上升趋势,且与低温对照无显著差异。

图2 壳聚糖对低温处理下丝瓜幼苗相对电导率的影响Fig.2 Effects of chitosan on the relative conductivity of loofah seedlings under low temperature treatments
2.3 壳聚糖对低温处理下丝瓜幼苗可溶性糖和可溶性蛋白含量的影响
由图3 可知:叶面喷施不同质量浓度的壳聚糖可提高丝瓜幼苗叶片中的可溶性糖和可溶性蛋白含量。与常温对照相比,低温处理后丝瓜幼苗的可溶性糖含量无显著变化,但可溶性蛋白含量显著降低。低温胁迫下,叶面喷施不同质量浓度的壳聚糖可提高丝瓜幼苗叶片中的可溶性糖含量,且各质量浓度处理间无显著差异;其中,25 和50 mg/L 壳聚糖处理后丝瓜幼苗中的可溶性糖含量显著高于常温对照和低温对照,100 和200 mg/L 壳聚糖处理后的可溶性糖含量显著高于常温对照。与常温对照和低温对照相比,叶面喷施25 mg/L 壳聚糖可显著提高丝瓜幼苗的可溶性蛋白含量;与低温对照相比,叶面喷施100 和200 mg/L 壳聚糖可显著提高丝瓜幼苗的可溶蛋白含量,但与常温对照相比无显著差异。
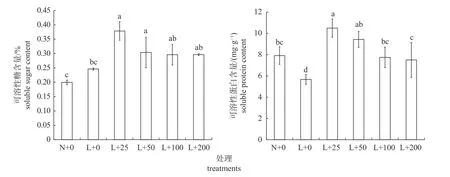
图3 壳聚糖对低温处理下丝瓜幼苗可溶性糖和可溶性蛋白含量的影响Fig.3 Effects of chitosan on the soluble sugar and soluble protein content of loofah seedlings under low temperature treatments
2.4 壳聚糖对低温处理下丝瓜幼苗脯氨酸(Pro)和丙二醛(MDA)含量的影响
由图4 可知:低温处理可显著降低丝瓜幼苗的Pro 含量,显著提高其MDA 含量。与常温对照和低温对照相比,叶面喷施25 mg/L 壳聚糖可显著提高丝瓜幼苗的Pro 含量;喷施 50、100 和200 mg/L 壳聚糖时,各处理间丝瓜幼苗的Pro 含量无显著差异,且均显著低于喷施25 mg/L 壳聚糖处理、显著高于低温对照。此外,与常温和低温对照相比,叶面喷施25 mg/L 壳聚糖后丝瓜幼苗的MDA 含量分别显著下降18.60%和30.90%;喷施50 和200 mg/L 壳聚糖丝瓜幼苗的MDA 含量显著高于常温对照,但与低温对照无显著差异;喷施100 mg/L 壳聚糖丝瓜幼苗的MDA 含量显著低于低温对照,但与常温对照无显著差异。
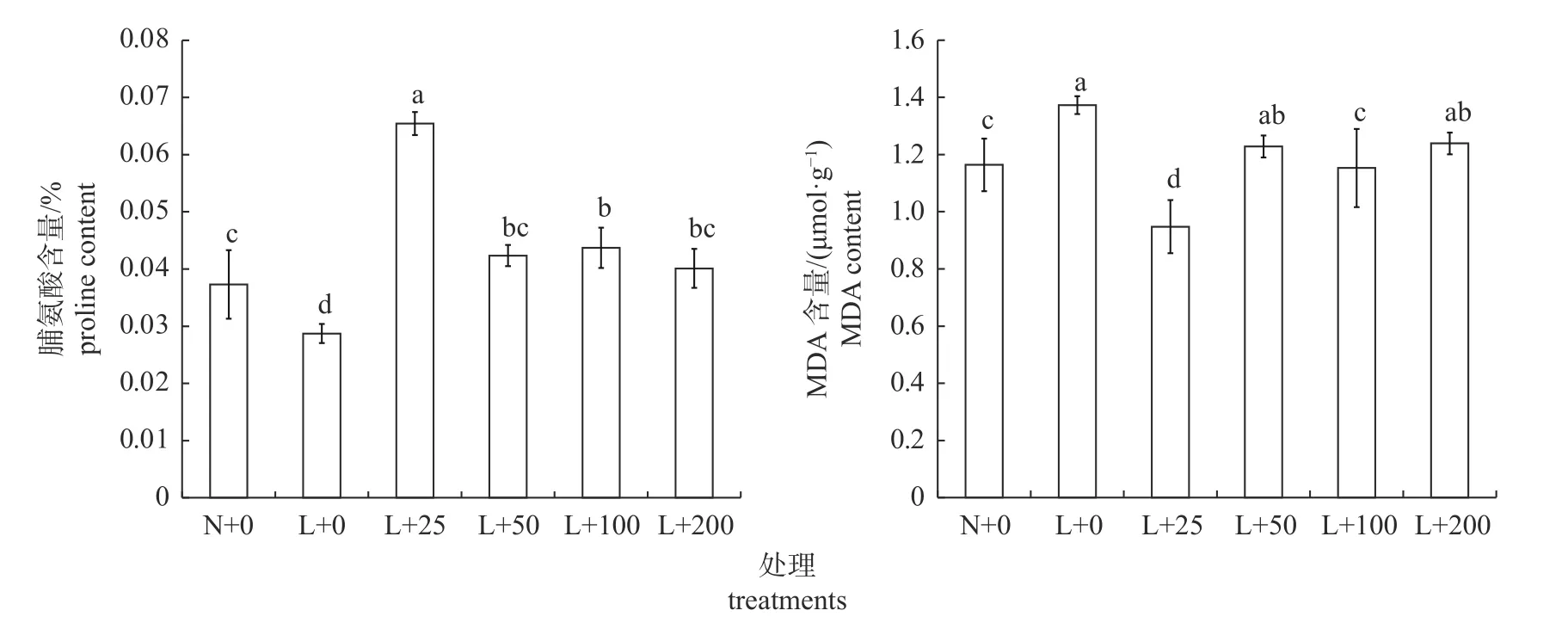
图4 壳聚糖对低温处理下丝瓜幼苗脯氨酸(Pro)和丙二醛(MDA)含量的影响Fig.4 Effects of chitosan on the contents of proline (Pro) and malondialdehyde (MDA) in loofah seedlings under low temperature treatments
2.5 壳聚糖对低温处理下丝瓜幼苗抗氧化酶活性的影响
由图5 可知:与常温对照相比,低温处理可显著降低丝瓜幼苗的SOD、POD 和CAT 活性;与低温对照相比,叶面喷施25 mg/L 壳聚糖可显著提高3 种抗氧化酶的活性;随着壳聚糖质量浓度的升高,3 种抗氧化酶活性总体呈下降趋势。

图5 壳聚糖对低温处理下丝瓜幼苗抗氧化酶活性的影响Fig.5 Effects of chitosan on the activity of antioxidant enzymes in loofah seedlings under low temperature treatments
2.6 壳聚糖对低温处理下丝瓜幼苗N、P、K 含量的影响
图6 显示:与常温对照相比,低温处理可显著降低丝瓜幼苗的N 和P 含量(分别降低37.90%和15.30%)、显著提高K 含量(提高6.69%);与低温对照相比,喷施25 mg/L 壳聚糖可显著提高丝瓜幼苗的N、P、K 含量;随着壳聚糖质量浓度的升高,丝瓜幼苗的N、P、K 含量总体呈下降趋势。
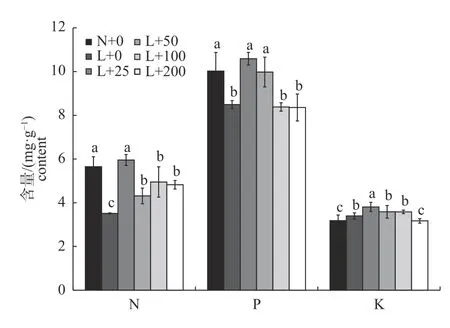
图6 壳聚糖对低温处理下丝瓜幼苗N、P、K 含量的影响Fig.6 Effects of chitosan on the N,P and K contents of loofah seedlings under low temperature treatments
3 讨论
作为中国常见的瓜类,丝瓜的生长发育和地理分布主要受限于温度。低温环境干扰丝瓜的光合作用、呼吸作用、蒸腾作用等生长和生理活动,使丝瓜代谢紊乱,对丝瓜的品质和产量造成严重影响[3]。在丝瓜的光合作用中,叶绿素具有吸收和转换光能的作用,从而影响植物光合作用对光能的吸收与转化,并且能够影响植物的衰老程度[27]。前人研究表明:壳聚糖能够改善蔬菜幼苗的光合作用性能,提高光合色素含量[9,15]。在本研究中,喷施壳聚糖可缓解低温处理下丝瓜幼苗叶片光合色素含量的下降,但喷施不同质量浓度的壳聚糖表现有所不同,其中,丝瓜幼苗叶片中叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量均在25 mg/L 壳聚糖处理时最高。这与壳聚糖能显著提高水稻[11]、草莓[13]和茄子[28]等叶片光合色素含量的研究结果一致,其原因可能是壳聚糖可有效抑制低温下叶绿体类囊体片层结构紊乱、被膜内陷或破裂,促进叶绿体形成和叶绿素合成[29];也有可能是壳聚糖可缓解低温引起的光合电子传递率下降和光合作用相关酶活性降低[30]。
遭遇低温胁迫时,植物体内会积累渗透调节物质,以提高植物的耐冷性。低温胁迫可提高植物体内的相对电导率以应对植物失水[31-32],本研究结果与之类似。本研究中,叶面喷施壳聚糖不仅降低了丝瓜幼苗的相对电导率,还提高了低温处理下丝瓜幼苗叶片的可溶性糖、可溶性蛋白和Pro 含量,这与前人对水稻幼苗[33]和黄瓜幼苗[12]的研究结果类似。与常温对照相比,低温处理使丝瓜幼苗叶片中K 元素含量上升,分析其原因可能是K+为调节细胞渗透势的重要组分,其含量增加有利于提高植株的耐冷性[34]。在低温胁迫下,胞内的可溶性物质含量增加,而胞内渗透势随之降低,植物可从外界吸收水分,防止细胞过度脱水,从而减少低温对细胞的伤害[35]。外源壳聚糖能够缓解低温造成的细胞膜破坏而导致的电解质外渗,同时促进可溶性物质的增加。
SOD、POD 和CAT 作为植物体内重要的抗氧化酶,能够清除活性氧、抑制MDA 积累,维持体内氧代谢平衡,保持细胞的稳定性和完整性。在植物的正常发育过程中,植物体内活性氧的产生与清除处于平衡状态,不会使细胞遭受氧化损害。姜秀梅[36]研究发现:Pro 可通过线粒体电子传递链诱导植物体内抗氧化酶活性增强和保护蛋白含量增加,同时启动抗低温代谢途径,从而缓解植物遭受的低温伤害。本研究中,壳聚糖处理丝瓜幼苗可提高低温下叶片的Pro 含量和抗氧化酶活性,降低MDA 含量,表明壳聚糖对低温处理具有缓解作用。该结论与前人对草莓[13]和水稻[37]的研究结论一致,即低温处理下,喷施壳聚糖可通过提高叶片的抗氧化酶活性和降低MDA含量来提高植物的耐冷性。壳聚糖可能增强了丝瓜幼苗清除活性氧的能力,缓解了其在细胞膜系统上诱发的膜脂过氧化作用,从而保护细胞膜结构的完整性,减缓丝瓜幼苗的氧化损伤。
矿质元素作为植物体的组成成分,参与植物的各种生理代谢,是维持植物生命活动所需的物质。低温导致植物体内部分矿质元素的运输受阻,本研究中,与常温对照相比,低温使得丝瓜幼苗叶片中N 和P 元素含量下降,该结果与低温胁迫对番茄[34]和黄瓜[7]幼苗矿质元素含量的影响一致,分析其原因可能是低温直接影响根系生长,从而影响对矿质元素的吸收或使叶片蒸腾作用减弱,导致矿质元素运输减慢[38]。施用壳聚糖后丝瓜幼苗的N 和P 含量增加,说明壳聚糖能缓解低温对矿质元素吸收和运输的影响。
4 结论
叶面喷施壳聚糖可增加丝瓜幼苗叶片的叶绿素含量,提高对光能的吸收和转化,有利于其光合作用;可通过提高抗氧化酶活性、增加渗透调节物质含量以及降低叶片相对电导率和MDA 含量维持叶片细胞结构完整和增强丝瓜幼苗的耐冷性;可提高对矿质元素的吸收。其中,以25 mg/L壳聚糖处理效果最好。本研究结果为壳聚糖的实际应用提供了理论基础。

