油茶根际土壤真菌群落组成及多样性分析
罗鑫, 吴跃开, 张念念, 许杰, 杨再华
(贵州省林业科学研究院,贵阳 550005)
根际土壤微生物(rhizosphere soil microorganism)种类繁多,是根际微生态系统(rhizosphere microecosystem)的重要组成部分[1]。其中,根际土壤真菌(rhizosphere soil fungi)对植物摄取营养物质、促进生长发育、提高宿主植物抗病性以及维持根际微生态系统平衡等起重要调节作用[2-3]。在根际微生态系统中,土壤理化性质的差异会影响根际土壤真菌群落的组成和数量,且在不同植物种类下两者关系复杂多样。吴佳伟等[4]研究表明灌木林、草坡、湿地3种植被的根际土壤真菌多样性与土壤全氮、全钾和速效钾含量呈显著相关。魏世清等[5]研究指出油茶林根际土壤真菌数量与速效钾含量呈显著正相关,与有机质、有效磷、速效氮呈极显著正相关。可见,植物根际土壤真菌多样性及数量与土壤环境因子存在一定的相关性,但其真菌群落组成与土壤环境因子的关系尚不明确。
油 茶(Camellia oleiferaAbel.)为 山 茶 科(Theaceae)山茶属(Camellia)的常绿小乔木,是我国南方特有的纯天然高级优质油料。油茶中提取的茶籽油具有很高的营养价值,在工业、旅游文化、生态和食品等方面具有不可估量的经济价值[6]。油茶在我国已有2 300年的栽植历史,其中,贵州以得天独厚的山区环境成为我国主要的油茶产出省份,油茶种植面积达17.56×104hm2,在天柱、玉屏、黎平、望谟和册亨等多地区拥有代表性的油茶产业基地[7]。目前,贵州油茶种植已具备一定规模,但近年来多处油茶林频发茶饼病、炭疽病、软腐病等病害,致使油茶品质和产量下降,一定程度上影响了贵州油茶产业。因此,急需通过对油茶林生长环境进行探究,明确土壤微生物对油茶生长和病害的影响。
目前,油茶的相关研究主要集中在植物病原菌的鉴定和活性物质的提取,有关根际土壤微生物多样性的研究虽已有少许[8-10],但其与土壤环境因子的相关性研究却鲜见报道。因此,本研究通过高通量测序,对贵州不同地区油茶根际土壤真菌的群落组成及多样性进行分析,并进一步探究油茶根际土壤真菌组成与土壤环境因子的关系,以期为开发有益的油茶根际微生物资源、调控土壤环境因子预防油茶病害提供科学依据。
1 材料与方法
1.1 油茶根际土壤的采集
于2020 年9 月4—10 日,分别在贵州省贵阳(Guiyang,GY)、天柱(Tianzhu,TZ)、玉屏(Yuping,YP)、望谟(Wangmo,WM)、威宁(Weining,WN)、黎平(Liping,LP)、册亨(Ceheng,CH)7个地区采集油茶根际土壤样品,采样地信息详见表1。每个采样点随机选择4 棵长势相近且健康的6 年生油茶树,每棵树之间距离大于20 m。去除表面枯叶及杂质,沿油茶树主根垂直地面向下挖取至油茶根系,再以主根为中心向外挖取至35~40 cm 细根发达的根系,在东南西北四周均收集地面以下10—20 cm 深度的植物细根土壤共500 g,装入无菌塑封袋中充分混匀,迅速置于冰盒中保存并带回实验室。将采集到的土壤样品分成2份,其中1份置于-80 ℃超低温冰箱中保存,用于提取土壤真菌DNA;另1 份土壤置于常温下阴干后,一部分过0.25 mm孔径筛用于测定土壤pH及有机质、全氮、全磷和全钾含量,另一部分过2 mm孔径筛的土壤用于测定碱解氮、有效磷、速效钾含量。

表1 油茶根际土壤采样地点及信息Table 1 Sampling sites and information of C. oleifera rhizosphere soil
1.2 土壤理化性质测定
根据鲍士旦[11]的方法测定土壤理化性质。土壤pH 采用点位测定法;有机质(organic matter,OM)含量采用油浴加热重铬酸钾氧化法;全氮(total nitrogen,TN)含量采用碱解扩散法+半微量开氏法;全磷(total phosphorus,TP)含量采用消煮液+钼锑抗比色法;全钾(total potassium,TK)含量采用消煮液+ 火焰光度法;碱解氮(alkali hydrolyzed nitrogen,AN)含量采用碱解扩散法+半微量开氏法;有效磷(available phosphorus,AP)含量采用碳酸氢钠浸提+钼锑抗比色法;速效钾(available potassium,AK)含量采用乙酸铵浸提+火焰光度法。每个样品重复4次。
1.3 土壤真菌群落组成及多样性分析
1.3.1 DNA 提取与测序 根据CTAB 法[12]对土壤样品进行总DNA 的提取。利用引物ITS1F(5'-CTTGGTCATTAGAGAGAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCTCTCGATGGC-3')进行ITS 序列扩增。PCR(ABI GeneAmp®9700 型)扩增采用TaKaRarTaqDNA 聚合酶和20 μL 反应体系:10×Buffer 4 μL,dNTPs(2.5 mmol·L-1)2 μL,正向引物ITS1F(5 μmol·L-1)0.8 μL,反 向 引 物ITS2R(5 μmol·L-1)0.8 μL,rTaq聚 合 酶0.2 μL,BSA 0.2 μL,模板DNA 10 ng,随后添加ddH2O至20 μL。PCR 程序:95 ℃ 180 s;98 ℃ 30 s,55 ℃ 30 s,72 ℃45 s,35个循环;72 ℃ 10 min,4 ℃保存。PCR 产物经上海美吉生物医药科技有限公司Illumina Hiseq 平台进行高通量测序,而后于I-Sanger 生物信息分析云平台(http://www.i-sanger.com/)进行数据处理和根际土壤真菌多样性分析。
1.3.2 序列处理与组成分析 利用FLASH 将所有原始序列数据依次进行过滤、拼接、剔除嵌合体后获得有效序列。通过平台QIIME(http://qiime.org/scripts/assign_taxonomy.html)将识 别 阈 值在97% 以上的序列聚类为操作分类单元(operational taxonomic units,OTU)[13]。从每个OTU中选择最丰富的序列作为该OTU 的代表性序列,计算出每个OTU 在各个样品中的相对丰度(relative abundance),并在Unite(http://unite.ut.ee/index.php)真菌数据库进行物种注释,获得每个OTU 在各级(界、门、纲、目、科、属、种)分类水平信息[14]。所有样本的数据按最小序列数41 857抽平后,再进行后续多样性分析。采用单因素方差分析(one-way,ANOVA)比较不同地区间丰度分布存在差异的物种,多重比较采用Tukeykramer 检验差异性显著水平。真菌组成以及物种差异均使用R 3.5.0 软件进行绘制。
1.3.3 多样性分析 Alpha 多样性分析采用Mothur(http://www.mothur.org/wiki/Schloss SOP#Alpha diversity)指数分析程序包计算各样本的Shannon指数、Simpson指数、ACE指数和Chao 1指数,并用t检验进行差异显著性检验[15]。Beta多样性分析通过非加权组平均法(unweighted pair-group method with arithmetic,UPGMA)聚类样品OTU,基于unweighted unifrac距离算法下对样品在门水平上进行聚类,并获得层级聚类树。通过非度量多维尺度(nonmetric multi-dimensional scale,NMDS)分析检验真菌在属水平群落组成的差异,同时利用相似性分析(analysis of similarities,ANOSIM)检验不同地区间样本差异是否显著大于同一地区内样本差异[16]。
1.4 数据分析
采用SPSS 20.0 软件进行数据的统计分析。利用R 软件的冗余分析(redundancy analysis,RDA)研究油茶根际土壤真菌相对丰度前10 的类群、土壤环境因子以及土壤样本三者间的关系,并利用envfit 函数检验土壤环境因子间关系的显著性;同时将根际土壤真菌群落丰度与土壤环境因子进行相关性分析。
2 结果与分析
2.1 油茶根际土壤的理化性质
7 个地区油茶根际土壤的理化性质如表2 所示,各地区土壤均呈酸性,pH 4.35~4.79。依据全国第二次土壤普查养分分级标准[17],威宁地区土壤有机质、全氮、全磷含量均达到Ⅰ级,为极丰富水平;黎平地区土壤中有机质、全氮、全磷和碱解氮含量达到Ⅳ或Ⅴ级,呈适宜至缺乏之间水平。土壤中全钾含量最高是玉屏地区,处于Ⅲ级最适水平;其次为册亨和望谟地区。有效磷和速效钾含量最高的分别是贵阳和天柱地区,但贵阳地区土壤的有效磷含量仅为Ⅳ级(适宜水平),而天柱地区速效钾含量则处于Ⅱ级(丰富水平)。由此表明,7 个地区间油茶根际土壤具有不同的理化性质特征。
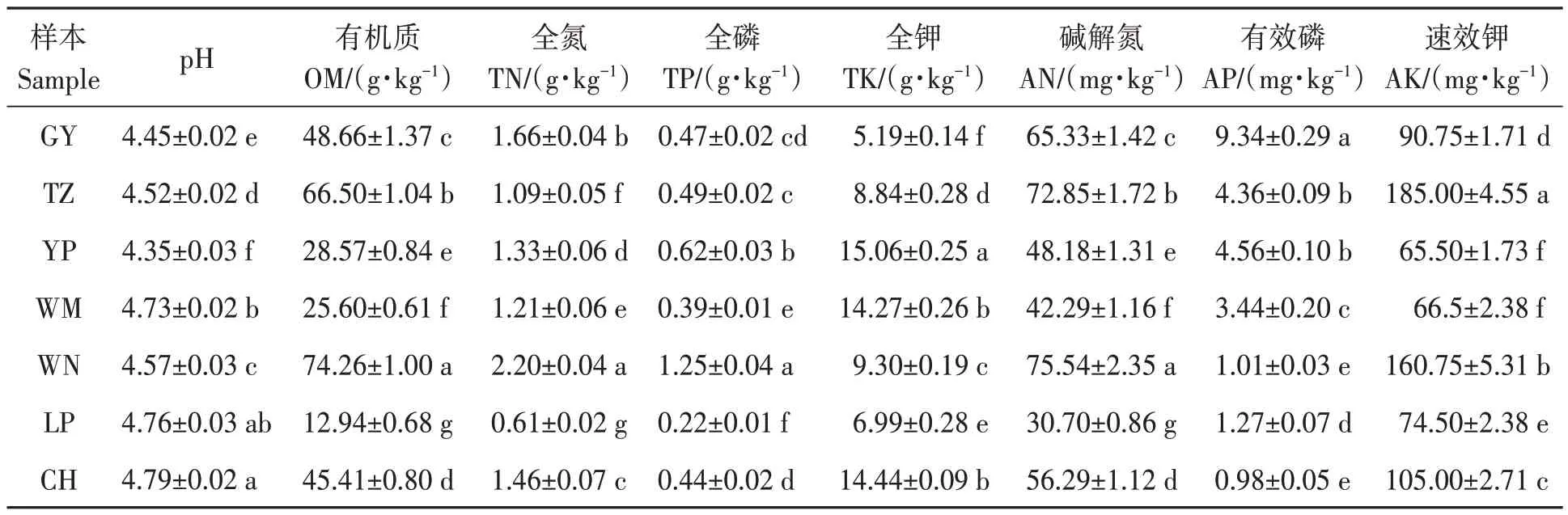
表2 不同地区油茶根际土壤的理化性质Table 2 Physicochemical properties of C. oleifera rhizosphere soil from different regions
2.2 测序结果与Alpha多样性分析
经Illumina Miseq 高通量测序后,7 个地区的土样中共获得1 959 963 条有效ITS 序列(表3)。基于97%相似度水平下,共聚成了634 个OTUs。覆盖度达99.90%~99.97%,表明测序结果基本覆盖了样本中绝大多数真菌的生物学信息,能够准确反映油茶根际土壤真菌群落的结构组成及多样性。对于多样性指数(Shannon 指数和Simpson 指数),7 个地区的多样性从大到小依次为望谟>册亨>威宁>天柱>黎平>玉屏>贵阳;对于丰富度指数(ACE 指数和Chao 1 指数),从大到小依次为册亨>天柱>望谟>贵阳>威宁>黎平>玉屏。由此表明,7 个地区的油茶根际土壤真菌群落多样性和丰富度存在差异。
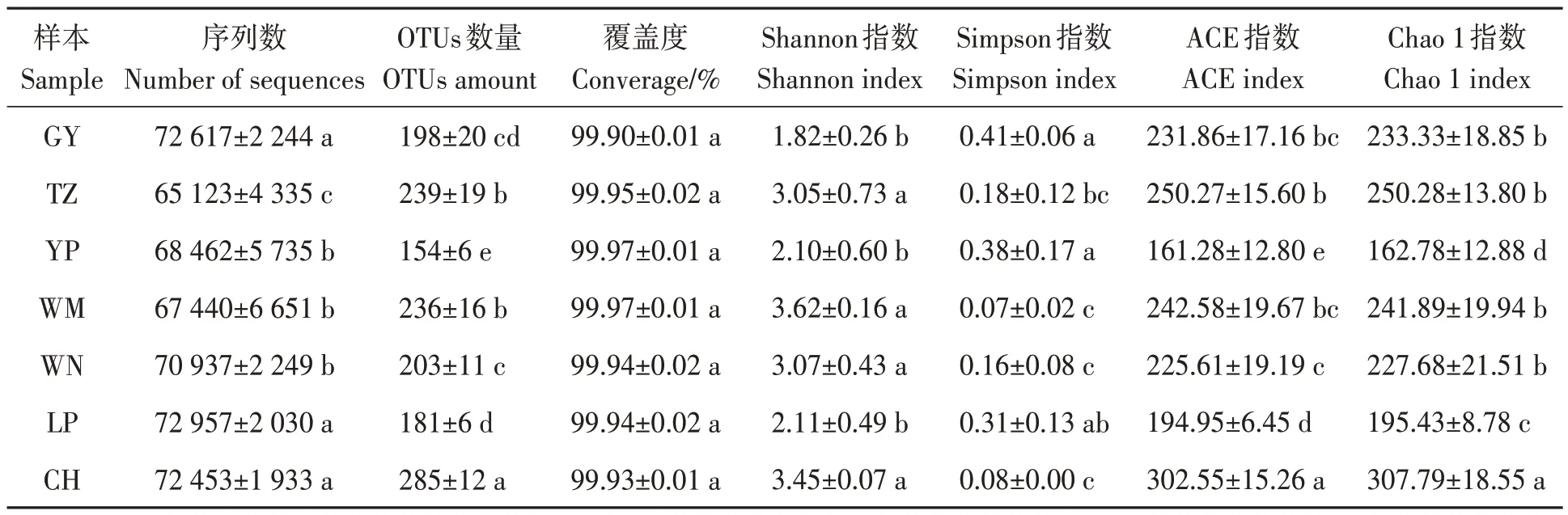
表3 油茶根际土壤真菌ITS测序结果及Alpha多样性Table 3 ITS sequencing results and alpha diversity of rhizosphere soil fungi of C. oleifera
2.3 土壤真菌的Beta多样性分析
使用韦恩图分析7 个地区间共有和特有的OTUs,结果(图1)表明,7 个地区共有的OTUs 为42 个,为各地区特有的OTUs 数量从多到少依次为望谟>册亨>威宁>天柱>贵阳>玉屏>黎平,各地区特有的OTU 数量分别占其总OTU 数量的56.70%、41.67%、40.85%、31.15%、27.59%、12.05%、10.64%。基于门水平的UPGMA 聚类树显示(图2),天柱与玉屏地区的根际土壤真菌群落组成较相似;威宁、贵阳和望谟3个地区的根际土壤真菌群落结构较相似;而黎平地区与其他地区的土壤真菌组成差异较大。
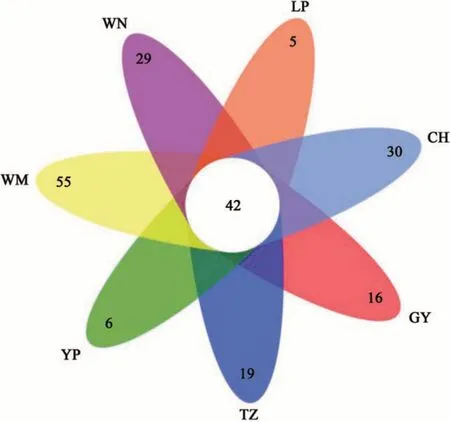
图1 OTUs数量韦恩图Fig. 1 Venn profile of OTU number
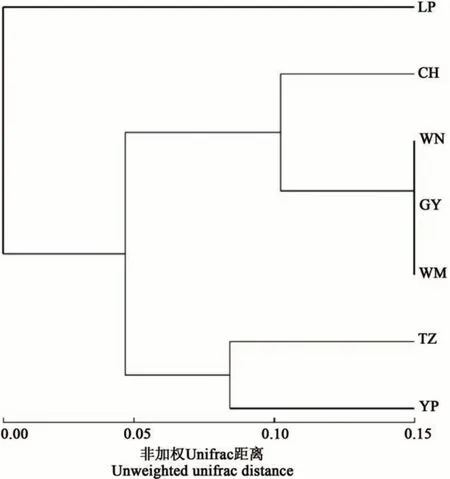
图2 油茶根际土壤真菌在门水平上的UPGMA聚类树Fig. 2 UPGMA cluster tree of fungi in the rhizosphere soil of C. oleifera at phylum level
基于unweighted unifrac 距离在属水平上的NMDS 分析(图3)表明,7 个地区的油茶根际土壤真菌群落组成存在显著差异(P=0.001),即不同地区的土壤样品具有分组意义。且ANOSIM(图4)表明,组间的距离显著大于各地区的土壤样本。综上所述,各地区间油茶根际土壤真菌群落组成差异显著。
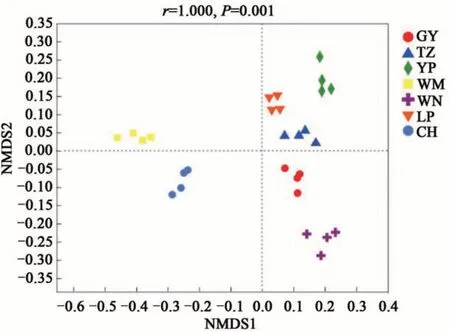
图3 基于非加权unifrac距离算法下油茶根际土壤真菌在属水平上的NMDS分析Fig. 3 NMDS analysis of rhizosphere soil fungi form C.oleifera based on unweighted unifrac algorithm
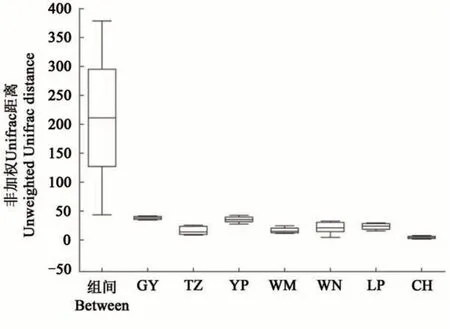
图4 ANOSIM分析距离盒状图Fig. 4 Anosim analysis distance box diagram
2.4 土壤真菌的群落组成及物种分布差异分析
7 个地区的油茶根际土壤真菌测序所获得的634个OTUs隶属于9门、32纲、73目、141科、213属。在门水平上,包含子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被 孢 霉 门(Mortierellomycota)、Rozellomycota、球囊菌门(Glomeromycota)、毛霉门(Mucoromycota) 、壶 菌 门(Chytridiomycota) 、Zoopagomycota 和Calcarisporiellomycota(图5)。玉屏地区根际土壤真菌优势门为担子菌门(61.71%);而其余6个地区根际土壤真菌的优势菌门均为子囊菌门(54.00%~83.62%)。不同地区在门水平上的组成和相对丰度存在差异,其中,子囊菌门在贵阳地区油茶根际土壤中的相对丰度较高,为83.62%;担子菌门在玉屏地区油茶根际土壤中的相对丰度较高,为61.71%;被孢霉门在天柱地区油茶根际土壤中的相对丰度较高,为24.02%;Rozellomycota在黎平地区油茶根际土壤中的相对丰度较高,为7.67%。
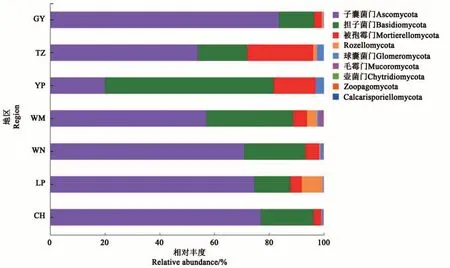
图5 油茶根际土壤真菌在门水平上的组成及相对丰度Fig. 5 Composition and relative abundance of fungi in rhizosphere soil of C. oleifera at phylum level
在属水平上,除未能分类到属的真菌类群外,7 个地区均检测到沙蜥属(Saitozyma)、Archaeorhizomyces、被 孢 霉 属(Moretierella)、Clavaria、青 霉 属(Penicillium)、木 霉 属(Trichoderma)、篮状菌属(Talaromyces)、瓶霉属(Cladophialophora)、枝孢菌属(Cladosporium)和Geminidasidium(图6)。同时,不同地区间油茶根际土壤真菌的组成和相对丰度也存在差异,贵阳、天柱、玉屏和望谟地区根际土壤真菌的优势菌属为沙蜥属,其相对丰度依次为11.18%、14.75%、59.11%和17.61%;而威宁地区的优势菌属为Archaeorhizomyces,相对丰度为38.13%;册亨地区的优势菌属为Trichoglossum,相对丰度为10.26%。此外,Trichoglossum和Cuphophuyllus是册亨地区油茶根际土壤中的特有菌属,相对丰度分别为10.26%和8.49%;Ilyonectria为望谟地区的特有菌属,相对丰度为2.65%;Sebacina和Tomentella为威宁地区的特有菌属,相对丰度分别 为 1.85% 和 1.60%;Coniosporium和Metschnikowia为天柱地区的特有菌属,相对丰度分别为1.03%和1.00%;而贵阳和黎平地区未发现特有菌属。

图6 油茶根际土壤真菌在属水平上的组成及相对丰度Fig. 6 Composition and relative abundance of fungi in rhizosphere soil of C. oleifera at genus level
分析在各地区样本间存在显著分布差异的真菌菌属,结果(图7)表明,丰度排前10的菌属分别为沙蜥属、Archaeorhizomyces、被孢霉属、青霉属、Clavaria、木霉属、篮状菌属、瓶霉属、Oidiodendron和Ilyonectria。其中,沙蜥属在玉屏地区根际土壤中的相对丰度显著高于其他地区;Archaeorhizomyces、瓶霉属和Oidiodendron在威宁地区土壤中的相对丰度显著高于其他地区;被孢霉属、木霉属和篮状菌属在天柱地区根际土壤中的相对丰度显著高于其他地区,而青霉属、Clavaria和Ilyonectria在望谟地区土壤中的相对丰度显著高于其他地区。
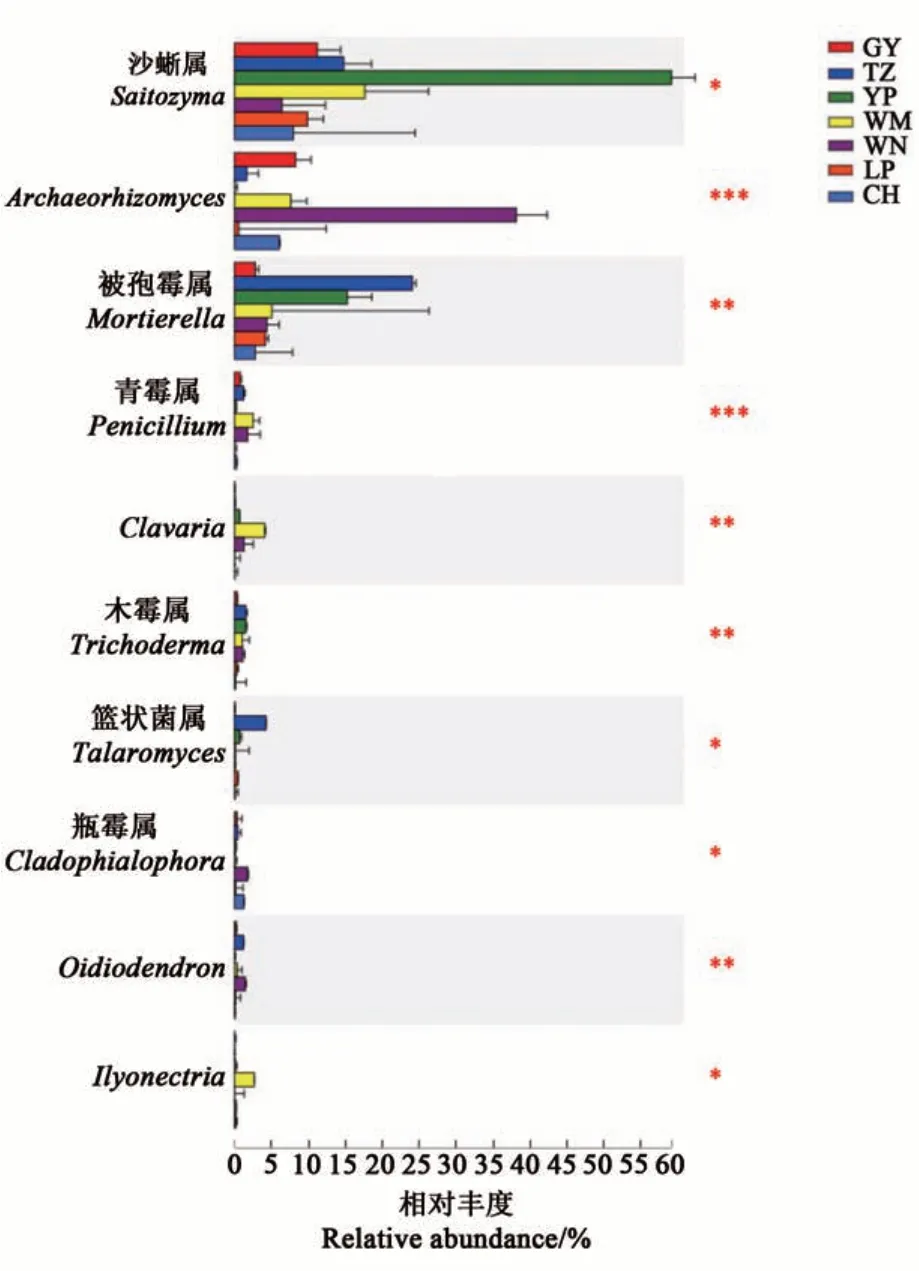
图7 油茶根际土壤真菌的物种差异分析Fig. 7 Differential species analysis of fungi in the rhizosphere soil of C. oleifera
2.5 土壤真菌与土壤环境因子的相关性分析
对油茶根际土壤样品中相对丰度排前10 位的真菌菌属与土壤环境因子进行RDA 分析,结果(图8)显示,第1、第2轴的解释率分别为44.08%和22.21%,累计总解释率达66.29%,表明该结果较好地反映了真菌群落与土壤环境因子之间的相互关系。土壤环境因子对油茶根际土壤真菌群落的影响从大到小依次为:全钾>有效磷>速效钾>有机质>全磷>碱解氮>全氮>pH。Cuphophyllus、Trichoglossum、Archaeorhizomyces等菌属均与土壤全磷、全氮、碱解氮、有机质、速效钾含量及土壤pH 呈正相关,与土壤有效磷含量呈负相关;而被孢霉属和沙蜥属与土壤有效磷含量呈正相关,与土壤全磷、全氮、碱解氮、有机质、速效钾含量及土壤pH 呈负相关。沙蜥属、被孢霉属、Cuphophyllus和Trichoglossum与土壤全钾含量呈正相关;而Archaeorhizomyces与土壤全钾含量相关不显著。经显著性检验(表4)表明,土壤全钾、有效磷、速效钾和有机质含量对真菌群落结构影响显著。由此表明,土壤全钾、有效磷、速效钾和有机质含量是影响油茶根际土壤真菌群落组成的主要因子。
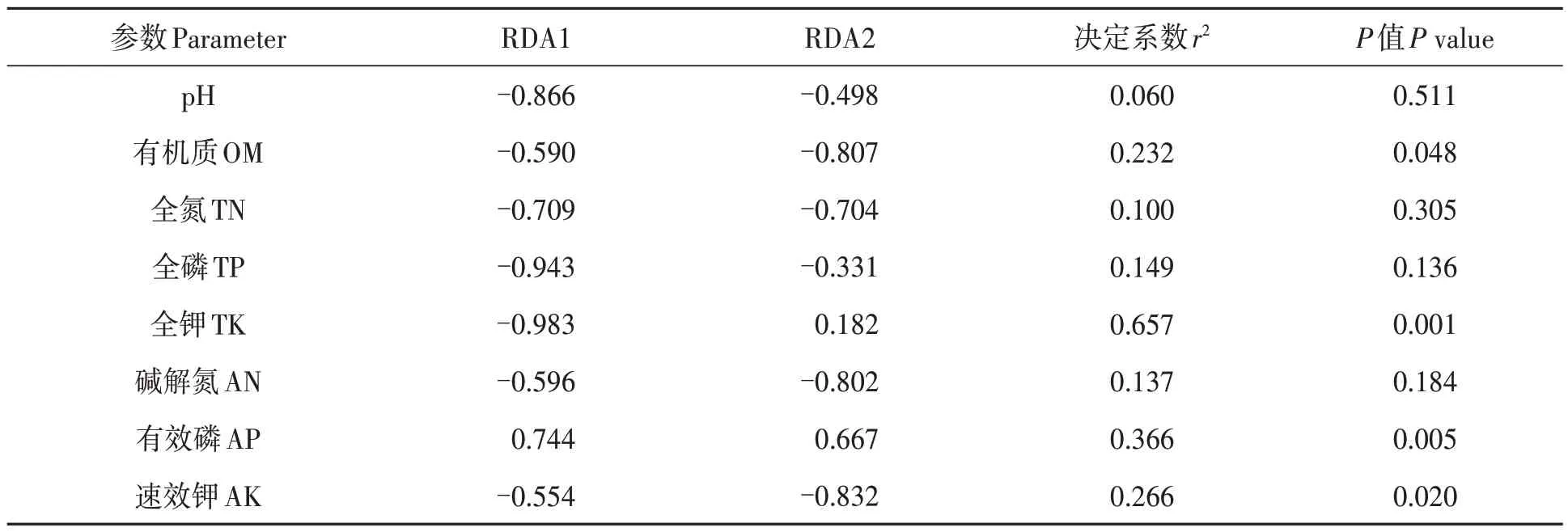
表4 前10优势真菌类群与土壤环境因子envfit函数检验Table 4 Envfit permutation function test of top ten dominant fungal groups and soil environmental factors

图8 前10优势真菌类群与土壤环境因子在属水平上的RDA分析Fig. 8 RDA analysis of top ten dominant fungal groupsand soil environmental factors in C. oleifera rhizosphere soil at genus level
Spearman 相关分析(图9)显示,Ilyonectria与土壤pH呈极显著正相关,与土壤有机质、全磷和碱解氮含量呈极显著负相关;Archaeorhizomyces与土壤全氮含量呈极显著正相关;篮状菌属和假黑孢霉(Coniosporium)与土壤全氮含量呈极显著负相关;镰刀菌属(Fusarium)与土壤pH 呈显著正相关,与有机质、全氮、全磷和碱解氮含量呈显著负相关;沙蜥属与土壤有效磷含量呈显著正相关;Cuphophyllus和Cladophialophora与土壤有效磷含量呈显著负相关;Cladophialophora和Oidiodendron与土壤速效钾含量呈极显著正相关;沙蜥属、Ilyonectria和与土壤速效钾含量呈显著负相关。

图9 属水平物种丰度与土壤环境因子的Spearman相关性分析Fig. 9 Spearman correlation analysis of species abundance and soil environmental factors at genus level
3 讨论
油茶喜好有机质和养分丰富的酸性(pH 5.0~6.5 )土壤,但也具有一定的耐干旱瘠薄特性[18]。本研究中,威宁、天柱、贵阳和册亨4 个地区油茶土壤的有机质含量达Ⅰ级;玉屏和望谟地区油茶土壤有机质含量达Ⅲ级;黎平地区则处于Ⅳ级。总体上看,各个地区土壤的有机质含量丰富,且呈酸性,这与油茶的生长习性相吻合。另外,7 个地区的油茶均栽植于丘陵或者斜坡地带,其中,天柱和册亨两地的健康油茶长势优越,这2个地区分别位于贵州的东南和西南,与马帅兵等[19]提出的贵州油茶的最适宜栽培区主要分布在东部和南部地区相一致。7 个地区土壤的碱解氮含量均处于Ⅳ级和Ⅴ级(适宜但偏缺乏水平),有效磷含量多处于Ⅴ级至Ⅵ级之间(缺乏水平),速效钾含量均处于Ⅱ级到Ⅳ级之间(丰富水平),表明油茶根际土壤呈现少氮、低磷、富钾的状态。而7个地区间土壤的全氮、全磷和全钾含量存在显著差异,这可能与不同地区的立地土壤条件不同有关。
根际土壤真菌具有降解有机质、释放营养和微量元素及调控土壤养分的作用,在促进植物生长过程中扮演着重要角色[20-21]。本研究中7 个地区油茶根际土壤真菌均具有丰富的多样性,但真菌多样性与群落组成具有差异。研究表明,根际土壤真菌的组成及多样性受植物种类和土壤环境等多种因素影响[22-23]。本研究表明,子囊菌门和担子菌门在油茶根际土壤中的相对丰度较高,可能是由于子囊菌门可分解土壤中腐烂的动植物遗骸,释放有机物供植物吸收利用;而担子菌门可与植物共生形成菌根,有利于植物生长发育[24]。在属水平组成上,沙蜥属、Archaeorhizomyces、被孢霉属和Clavaria等普遍存在于7 个地区的油茶根际土壤中,与傅海平等[25]的研究结果有部分相似,而与其他物种植物差异较大[26-27]。在不同地区间表现出显著差异的菌属中,木霉属具有降解木质素的功能,而青霉属可产生有机酸代谢产物溶解土壤中的无机磷,从而调节土壤肥力,间接影响植物生长[28]。由此表明不同地区油茶根际土壤理化性质的差异一定程度上可能受到功能性土壤真菌分布差异的影响。另外,被孢霉属可与根际微生物互作,在植物代谢、繁殖和抗逆性中发挥重要作用,是影响油茶生长和品质的重要真菌[29]。可见,油茶根际土壤真菌的分布差异可能是土壤环境与微生物间互作的结果[30]。然而,土壤环境与土壤中微生物的互作对影响根际土壤微生物的组成分布是否具有协同效应还需要进一步研究。
土壤是根际土壤真菌赖以生存的环境,其环境因子与根际土壤真菌有着密切联系。土壤环境因子制约着根际土壤真菌群落的种类和数量,而环境因子的变化又受到根际土壤真菌种类和数量的影响[31-32]。本研究显示,油茶根际土壤的全钾、有效磷、速效钾和有机质含量是影响根际真菌群落组成的主要因子,说明这些土壤因子对于7 个地区土壤真菌的群落组成和丰度起着重要作用。Spearman 相关性分析表明,Archaeorhizomyces、青霉属与土壤碱解氮含量呈显著正相关;沙蜥属、被孢霉属与有效磷含量呈正相关;Cladophialophora、Oidiodendron与速效钾含量呈极显著正相关。由此表明,可通过施用相关的微生物氮肥、磷肥、钾肥提高土壤养分,促进油茶生长[33]。在本研究中,沙蜥属和被孢霉属是油茶根际土壤中丰度较高的优势菌属,但各地区土壤中有效磷含量并不高,推测可能是由于在植物根系吸收的同时部分土壤微生物在增殖和定植于植物根系过程中也吸收了土壤中大量的磷元素[34]。研究表明,Ilyonectria可引发多种植物患病,镰刀菌属也是土壤中常见的致病菌[35-36]。对于缺乏有机质以及氮磷钾的土壤,植物由于养分获取不足,抗性下降,为土壤中病原菌的侵害提供了机会[37]。本研究发现Ilyonectria与土壤pH 呈极显著正相关,与土壤有机质、全磷和碱解氮含量呈极显著负相关;镰刀菌属与土壤pH 呈显著正相关,与有机质、全氮、全磷和碱解氮含量呈显著负相关。这表明Ilyonectria和镰刀菌属在油茶根际土壤真菌群落中的丰度变化具有潜在的致病风险。因此,及时关注土壤pH 变化、调控土壤中有机质及氮磷钾含量可成为预防和监控油茶病害的有效途径。本研究结果为油茶根际土壤真菌与土壤环境因子相关性研究提供了新的结论,并为开发微生物菌肥资源和调控土壤环境因子预防植物病害奠定了科学研究基础。

