海分枝杆菌调控巨噬细胞糖酵解重编程的研究
肖 雄 糜自豪 刘亭亭 王 艺 张 园 王 川 孙乐乐 时培殿 刘 红 张福仁
山东第一医科大学附属皮肤病医院(山东省皮肤病医院),山东省皮肤病性病防治研究所,济南,250022
海分枝杆菌是引起人类机会性感染的最常见的非结核分枝杆菌之一。海分枝杆菌感染可引起皮肤溃疡和肉芽肿性病变,感染严重时可导致腱鞘炎、关节炎和骨髓炎等,其病理改变主要是巨噬细胞及其衍生细胞异常增生并在感染部位聚集[1]。此外,海分枝杆菌感染患者的药物治疗时间3周~2年不等,平均治疗时间140天,这严重影响了患者的身心健康[2]。
免疫代谢指免疫细胞的代谢情况决定着自身的命运,代谢重编程与免疫细胞功能密切相关[3]。免疫细胞的代谢方式主要有糖代谢、脂质代谢和氨基酸代谢。其中,糖酵解代谢是指葡萄糖经相关酶(HK2、LDHA等)催化分解为乳酸同时产生少量ATP的过程。免疫细胞糖酵解代谢与癌症、肥胖、糖尿病等代谢综合征密切相关[3-5]。近年来,研究发现糖酵解与感染性疾病的发生、发展有关,其中分枝杆菌中以结核分枝杆菌感染重编程巨噬细胞糖酵解的研究为最多。研究表明感染结核分枝杆菌的巨噬细胞通过上调葡萄糖转运蛋白受体(GLUT-1)基因SLC2A1的表达增加了葡萄糖的摄取,同时也增加糖酵解关键基因HK2(编码关键酶HK2:催化糖酵解第一步葡萄糖转化为葡萄糖-6-磷酸)和LDHA(编码关键酶LDHA:催化糖酵解最后一步丙酮酸转化为乳酸)的表达[6-8]。与此同时,上调的糖酵解对巨噬细胞抵御结核分枝杆菌感染至关重要[9]。但是,国内外罕有报道海分枝杆菌感染对其最主要宿主细胞巨噬细胞糖酵解调控的系统研究。
因此本研究利用海分枝杆菌感染小鼠骨髓来源巨噬细胞(bone marrow derived macrophage,BMDM),通过对糖酵解代谢相关基因的表达和糖酵解最终产物乳酸的产生进行检测,系统地研究了海分枝杆菌对巨噬细胞糖酵解代谢的调控。
1 材料和方法
1.1 伦理声明 本研究经山东第一医科大学伦理委员会批准,并获得参与者的知情同意。
1.2 细胞培养 C57BL/6野生型小鼠(中国,集萃药康)BMDM的分离:脱臼处死小鼠,75%酒精浸泡10 min。生物安全柜中分离出小鼠股骨和胫骨,剔除骨头两端,无菌胰岛素注射器吸取2 mL的DMEM培养基冲洗股骨和胫骨两端各三次。收集冲洗后的培养基(美国,ATCC),70 μm细胞筛过滤。取过滤后的培养基,500 rpm离心5 min,弃上清,加入5 mL的DMEM培养基(美国,ATCC)重悬。用默克ScepterTM3.0细胞计数仪计算细胞浓度。
BMDM培养:将BMDM以5×105个/mL均匀铺入24孔板中,加入终浓度20 ng/mL的巨噬细胞集落刺激因子(M-CSF)(美国,R&D)诱导分化6天后进行实验(37℃,5% CO2)。培养基为DMEM培养基(美国,ATCC),添加1%青霉素-链霉素(Penicillin-Streptomycin)(美国,Gibco)和10%胎牛血清(FBS)(美国,Gibco)。
1.3 分枝杆菌的培养和感染 分枝杆菌培养:海分枝杆菌为荷兰莱顿大学Annemarie H. Meijer教授惠赠的表达红色荧光蛋白mCherry的海分枝杆菌菌株Mycobacteriummarinum(Mma20)。减毒牛型分枝杆菌(BCG)为济宁医学院的刘昂副教授赠送。Mma20和BCG培养在细胞培养瓶中,培养瓶置于恒温振荡培养箱中(上海,知楚),温度为32℃,振荡速度为100 rpm。培养基为分枝杆菌即用型液体完全培养基(上海,晶诺)。海分枝杆菌表达红色荧光蛋白,在海分枝杆菌培养瓶中加入终浓度为50 μg/mL的潮霉素B(北京,索莱宝)维持其自发荧光。超声细菌分散计数仪(宁波,新芝)测量分枝杆菌浓度。
分枝杆菌感染:分枝杆菌感染巨噬细胞3 h,收集细胞培养板中的上清液13000 rpm离心10 min,用无菌PBS(中国,逍鹏)洗涤细胞培养板2次去除细胞培养板中残留的细菌。小心吸取离心后的培养基,并将无细菌的培养基上清加回原培养孔中。对于热灭活分枝杆菌,在恒温水浴锅中99℃,30 min热灭活Mma20(HK-Mma20)后感染巨噬细胞。
1.4 乳酸测量 感染指定时间后的上清液通过10 kd截留分子量过滤管(美国,millipore)过滤,以13000 rpm离心10 min去除上清液中的乳酸脱氢酶。按照厂家说明书使用乳酸比色法测定试剂盒(MAK064)(美国,Sigma-Aldrich)测定上清液中的乳酸浓度。
1.5 总RNA提取及实时荧光定量聚合酶链反应(qPCR)分析 使用Eastep® Super总RNA提取试剂盒从感染的巨噬细胞中提取总RNA(美国,Promega)。使用GoScriptTMReverse Transcription Mix,Random Primers 试剂盒(美国,Promega)逆转录合成cDNA。实时荧光定量PCR扩增反应采用SYBR Green PCR试剂盒(中国,CWBIO),并用stepone plus荧光定量PCR系统(美国,Applied Biosystems)分析。
1.6 2-脱氧葡萄糖(2-DG)抑制糖酵解的实验 共聚焦显微镜观察细胞内荧光:在10 mM 2-DG(中国,MCE)存在的条件下,Mma20感染巨噬细胞48 h。用蔡司LSM980共聚焦显微镜对巨噬细胞内Mma20的荧光进行观察。
流式细胞术检测细胞内荧光强度:在10 mM 2-DG存在的条件下,Mma20感染巨噬细胞48 h,弃上清,无菌PBS清洗2遍。加入0.25%胰酶(预热37℃)吹打混匀,显微镜下观察到贴壁的巨噬细胞悬浮后立即加入等体积FBS终止反应,收集细胞悬液以500 rpm,离心5 min,弃上清,加入100 μL PBS重悬。在BD流式细胞仪(FACSAriaTMFusion)上使用PE通道检测细胞内海分枝杆菌的荧光强度。
1.7 统计学方法 本研究中的所有数据均以(平均值±标准差)表示,并使用Graphpad Prism V.8.0.1软件进行分析。采用双尾学生t检验和非参数Mann-Whitney检验。在所有实验中,P<0.05为差异具有统计学意义。
2 结果
2.1 海分枝杆菌感染导致巨噬细胞糖酵解代谢显著上调 为了解海分枝杆菌感染对巨噬细胞糖酵解的影响,我们研究了海分枝杆菌(Mma20)感染BMDM 24 h后葡萄糖的摄取情况。2-脱氧葡萄糖(2-NBDG)是一种葡萄糖类似物,能竞争性被巨噬细胞摄取,在巨噬细胞中呈现绿色荧光。共聚焦显微镜分析显示感染后的巨噬细胞中2-NBDG的绿色荧光与巨噬细胞吞噬的海分枝杆菌的红色荧光重合,表明巨噬细胞吞噬海分枝杆菌的同时对葡萄糖的摄取增加(图1a~1d)。我们又检测了脂多糖(LPS)、海分枝杆菌(Mma20)和减毒牛型分枝杆菌(BCG)分别感染BMDM后葡萄糖转运蛋白受体(GLUT-1)基因SLC2A1和糖酵解相关酶编码基因(HK2、LDHA)的表达。RT-qPCR分析表明,感染24 h后,感染组中SLC2A1、HK2和LDHA的表达量均显著高于未感染组(图1e~1g)。与此同时,感染后的巨噬细胞上清液中乳酸浓度在24 h后也显著高于对照组(图1h)。以上这些结果表明,海分枝杆菌感染能促进巨噬细胞对胞外葡萄糖的摄取,并诱导巨噬细胞糖酵解重编程。
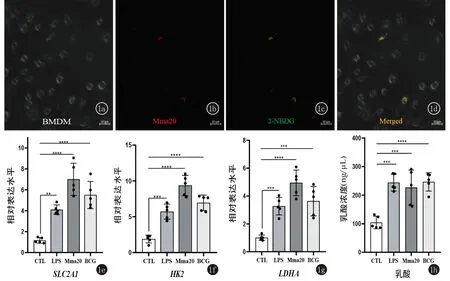
1a~1d: Mma20感染BMDM(MOI = 10,24 h),共聚焦显微镜观察2-NBDG和Mma20的荧光检测葡萄糖的摄取;1e~1g: LPS(100 ng/mL)、Mma20或BCG分别感染BMDM(MOI=10,感染时间24 h),RT-qPCR检测糖酵解相关基因的表达水平;1h: LPS(100 ng/mL)、Mma20或BCG分别感染BMDM(MOI=10,感染时间24 h),细胞外的乳酸含量的检测
2.2 海分枝杆菌以感染时间和感染复数(MOI)依赖的方式增加巨噬细胞的糖酵解代谢 为系统探究海分枝杆菌对巨噬细胞糖酵解代谢的影响,我们对不同感染时间和感染复数条件下的糖酵解变化进行了详细的研究。我们用Mma20分别感染BMDM 24 h、48 h或72 h,并对糖酵解相关基因的表达和培养基中乳酸含量进行检测。结果表明,SLC2A1和LDHA的表达水平随着感染时间的增加而升高,而HK2基因则在感染72 h后表达量显著高于24和48 h(图2a~2c)。同时,我们在相同的时间点检测细胞上清液中乳酸的浓度,感染Mma20的巨噬细胞上清液中乳酸含量随着时间推移也有着显著的差异(图2d)。此外,我们在不同感染复数条件下检测了这些关键基因的表达和代谢物产量。结果显示,SLC2A1、HK2和LDHA的表达和乳酸浓度随着感染复数的增加而升高(图2e~2h)。
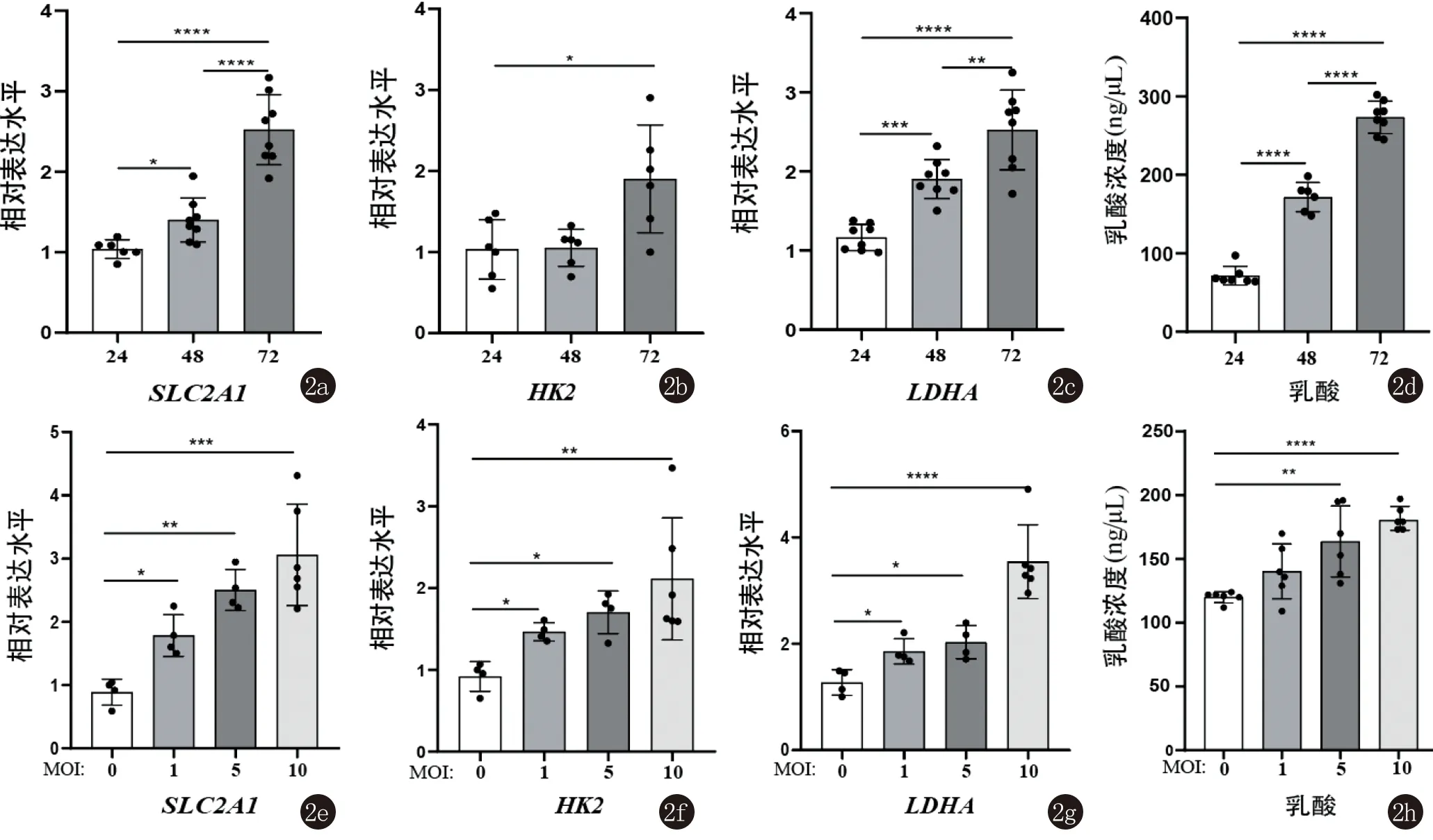
2a~2c: Mma20感染BMDM 24 h、48 h或72 h(MOI=10),RT-qPCR检测糖酵解相关基因的表达水平;2d: Mma20感染BMDM 24 h、48 h或72 h(MOI=10),细胞外乳酸含量的检测;2e~2g: Mma20感染BMDM(MOI = 0、1、5或10,感染时间24 h),RT-qPCR检测糖酵解相关基因的表达水平;2h: Mma20感染BMDM(MOI = 0、1、5或10,感染时间24 h),细胞外乳酸含量的检测
2.3 活的海分枝杆菌可抑制巨噬细胞的糖酵解代谢 有研究表明,与热灭活的结核分枝杆菌相比,活的结核分枝杆菌限制了巨噬细胞糖酵解相关基因的表达和乳酸的产生[10]。为了探索海分枝杆菌感染是否也会有类似的现象,我们比较热灭活的海分枝杆菌(HK-Mma20)和活的海分枝杆菌(Mma20)对BMDM糖酵解的影响,结果发现与HK-Mma20相比,活的Mma20下调了BMDM中SLC2A1、HK2和LDHA的表达水平(图3a~3c)。此外,活的Mma20感染BMDM后乳酸的释放量也显著低于HK-Mma20(图3d)。总之,活的Mma20能一定程度地抑制巨噬细胞糖酵解。
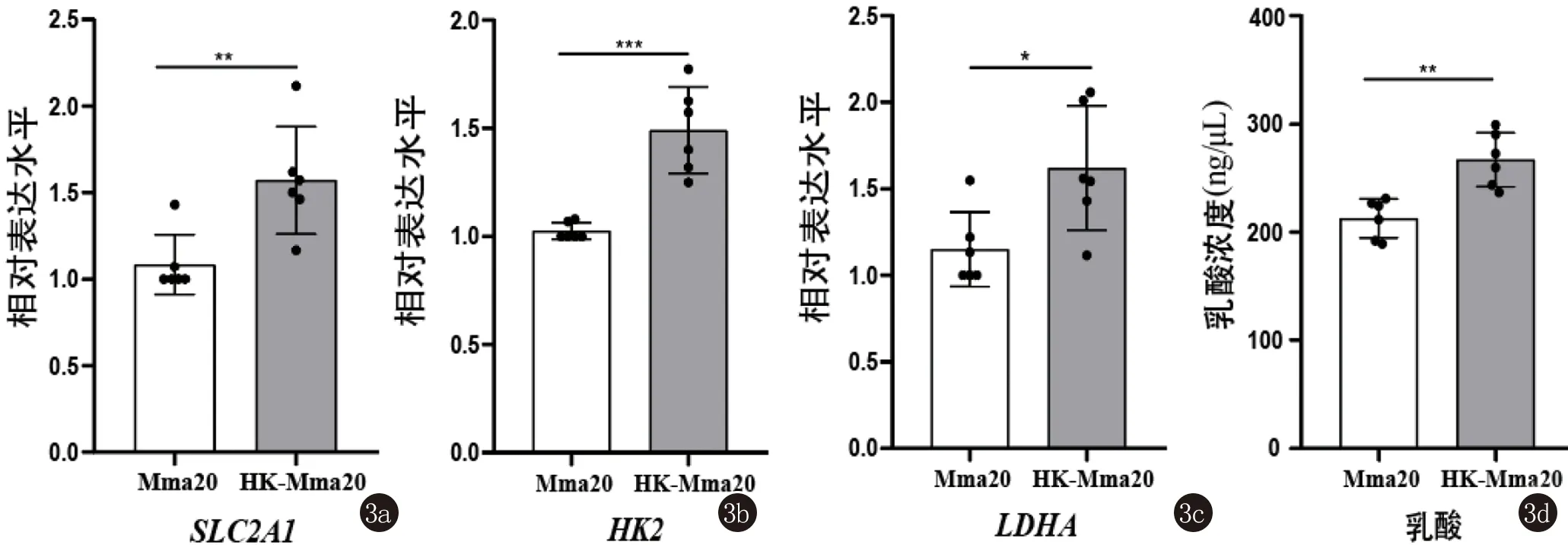
3a~3c:活的Mma20或HK-Mma20分别感染BMDM(MOI=10,感染时间72 h),RT-qPCR检测相关基因的表达水平;3d:活的Mma20或HK-Mma20分别感染BMDM(MOI=10,感染时间72 h),细胞外乳酸含量的检测
2.4 抑制巨噬细胞的糖酵解代谢促进了胞内海分枝杆菌的存活 为探究糖酵解的抑制是否有利于海分枝杆菌的存活,在Mma20感染前3 h,将糖酵解抑制剂2-DG 10 mM加入到BMDM细胞培养板中。2-DG被糖酵解第一步限速酶HK2磷酸化形成2-脱氧葡萄糖-6-磷酸(2-DG-6-P),其不能进一步代谢并经积累抑制糖酵解第一步,它是用于抑制糖酵解的常用分子[4,11]。因Mma20表达红色荧光蛋白mCherry,我们在感染48 h后通过流式细胞仪检测到在2-DG浓度为10 mM条件下mCherry阳性细胞比例和细胞内的荧光强度显著高于未加2-DG的条件下(图4a、4b)。与此同时,我们用共聚焦显微镜观察了感染的BMDM中Mma20的荧光。在加入10 mM 2-DG感染48 h后,BMDM内Mma20荧光强度明显高于未加2-DG的条件下(图4c)。以上结果表明2-DG的处理抑制了巨噬细胞的糖酵解代谢,减弱了细胞的杀菌能力,促进了海分枝杆菌在细胞内的存活。
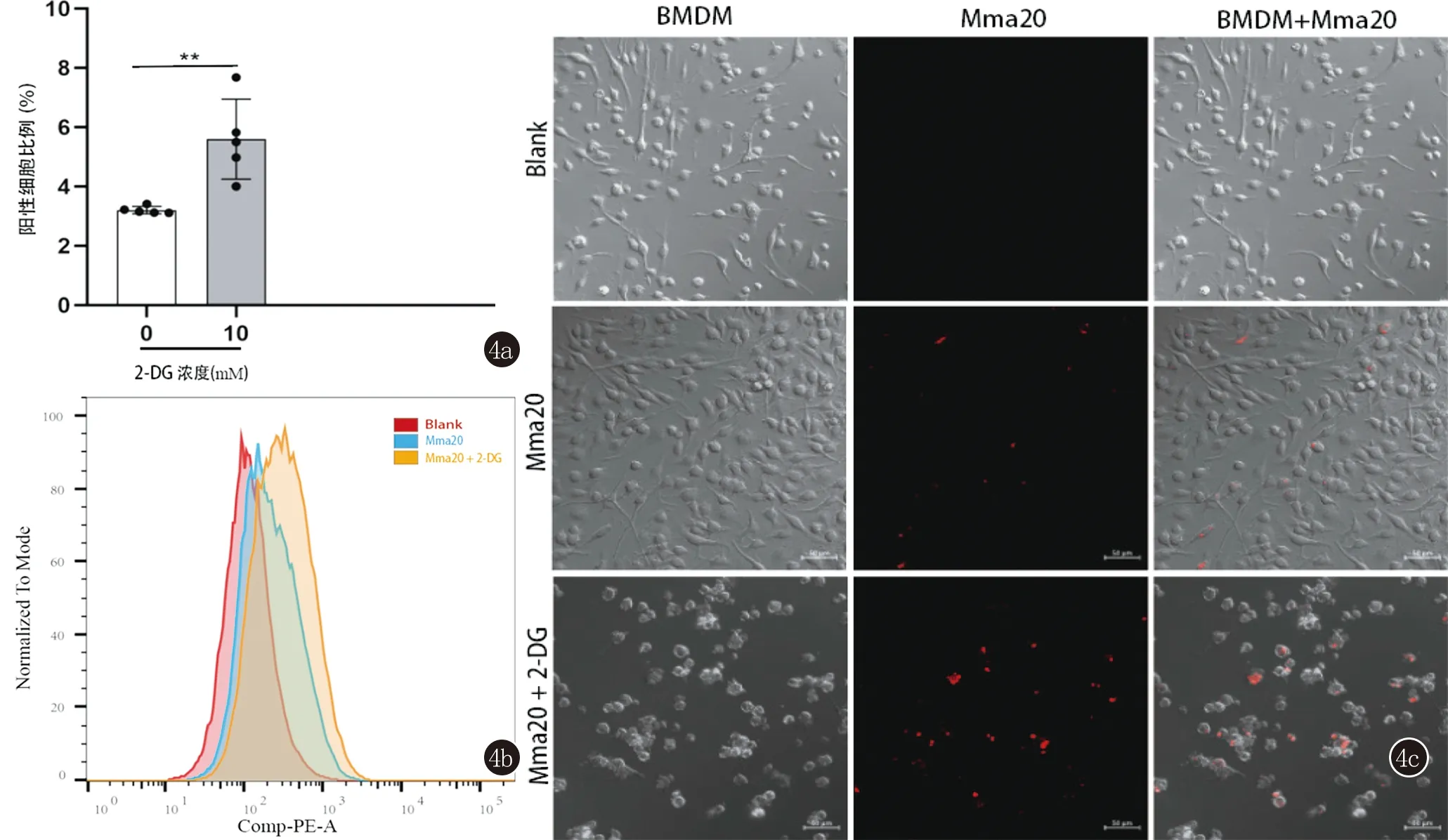
4a、4b:在培养基中加入10 mM 2-DG或不加2-DG条件下,Mma20感染BMDM(MOI=10,48h),流式细胞仪检测阳性细胞比例和细胞内Mma20荧光强度(**表示P<0.01);4c:在培养基中加入10 mM 2-DG或不加2-DG条件下,Mma20感染BMDM(MOI=10,48 h),共聚焦显微镜观察细胞内Mma20红色荧光
3 讨论
本世纪以来共报道三起群体海分枝杆菌感染暴发事件,第一起暴发感染事件发生于2008年,中国江苏一处养鱼场共计18名鱼工感染[12]。第二起暴发感染事件发生于2013-2014年美国纽约鱼市,感染人数总计98例[13]。最近的一起暴发感染事件则发生在2019-2020年山东寿光,217例患者均与鲈鱼传染有关[14]。此外,根据中国医学科学院皮肤病医院2008-2017年的数据报告显示,该院非结核分枝杆菌感染率有明显升高的趋势,其中海分枝杆菌占62.3%[15]。暴芳芳等通过文献检索共发现了2092例海分枝杆菌感染的报道,分布于全世界43个国家,其中美国居世界首位,高达757例,其次为中国441例,本世纪以来世界报道海分枝杆菌感染病例数量总体也呈现增多趋势[2]。
正常条件下细胞内葡萄糖以氧化磷酸化方式产生能量,在缺氧条件下则通过糖酵解途径产生能量,然而Otto Heinrich Warburg发现肿瘤细胞即使在氧气充足的条件下也通过糖酵解途径产生能量。因此,肿瘤细胞将葡萄糖代谢方式从氧化磷酸化转化为糖酵解的过程也被称为Warburg效应,即代谢重编程[16-18]。代谢重编程指细胞通过改变代谢(糖代谢,脂质代谢,氨基酸代谢)模式促进自身存活和生长,这不仅能帮助细胞适应外界环境,还能赋予细胞新的功能[17,19]。近年来,研究发现结核分枝杆菌感染的巨噬细胞也能产生肿瘤细胞类似的代谢重编程的现象[7,9]。而本研究以海分枝杆菌为模型,通过对糖酵解代谢相关基因的表达和乳酸的产生等的检测,系统研究了海分枝杆菌对巨噬细胞糖酵解的重编程现象,这和结核分枝杆菌感染巨噬细胞的糖酵解变化情况基本一致。Lachmandas等发现结核分枝杆菌诱导人CD14+单核细胞糖酵解代谢相关基因HK2的表达上调以及细胞外乳酸产生增加[7]。Gleeson等发现结核分枝杆菌感染人肺泡巨噬细胞、人单核细胞来源的巨噬细胞和小鼠骨髓来源的巨噬细胞后乳酸的生成增加[6]。Shi等发现小鼠肺中宿主细胞增强了葡萄糖的摄取、糖酵解途径和磷酸戊糖途径以应对结核分枝杆菌感染[8]。Hackett等发现结核分枝杆菌以感染时间和感染复数依赖方式调节巨噬细胞中乳酸的产生[10]。
对于海分枝杆菌对宿主细胞糖酵解的研究,Kan等发现海分枝杆菌感染小鼠巨噬细胞(RAW264.7)后葡萄糖的摄取、乳酸的分泌和糖酵解代谢中间体(己糖-6-磷酸、3-磷酸甘油酸和丙酮酸)的含量均增加[20]。但RAW264.7细胞是一种肿瘤细胞,有研究表明肿瘤细胞本身葡萄糖摄取增加,糖酵解活跃,乳酸产生增加,因此原代细胞可能是一种更为合适的巨噬细胞来研究海分枝杆菌感染后其糖酵解变化情况[16,21]。本文系统的研究了海分枝杆菌对小鼠原代巨噬细胞糖酵解的调控,发现海分枝杆菌以感染时间和感染复数依赖的方式增加原代巨噬细胞糖酵解相关基因(SLC2A1、HK2和LDHA)的表达和乳酸的生成。总而言之,海分枝杆菌感染有效的增加了巨噬细胞对葡萄糖的利用,调节巨噬细胞的糖代谢重编程。
此外,在结核分枝杆菌的研究中发现糖酵解抑制剂2-DG可促进巨噬细胞内细菌的存活[10]。本研究表明2-DG也同样促进了海分枝杆菌在巨噬细胞内的存活。更有趣的是,与灭活的结核分枝杆菌不同,活的结核分枝杆菌最近被证明可以有效地抑制感染的巨噬细胞中的糖酵解转变,这说明结核分枝杆菌已经进化出特定的策略,为了自身的存活来调节宿主细胞的糖酵解[10,22,23]。本研究发现与灭活的海分枝杆菌相比,活的海分枝杆菌抑制巨噬细胞中SLC2A1、HK2和LDHA的表达以及乳酸的产生。证实了活的海分枝杆菌也可抑制巨噬细胞的糖酵解代谢转变,这可能是分枝杆菌甚至是胞内菌免疫逃逸的共有机制。
总而言之,受感染的巨噬细胞的糖酵解受到其自身和海分枝杆菌的共同作用,这是决定感染结果的关键。因此,有望通过调控宿主细胞糖酵解代谢来辅助治疗海分枝杆菌的慢性感染,减少治疗周期。
志谢:感谢荷兰莱顿大学Annemarie H. Meijer教授惠赠的表达红色荧光蛋白mCherry的海分枝杆菌菌株MycobacteriummarinumMma20和济宁医学院刘昂副教授赠送减毒牛型分枝杆菌。

