重组人HMGB1调控内皮细胞成血管作用的机制初探
邓金涛 许文斌 任建华 张文辉 王哲 梁堂钊
由创伤、感染及肿瘤导致的大段骨缺损是骨损伤后常见并发症,存在治疗难度大、自身愈合不佳等问题,是骨科医师面临的主要挑战[1]。临床上常用的治疗方法包括自体骨移植、同种异体骨移植、人工骨移植等方式[2-4]。但这些常规治疗方式伴随着各种问题,如自体来源骨组织有限及移植部位感染、血管神经损伤等[5-8]。此外,同种异体骨的使用也会受到骨源有限、供体部位感染、异常骨吸收等严重并发症的限制而无法大规模使用[9]。目前临床上常用的生物材料由于骨诱导能力差、组织相容性低等缺点无法与人体骨组织形成有效的结合[10-11]。
近些年3D 打印的生物支架在骨缺损修复领域引起了广泛的关注,通过3D 打印的方式,将一些生物材料按照预先设计好的结构构建移植替代物,有望成为骨缺损治疗的新方向[12]。遗憾的是目前3D 打印的生物支架由于缺少合适的生物活性物质,无法在损伤部位形成合适的血管网,也限制了其在临床上的应用。
高迁移率族蛋白1(high mobility group box 1,HMGB1)是一类在真核细胞核内常见的核蛋白,多种干细胞均可分泌,参与多种生理、病理活动,包括炎症、血栓形成、组织再生等[13-16]。已有文献发现在炎症或者缺氧条件下,HMGB1 可以促进间充质干细胞(mesenchymal stem cell,MSC)迁移、成骨分化[17]。但是生理或病理条件下的HMGB1 浓度较低,治疗效果不佳。Yes 相关蛋白(Yes-associated protein,YAP)是Hippo 信号通路的关键效应蛋白,通过入核发挥作用,广泛参与细胞的增殖、分化以及凋亡的调控[18-19],是再生领域研究的热门蛋白[20]。YAP 参与了肿瘤的发生发展过程[21],除此之外,在干细胞增殖分化、血管再生领域中也发挥着重要作用[22-23]。本文将外源高浓度的重组人HMGB1(recombinant human HMGB1,rhHMGB1)蛋白与内皮细胞共培养,探索高浓度rhHMGB1 蛋白对内皮细胞迁移及成血管活性物质释放能力的影响,为后期将rhHMGB1 蛋白搭载至生物支架进行体内实验研究奠定理论基础,也为后续搭载rhHMGB1 支架临床治疗大段骨缺损积累充足的实验证据。
1 材料与方法
1.1 细胞来源及主要试剂
人骨髓MSC、内皮细胞均购自广州吉妮欧公司。胎牛血清、DMEM 培养基、胰蛋白酶购自美国Gibco公司。细胞计数试剂(cell counting kit,CCK)-8、多聚甲醛溶液、结晶紫染色液购自上海碧云天公司。一抗[血管内皮生长因子(vascular endothelial growth factor,VEGF)、CD31、YAP、磷酸化YAP(p-YAP)、缺氧诱导因子(hypoxia inducible factor,HIF)-1α]、二抗、荧光标记二抗、内参购自江苏亲科生物公司。RNA 提取试剂盒、逆转录试剂盒、实时荧光定量试剂盒购自南京诺唯赞公司,rhHMGB1 蛋白购自北京义翘神州公司。本实验研究方案已通过中山大学附属第三医院伦理委员会批准。
1.2 细胞培养与分组
MSC、内皮细胞传代培养,培养条件为含有青霉素-链霉素以及10%胎牛血清的DMEM 培养基,当细胞融合至90%时,弃去旧培养基,用磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤,加入0.25%胰蛋白酶和0.02%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)混合消化液,当细胞变圆后迅速加入完全培养基终止消化,轻轻吹打,收集细胞。离心,弃去上清,用完全培养基重悬细胞,传代培养,隔日换液。
实验分组:将内皮细胞分为对照组、MSC 上清组及rhHMGB1 组。对照组使用DMEM 培养基培养内皮细胞;MSC 上清组使用MSC 的培养上清对内皮细胞进行培养;笔者在预实验中发现2 μg/mL rhHMGB1 对内皮细胞细胞迁移的促进作用较明显,因此rhHMGB1 组选择2 μg/mL rhHMGB1 蛋白来处理内皮细胞进行后续实验。
1.3 实验方法
1.3.1 MSC 上清提取 MSC 在完全培养基中培养一段时间后,去除原有培养基,用PBS 清洗,换用无血清培养基培养。24 h 后,收集细胞上清,800×g,4 ℃离心10 min,小心吸取上清,10 000×g,4 ℃离心20 min,将上清分装到无菌的1.5 mL 离心管中,-80 ℃保存。
1.3.2 CCK-8 实验 对数生长期的内皮细胞以830 个/孔接种于96 孔板,继续培养直至细胞60%融合后弃去上清,各组细胞孵育48 h 后,每孔加入10 μL CCK-8 溶液。孵育结束后,用酶标仪测定吸光度值,统计各组细胞增殖率。
1.3.3 Transwell 实验 将内皮细胞在无血清培养基中重悬后加入Transwell 上室,并补足无血清培养基500 μL,在下室中根据分组加入不同的培养基500 μL,随即将上室放入下室中,置于37 ℃培养箱中培养。分别培养0、6、12、18、24 h 后,将上室取出,在下室加入500 μL 多聚甲醛溶液,固定20 min,随后加入600 μL 结晶紫,染色10 min。染色结束后,清洗上室2 次,用棉花轻轻拭去小室内膜表面的细胞,自然晾干后显微镜下观察拍照。
1.3.4 实时荧光定量逆转录聚合酶链反应 采用RNA提取试剂盒提取细胞RNA,进行实时荧光定量逆转录聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR),并通过2-ΔΔCt法对VEGF、CD31、HIF-1α 及YAP 的信使RNA(messenger RNA,mRNA)相对表达量进行分析。
1.3.5 蛋白质印迹法 提取内皮细胞的总蛋白,经过电泳、转膜、封闭后进行一抗4 ℃过夜孵育(稀释比为1∶1 000),二抗室温孵育2 h(稀释比为1∶5 000),清洗后使用化学发光成像仪成像,检测VEGF、CD31、YAP、HIF-1α 蛋白相对表达量。
1.3.6 免疫荧光 将内皮细胞用多聚甲醛溶液固定30 min,PBS 清洗后加入TritonX-100 透化,接着使用山羊血清封闭30 min。加入一抗(YAP、p-YAP,稀释比为1∶100)4 ℃过夜。清洗后二抗(稀释比为1∶100)室温避光孵育1 h,清洗后加入防荧光淬灭剂封片,荧光显微镜拍照。使用YAP/p-YAP 的比值来反映出YAP 的入核率。
1.4 统计学方法
采用Graphpad Prism 8 和Image J 软件进行统计学分析与作图。符合正态分布的计量资料以均数±标准差表示,比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 rhHMGB1 对内皮细胞增殖和迁移的影响
CCK-8 实验结果表明,3 组细胞增殖率差异无统计学意义(图1A,P>0.05)。Transwell 实验结果表明,与对照组比较,MSC上清组内皮细胞迁移率有所提高,但差异无统计学意义(图1B、C,P>0.05);与对照组比较,rhHMGB1 组内皮细胞迁移率增加,差异有统计学意义(图1B、C,P<0.05),且细胞迁移率随着时间的延长而增加。
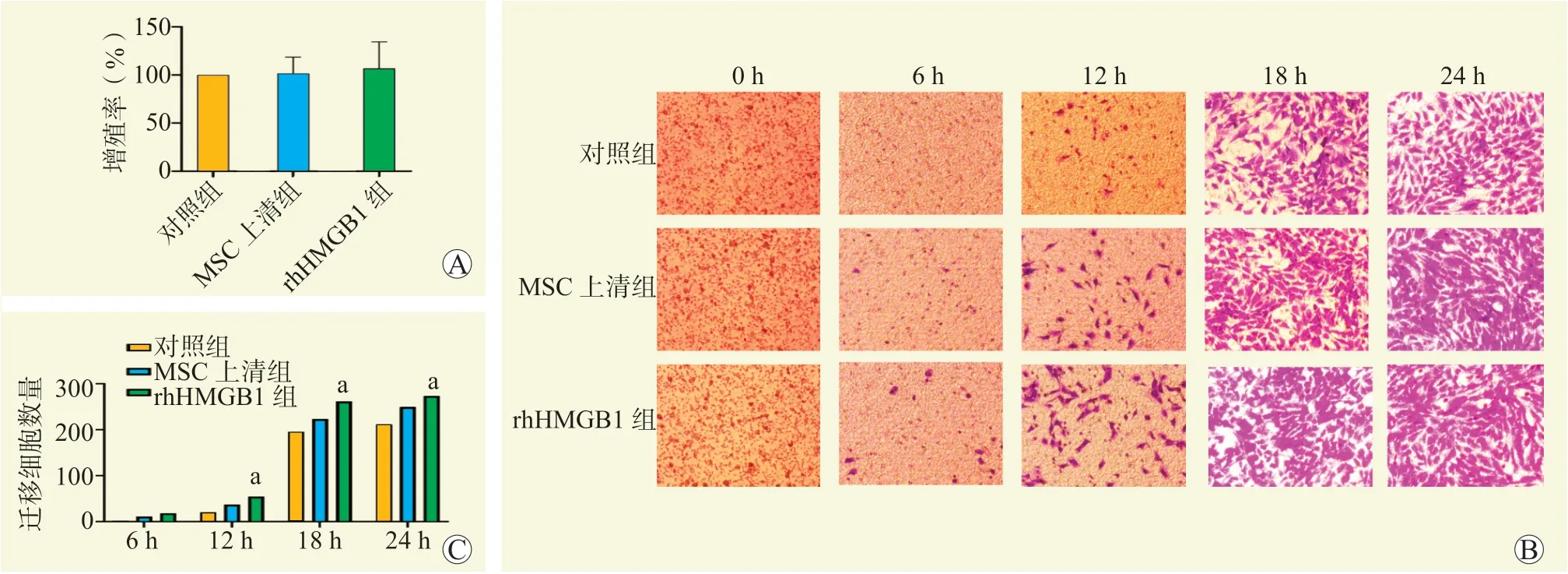
图1 rhHMGB1 对内皮细胞增殖和迁移能力的影响Figure 1 Effect of rhHMGB1 on proliferation and migration of endothelial cells
2.2 rhHMGB1 对内皮细胞释放成血管活性物质的影响
蛋白质印迹法结果见图2。与对照组比较,MSC上清组VEGF 蛋白相对表达量增加,rhHMGB1 组的VEGF 和HIF-1α 蛋白相对表达量均增加,差异均有统计学意义(均为P<0.05)。RT-qPCR 结果显示,与对照组比较,rhHMGB1 组的VEGF 和CD31 mRNA 相对表达量均增加,差异均有统计学意义(均为P<0.05)。与MSC 上清组比较,rhHMGB1 组的CD31 mRNA 相对表达量增加,差异有统计学意义(P<0.05)。
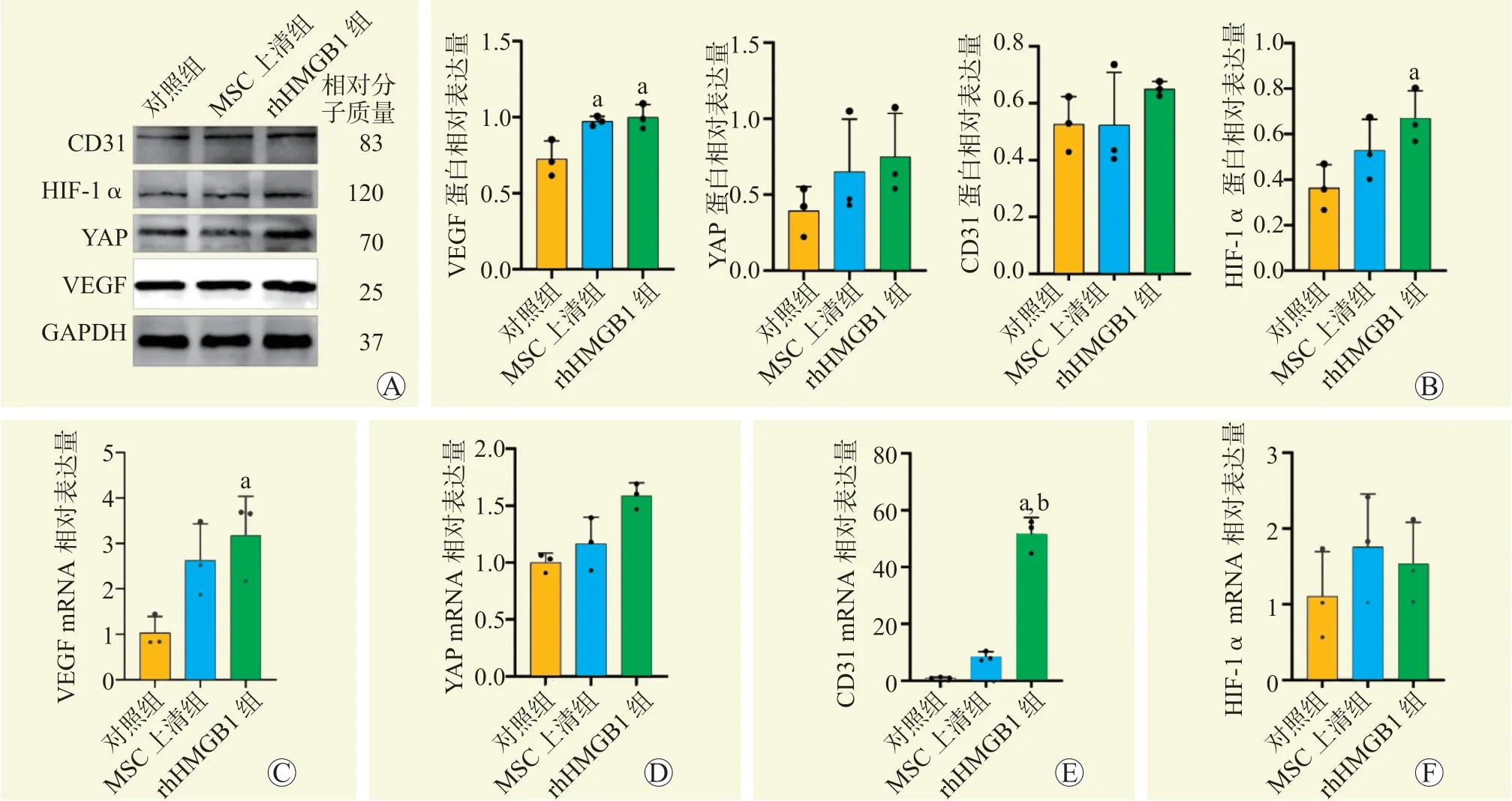
图2 rhHMGB1 对内皮细胞VEGF、HIF-1a、CD31、YAP 的mRNA 和蛋白表达的影响Figure 2 Effect of rhHMGB1 on the expression levels of VEGF,HIF-1a,CD31 and YAP mRNA and protein in endothelial cells
2.3 rhHMGB1 对YAP 入核的作用
免疫荧光结果显示,与对照组比较,MSC 上清组p-YAP 蛋白表达增多,差异有统计学意义(P<0.05),YAP/p-YAP 比值差异无统计学意义(图3,P>0.05)。与对照组比较,rhHMGB1组的YAP和p-YAP蛋白表达均增多,YAP/p-YAP 比值增加,差异均有统计学意义(图3,均为P<0.05)。与MSC 上清组比较,YAP 蛋白表达增多,YAP/p-YAP 比值增加,差异均有统计学意义(图3,均为P<0.05)。
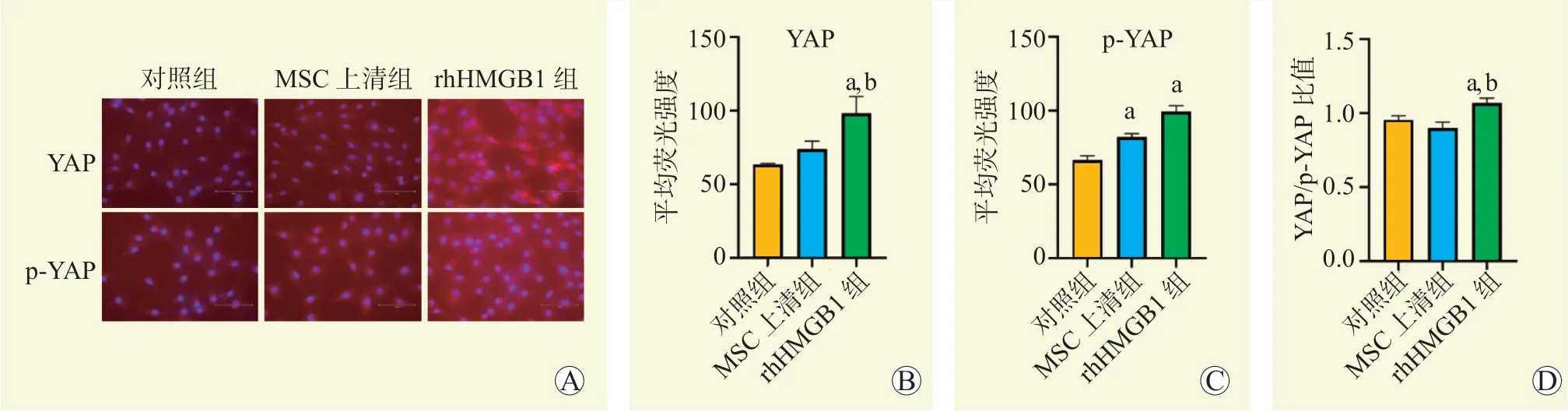
图3 rhHMGB1 对YAP 入核的影响Figure 3 Effect of rhHMGB1 on YAP entry into the nucleus
3 讨论
骨缺损部位愈合高度依赖充足的血管系统[24],充足的血管网可以为细胞增殖、骨组织沉积提供营养支持,单纯的生物支架放入后由于没有血管新生,会导致缺损部位骨再生失败[25],因此,采取支架搭载生物活性物质可以提高支架本身生物活性。骨髓MSC由于易获得且具有较强的增殖能力、多向分化能力,在过去被用作种子细胞与支架一起来进行骨移植治疗骨缺损[26],但因为缺乏血供,骨髓MSC 无法发挥生物治疗的作用,最终导致骨移植失败。通过本课题的探究发现,外源rhHMGB1 蛋白可以有效促进内皮细胞的迁移以及血管活性物质的释放,并且高浓度(2 μg/mL)情况下细胞毒性小,不会对支架以及周围细胞、组织产生负面影响,是一种高效、安全的生物活性物质,在骨移植领域具有很高的研究价值。
HMGB1 参与多种生理、病理活动,包括炎症、组织再生等[13],有文献发现,在低氧环境中骨髓MSC 可以通过释放HMGB1 来增强自身的迁移以及成骨分化能力,对内皮细胞也有一定的促进作用[17,27],但是具体调节方式还不清楚。缺氧环境会诱导细胞分泌HIF-1α,低氧条件下HIF-1α 会在细胞质中积累,接着进入细胞核内与启动子结合,从而诱导一系列基因表达[28],包括许多与血管再生相关的基因[29-31],因此HIF-1α 的高表达有利于促进缺损部位早期血管化[32-34]。CD31,又称为血小板内皮细胞黏附分子,是细胞黏附分子家族成员,是一类跨膜蛋白,包括胞外结构域、跨膜结构域及胞内结构域,通常位于血管内皮、血小板上,在内皮细胞连接处高度表达,维持内皮细胞连接完整性以及促进血管发育[35-36]。本研究使用外源rhHMGB1 以及MSC 上清分别对内皮细胞进行处理,MSC 上清组代表正常情况下MSC 分泌的HMGB1。通过研究发现2 μg/mL rhHMGB1 通过促进内皮细胞迁移以及释放更多的VEGF、CD31 及HIF-1α 来促进血管生成,MSC 上清中由于HMGB1 浓度不足,所以促进能力低于rhHMGB1。同时,本研究也发现在促进内皮细胞释放成血管活性物质这一过程里,YAP 蛋白也扮演着重要角色。这为后续骨移植替代物中生物活性物质的改造提供了可靠的实验依据。
YAP 是Hippo 信号通路的关键蛋白,属于转录共激活因子,需要与核内的TEAD 转录因子结合来启动下游相关靶基因的表达,YAP 磷酸化会在胞质内酶解失活,只有未被磷酸化的YAP 才能顺利进入细胞核发挥作用[37]。因此,本研究通过免疫荧光实验简单探究了外源HMGB1 处理内皮细胞后YAP 入核情况,通过实验发现经2 μg/mL rhHMGB1 蛋白处理后,YAP 入核比例增加,结合前述实验结果,笔者推测YAP 入核后可能通过激活下游靶基因的表达,进而促进内皮细胞释放VEGF、CD31 及HIF-1α 来促进血管再生。这一结果为后续HMGB1 与Hippo 信号通路深入机制的探索提供了前期实验依据,详细的机制探索还需要进一步实验证实。
综上所述,外源高浓度rhHMGB1 可能通过介导YAP 入核促进内皮细胞的迁移能力,并上调血管生成相关蛋白的表达。后续可以通过基因工程的手段来人为地提高骨髓MSC 中HMGB1 的表达水平,进而提高生物支架血管再生的能力。然而,高浓度HMGB1蛋白与YAP 蛋白相互作用的具体机制仍需要进一步深入探讨,以期为骨移植替代物中种子细胞的选择及改造提供更科学的证据。

