干细胞移植治疗睾丸衰老的现状与思考
莫嘉辉 李欣禹 陈志宏 张敏 邓春华
随着全球老龄化进展加速以及国内人口负增长,各种衰老相关慢性疾病以及两性生育力保护日益引起重视[1]。睾丸衰老(testicular aging)是指睾丸结构和功能随着年龄增长逐渐衰退的过程[2],主要特点是睾酮合成能力以及生精功能逐渐下降,不仅影响男性生育力和生育质量,而且影响整体健康状况[3-4]。尽管关于睾丸衰老的命名与诊疗标准仍存在争议,但笔者认为相较迟发性性腺功能减退症(late-onset hypogonadism,LOH),睾丸衰老更准确地概括了在衰老过程多因素作用下睾丸生精及内分泌功能发生的渐进改变与多器官系统效应。因此,延缓睾丸衰老对于改善中老年男性健康和生活质量至关重要。
干细胞是具有强大的自我更新能力和多向分化潜能的细胞群体[5]。自从实现胚胎干细胞分离与体外诱导多能干细胞以来,干细胞的基础与临床应用研究不断深化,推动了细胞疗法的发展[6]。干细胞移植是将干细胞或其衍生物通过特殊技术移植到体内以重建损伤部位和恢复生理功能的细胞疗法,目前已被用于治疗皮肤、骨关节、神经、血液及内分泌相关疾病,并在衰老与再生医学领域受到广泛关注[7]。
目前临床上仍缺乏治疗睾丸衰老的理想疗法,而干细胞移植可通过定向分化替代衰老细胞,还可通过免疫调节维持组织微环境稳态[8],作为治疗睾丸衰老的新策略具有极大潜力。近年来,干细胞移植治疗睾丸衰老的研究取得令人兴奋的成果。随着基因工程和生物材料等技术的蓬勃发展,诸如理化因子预处理、基因修饰及结合仿生材料等新兴疗效优化策略也被广泛探讨[9-10]。本文将阐述当前干细胞移植治疗睾丸衰老的相关研究现状,并探讨临床转化面临的瓶颈以及疗效优化策略,以期为睾丸衰老干细胞疗法的研发及临床应用提供新思路。
1 干细胞移植治疗睾丸衰老的研究进展
睾丸作为男性性腺,具有分泌雄激素(睾酮)和产生精子两大主要功能[3]。睾丸衰老不仅会导致男性生育力下降,还会破坏内分泌稳态[11],对机体健康产生多种不良影响。一方面,睾丸是精子产生的场所,睾丸衰老微环境中积累的活性氧簇(reactive oxygen species,ROS)可能导致老年男性精液质量下降[12-13],其子代多种疾病(如儿童期肿瘤、自闭症和代谢综合征等)的患病率增加[14]。另一方面,睾丸间质细胞(Leydig cell,LC)是成年男性睾酮合成的主要场所,衰老导致的睾酮缺乏不仅引起性功能障碍,还与骨质疏松、肌肉萎缩、肥胖、糖尿病、阿尔兹海默症、心血管疾病等密切相关[11],严重影响老年男性的生活质量和预期寿命。随着现代文明的发展,在环境污染逐渐加重、精神心理压力增加以及不良生活习惯等多种不利因素的共同影响下,男性睾丸功能衰退呈现年轻化趋势,因此,防治睾丸衰老对于改善中老年男性健康和生活质量、缓解人口老龄化危机具有重要意义。
目前睾丸衰老的治疗策略主要包括内分泌调节和抗氧化疗法等,笔者总结见表1[2,15],但有效性和安全性有待进一步验证。现阶段临床上主要通过直接补充外源性雄激素(睾酮),缓解睾酮水平低下相关的临床症状,称为睾酮替代疗法(testosterone replacement therapy,TRT)[15]。TRT 可提高血清睾酮水平,改善男性性功能、肌力、代谢、骨密度等情况,但仍存在诸多缺陷[16]。一方面,睾丸不仅可分泌睾酮,还可分泌胰岛素样因子(insulin-like factor,INSL)3 和抗苗勒管激素等多种激素,进而调控骨代谢和血管发育等过程[17]。血清睾酮水平下降是睾丸衰老的表现而非原因,因此单纯补充睾酮无法替代睾丸复杂的内分泌功能,更无法延缓睾丸衰老。另一方面,睾酮分泌受到下丘脑-垂体-睾丸轴的精密调控。直接补充外源性睾酮会反馈性抑制LC 的分泌功能,导致内源性睾酮分泌不足,恶化患者的生精功能[18]。此外,TRT还可能加重患者的下尿路梗阻症状,增加红细胞增多症和前列腺癌等的发生率[16,18]。
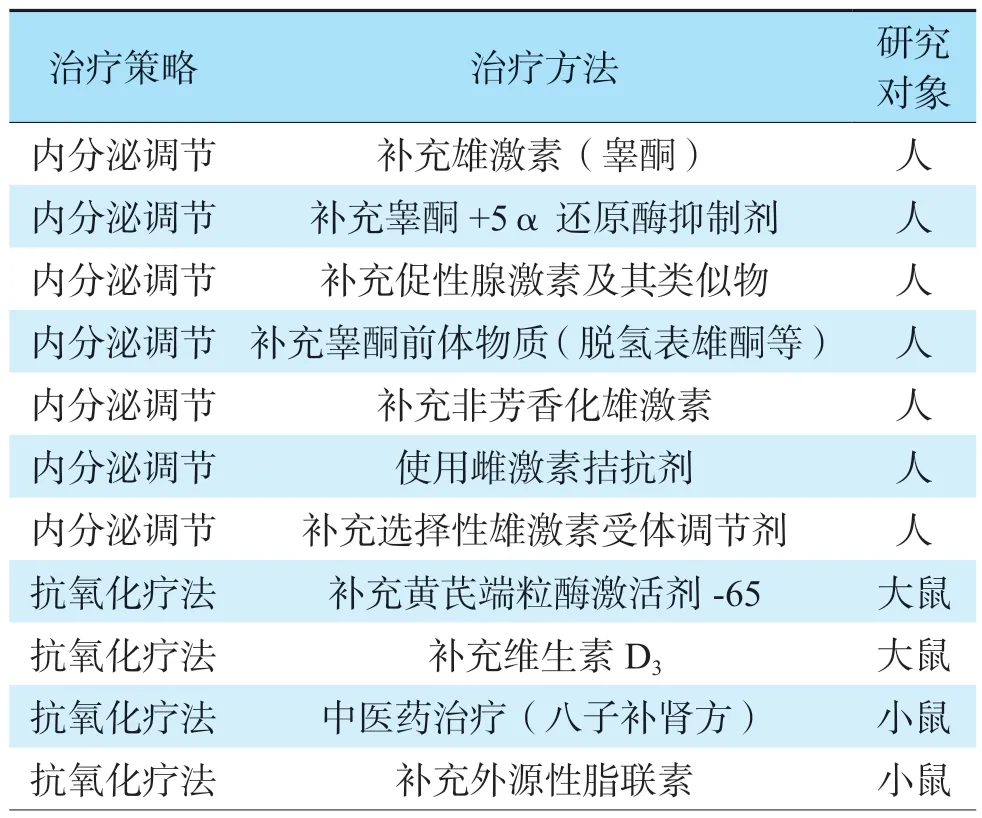
表1 睾丸衰老的内分泌及抗氧化治疗策略Table 1 Strategies of endocrinotherapy and antioxidant treatment for testicular aging
总之,目前针对睾丸衰老的治疗方法仍不理想,亟需探索延缓睾丸衰老的新策略。干细胞移植为治疗创伤、肿瘤和衰老等疾病带来了革命性的变化,是当今医学研究最前沿的方向之一。从首次提出“干细胞”的概念到如今干细胞治疗临床转化与应用,许多里程碑事件推动着干细胞研究领域的发展,笔者总结见图1[6,19-20]。2018年全球首例通过脐血间充质干细胞(mesenchymal stem cell,MSC)治疗的卵巢早衰患者成功分娩[21],标志着干细胞治疗生殖衰老难题取得重大进展,说明其作为治疗睾丸衰老的新策略具有广阔的应用前景。目前干细胞移植治疗睾丸衰老的研究主要集中在恢复睾丸生精功能和改善睾酮分泌两个方面。

图1 干细胞移植研究历程的重要进展Figure 1 The major scientific advances during the history of stem cell transplantation research
1.1 干细胞移植促进生精功能恢复
干细胞来源广泛、种类繁多,围绕恢复生精功能的干细胞研究主要包括精原干细胞(spermatogonial stem cell,SSC)、睾丸间质干细胞(stem Leydig cell,SLC)和MSC。
1.1.1 精原干细胞移植促进生精功能恢复 SSC 是位于睾丸生精小管基底膜上的成体干细胞,是维持精子发生和男性生育力的基础[22]。生理状态下,SSC 能够自我更新以维持干细胞库的稳定,也可通过分化产生成熟精子。SSC 移植疗法,即分离患者的自体SSC,经体外培养扩增后移植到患者的输出小管、生精小管或睾丸网(rete testis)[9],理论上可以补充精子发生的“种子”来源,恢复损伤或衰老睾丸的生精功能。Brinster 等[23]最早在不育小鼠中通过SSC 移植成功恢复精子发生并产生存活后代,证实了同种异体SSC 移植后分化产生功能精子和恢复生育力的可行性。随后,SSC 移植在其他哺乳动物的研究中得到了广泛探索,包括大鼠、犬、猪、牛、食蟹猴等[9]。由于不同物种存在睾丸结构差异,这些研究实际上为SSC 移植积累了宝贵的技术经验。Hermann 等[24]首次在非人灵长类动物中证实了SSC 移植后可产生功能精子,为SSC移植的临床转化奠定了坚实基础。截止至投稿日,仅1 项利用自体SSC 或自体睾丸组织移植恢复生精功能的注册临床试验(NCT04452305),该试验处于招募受试者阶段,尚未有在人体进行自体睾丸组织移植或SSC 移植成功产生功能精子的相关报道。此外,自体SSC 的来源有限,异体SSC 移植面临伦理问题,均限制了SSC 移植在睾丸衰老防治的应用。目前主要认为基于SSC 的疗法(包括自体睾丸组织移植、SSC 移植和体外精子发生)可作为接受性腺功能损伤治疗的青春期前患者保存生育力的基础策略[25],但相信随着对精子发生机制和生精小管微环境(niche)的认识不断深入,自体SSC 移植有望成为睾丸衰老的治疗策略。
1.1.2 睾丸间质干细胞移植促进生精功能恢复 SLC 是位于睾丸生精小管及血管周围间隙的组织特异性成体干细胞,可定向分化为LC[26]。LC既是睾丸内分泌细胞,也是生精微环境的重要组成部分,因为生理状态下睾丸的生精功能和睾酮合成功能并非完全独立的两个过程[27],生理浓度的睾酮对于维持正常的精子发生起着重要作用。SLC 的自我更新与定向分化有助于维持睾丸间质微环境中LC 的健康状态,在睾丸损伤修复反应中发挥重要作用,为“种子”的重新萌发提供良好的“土壤”环境。二甲基磺酸乙烷(ethane dimethane sulfonate,EDS)可特异性诱导大鼠LC 凋亡,使睾丸丧失睾酮分泌功能并导致生精功能损伤[26]。内源性SLC 可分化并替代EDS 损伤的LC,Ge 等[28]研究证明在大鼠中移植CD140a+的SLC可部分挽救精子发生,重建睾丸组织稳态。目前国内外尚未开展SLC 移植治疗不育症的临床试验,但随着SLC 的分离鉴定、体外扩增以及工程化改造体系的逐渐完善,SLC 移植有望成为恢复睾丸生精功能、延缓睾丸衰老的重要策略。
1.1.3 间充质干细胞移植促进生精功能恢复 MSC 是广泛来源于多种组织(骨髓、脂肪、脐带、胎盘、牙髓等)的多能干细胞[8],具有对组织微环境独特的感知与调控功能[29]。随着衰老过程不断积累损伤因素,生精细胞的凋亡比例逐渐增加[30]。此外,衰老过程高水平的氧化应激可引起DNA 损伤、端粒缩短,导致睾丸生精功能降低[12]。MSC 可能主要通过减少生精细胞凋亡和减少氧化应激以促进生精功能的恢复。Hsiao 等[31]研究表明小鼠睾丸原位注射脂肪组织来源的MSC 能够明显减少生精细胞的凋亡,进而改善精子质量。Sherif 等[32]研究发现小鼠静脉注射骨髓来源的MSC 不仅能够缓解顺铂诱导的睾丸毒性以及睾丸氧化应激,同时可降低睾丸局部炎症因子水平,进而恢复生精,提示MSC 移植在促进生精方面具有巨大潜力。目前共有6 项利用MSC 治疗无精子或少精子的临床研究(NCT02025270、NCT02641769、NCT02008799、NCT02041910、NCT05158114、NCT02414295),其中仅1 项选取了脐血来源的MSC(NCT05158114),其余均选取了骨髓来源的MSC,递送方法主要为原位注射或睾丸血管内注射,但尚未有公开的结果报道。值得肯定的是,MSC 移植后对局部微环境稳态的调控作用将使其成为促进睾丸生精功能恢复的重要候选细胞。
1.2 干细胞移植促进睾酮合成分泌
睾酮合成主要发生在LC,因此LC 衰老是导致睾丸衰老过程睾酮分泌减少的重要原因。理论上,LC 移植是治疗睾酮分泌减少的最佳选择,但LC 是无增殖能力的终末分化细胞[33],实际上难以获得适用于体内移植的LC。通过移植干细胞定向分化为LC以改善睾酮合成功能具有极大的应用潜力,目前成功实现Leydig 样细胞定向分化的干细胞类型包括成体SLC、MSC 和诱导多能干细胞(induced pluripotent stem cell,iPSC)。
1.2.1 睾丸间质干细胞移植促进睾酮合成分泌 人类和非人灵长类动物的LC 发育经历了3 个阶段,包括胎儿期、新生儿期和成年期,其中成年期LC 是在青春期由SLC 定向分化而来[33],因此SLC 对维持成年阶段LC 的稳态发挥重要作用。目前认为SLC 移植是针对睾酮分泌减少或LOH 的细胞治疗首选方案[34]。早在2004年,Lo 等[35]将SLC 移植到促黄体生成素受体敲除小鼠中,发现循环睾酮水平显著提高,但无法确定移植小鼠中分化为Leydig 样细胞的干细胞谱系来源。随后国内外研究者分别在大鼠和人类中证明了生精小管管周SLC 是成年阶段LC 的来源,并成功使用特定表达标记(CD51 和CD90)从大鼠及非人灵长类动物睾丸中分离SLC[34,36]。此外,项鹏教授团队陆续发现神经丝蛋白(nestin)、p75 和endosialin 可作为鉴定和分离人类SLC 的特异标记[37-39],推动了SLC鉴定、分离与体外培养扩增体系的建立;并证明了nestin 阳性SLC 移植后可分化为LC,提高EDS 处理大鼠模型的血清睾酮水平和生精能力[37]。
SLC移植不仅能够提高LC损伤动物的睾酮水平,还可恢复随着衰老发生的LC 衰老或耗竭。2020年,项鹏教授团队发现自体SLC 移植可提高老年食蟹猴的血清睾酮水平和生精能力,并缓解脂肪堆积和骨质疏松等睾酮缺乏所致的全身症状[40]。然而,直接将SLC移植到人类睾丸中进行临床治疗仍存在较多困难。人类睾丸可分为200~300 个睾丸小叶,在成人睾丸组织内实现SLC 均匀和反复移植目前技术上尚不可行,且受者依从性低。此外,在老年男性的睾丸微环境中常见的巨噬细胞募集和炎症反应激活,包括白细胞介素(interleukin,IL)-1β 等炎症因子水平与ROS 产生增加,可能导致移植后SLC 损伤、衰老甚至耗竭[41]。因此,目前国内外尚未开展SLC 移植治疗男性性腺功能减退或睾丸衰老的临床试验,迫切需要探索工程化改造SLC 的策略以推动SLC 移植治疗睾丸衰老相关疾病的临床转化。
1.2.2 间充质干细胞移植促进睾酮合成分泌 MSC 因其高度的体外扩增能力和可塑性成为了体外诱导分化获取LC 最广泛使用的细胞来源。2006年,Yazawa等[42]发现大鼠骨髓来源的MSC 移植到睾丸后可分化为Leydig 样细胞,而同样诱导条件下人类骨髓来源MSC 则分化为肾上腺样细胞。直到2016年,Hou等[43]结合促性腺激素等因子诱导才在体外首次成功将人类骨髓MSC 诱导为Leydig 样细胞。目前暂未有研究报道在体内实现人源性MSC 向LC 分化。2021年,Nguyen 等[44]报道了关于静脉输注自体脂肪来源MSC 的临床Ⅰ/Ⅱa 期试验,该研究发现MSC移植后患者的睾酮水平显著提高,并在6 个月内保持高水平,在12 个月后才出现下降,同时患者的性生活满意度也明显增加。这些研究提示MSC 可能通过旁分泌细胞因子或系统免疫调控的作用恢复LC 功能,表明MSC 在恢复睾酮分泌方面具有巨大的潜力。
1.2.3 诱导多能干细胞移植促进睾酮合成分泌 iPSC 是通过导入特定转录因子将终末分化的体细胞重编程形成的多能干细胞,因其来源方便及分化潜能高成为了体外诱导分化获取LC 的替代选择。2019年,Li 等[45]和Chen等[46]分别报道了基于病毒转染处理和基于小分子化合物预处理策略在体外获取人类iPSC 衍生的Leydig样细胞,并进一步证明了iPSC 分化的Leydig 样细胞移植到大鼠体内后可恢复血清睾酮水平和增加睾丸重量。iPSC 衍生的Leydig 样细胞在体内的存活情况以及远期睾酮生物合成能力仍有待进一步评估[34]。然而,iPSC 在体外长期培养过程中累积的自发突变及基因组不稳定性可能降低其分化效率和治疗效果。此外,由于iPSC 无限增殖的特性,移植后可能形成畸胎瘤样肿瘤[34],进一步阻碍了其临床应用。降低甚至消除iPSC致瘤性仍是iPSC 移植向临床转化面临的主要挑战。
2 干细胞移植治疗睾丸衰老的挑战
尽管干细胞移植在恢复生精功能和睾酮分泌方面展现出巨大的潜力,但与内分泌疗法相比,防治睾丸衰老的细胞疗法仍处于起步阶段。与SSC、SLC 等组织特异性干细胞相关的许多基础问题亟需解决,包括影响干细胞移植后存活和归巢能力的关键调控分子、受体免疫微环境(生态位)与供体干细胞的相互作用关系、向人体移植干细胞的数量和给药方式等[47-48]。
同时,干细胞移植的临床转化仍面临诸多挑战[49]。第一个挑战是需要找到更多合适的标记以高效鉴定和分离组织特异性干细胞(如SSC 和SLC),并明确体内移植后分化与组织特异性归巢调控中的相关标记。第二个挑战是需要确保干细胞的安全性及质量控制,相关评估指标包括细胞活力、内毒素含量、基因组稳定性、致瘤性等。第三个挑战是需要建立干细胞的应用级生产和扩增体系,睾丸组织内自体SLC 和SSC的数量有限,自体干细胞预保存的时机选择尚未达成共识,异体干细胞移植仍存在伦理学争议,大规模批量生产SLC 和SSC 非常困难;尽管MSC 和iPSC 来源广泛、体外培养体系成熟,但体内分化或转分化效果仍需经过长期评估[34]。
总之,干细胞移植的临床转化和广泛应用仍是艰巨的过程,为了推动细胞疗法未来成为患者可选的一线方案,仍需不断优化改造以提高干细胞移植的疗效和安全性。
3 干细胞移植的优化策略
移植的干细胞需要在受体组织内存活才能发挥其定向分化替代或旁分泌调控的治疗作用,然而衰老微环境的炎症因子、ROS、免疫细胞与移植细胞的相互作用等因素都会影响定植组织内干细胞的存活率,因此提高干细胞的存活率对优化干细胞移植疗效至关重要。近年来,随着基因工程和生物材料等技术的蓬勃发展,诸如理化因子预处理、基因修饰及结合仿生材料等多种干细胞移植优化策略也被广泛探讨[6,10]。
理化因子预处理是指在体外培养过程中通过物理或化学因素(缺氧、流体力学、小分子药物或生物大分子等)激活或减弱干细胞相关信号通路以增强干细胞对体内应激环境的适应性[50]。研究结果表明体外预处理可以增强干细胞抗凋亡、定向归巢、组织修复、旁分泌及免疫调节等生物学特性[51-52]。
基因工程化修饰是对干细胞进行基因编辑改变特定功能基因表达的优化处理策略[5]。目前已知部分基因在LC 发育和睾酮合成分泌过程中起重要作用,如NR5A1、NR2F2 和LHCGR 等[53]。基因编辑技术一方面有利于明确性腺功能减退或生精障碍相关基因在睾丸衰老过程中的作用,另一方面也可以对干细胞中抗炎、抗衰老、抗氧化相关基因进行工程化处理,为提高干细胞移植疗效提供更多的干预靶点[54]。
生物材料工程是利用仿生材料改善干细胞的体外培养与体内递送方式的优化策略[10]。仿生材料具有良好的生物相容性以及结构可塑性,一方面可以模拟细胞外基质为干细胞提供生物力学支持(如基质骨架、水凝胶、纤维支架材料等),有助于干细胞的黏附、迁移和长期定植[55];另一方面作为可溶性旁分泌因子的扩散媒介,也有助于增强干细胞的环境响应和免疫调控功能[56]。此外,也有研究报道通过2D 或3D 类器官结构、生物打印等可以提高SSC 的体外扩增效率,有助于自体干细胞的批量生产[57]。
尽管探索干细胞的工程化改造策略如火如荼,但这些新型治疗手段仍处于临床前研究阶段,目前尚无临床应用治疗睾丸衰老的报道。相信随着干细胞与材料科学等交叉学科的不断深入发展,干细胞移植在衰老和再生医学领域将不断取得突破。
4 小结与展望
随着全球老龄化进展加速以及国内人口负增长,衰老相关慢性疾病以及两性生育力保护日益引起重视。防治睾丸衰老对于改善中老年男性健康和生活质量、缓解人口老龄化危机具有重要意义。干细胞移植作为治疗睾丸衰老的新策略具有广阔的应用前景。高产的稻田不仅需要优良的种子,还需要肥沃的土壤。如何提高干细胞移植治疗睾丸衰老的效果,不仅需要关注干细胞的类型、数量、递送方式,还需要关注移植干细胞在睾丸生态位的相互作用及存活状态。随着对衰老机制的认识不断加深与新兴学科的交叉融通,我们期待干细胞移植疗法不断突破现有技术瓶颈,逐步建立完善的应用转化体系,为老龄化人群提供高质量的个性化治疗,为衰老与再生医学领域带来新一轮革命。

