移植肾动脉假性动脉瘤合并破裂出血支架置入后狭窄1 例报告并文献复习
刘如敏,郑晓虹,丘云逸,杜传福,苗芸,缪洪飞,夏仁飞,周敏捷,曾文利,徐健(.南方医科大学南方医院器官移植科,广东 广州 5055;.南方医科大学第一临床学院医院,广东 广州 5055;.南方医科大学南方医院血管介入科,广东广州 5055)
2015 年以来,公民逝世后器官捐献成为我国器官移植非亲属供体的唯一合法来源,应激状态下组织缺氧、细胞内环境紊乱和大量炎症因子释放等因素使得此类来源的器官存在不同程度的损伤,往往成为移植术后各类并发症的不利因素[1]。在肾移植术后早期并发症中,移植肾动脉假性动脉瘤较为罕见,发病率不到1%[2],但病情危急,易导致移植肾失功,一旦发生破裂出血将直接危及患者生命。感染是导致假性动脉瘤形成的重要原因之一[3]。本文回顾性分析本中心1 例移植肾假性动脉瘤合并破裂出血、行支架置入后再狭窄受者的诊疗过程,为移植肾动脉感染性假性动脉瘤介入处置及相关并发症的防治提供经验。
1 一般资料
受者为52 岁男性,血型O,Rh 阳性,诊断终末期狼疮性肾炎,交替行血液透析、腹膜透析8 个月余,伴有高血压病史9 年、2 型糖尿病病史4 年,术前估算肾小球滤过率(estimated glomerular filtration rate,eGFR)为3.42 ml/min,群体反应性抗体(panel reactive antibodies,PRA)阴性。供者为49 岁男性,血型O,Rh 阳性,高处坠落伤,经评估为心脏死亡器官捐献者(donation after cardiac death,DCD)。配型情况良好。2020 年7 月患者于本中心行同种异体肾移植术+腹膜透析管拔除术。术中予以移植肾动脉与右侧髂外动脉端侧吻合。免疫诱导方案为抗人T 细胞兔免疫球蛋白 (anti-human T lymphocyte rabbit immunoglobulin,ATG-F)+甲泼尼龙。术后免疫抑制维持方案为他克莫司+霉酚酸酯+泼尼松,常规使用头孢哌酮钠舒巴坦钠(d 1 ~d 10)联合米卡芬净(d 1 ~d 7)预防围术期感染。术后2 周,患者移植肾功能恢复良好,未发生DGF,血肌酐恢复至154 μmol/L,eGFR 为44.03 ml/min 出院。
2 治疗与预后
术后27 d 夜间,患者突发右侧腰痛伴冷汗,遂至本院急诊科就诊,体温36.8℃,脉搏111 次/分,血压80/40 mmHg(1 mmHg =0.133 kPa),呼吸急促,无尿,急查血红蛋白为75 g/L,血肌酐为171 μmol/L,eGFR 为38.79 ml/min,移植肾彩超提示吻合口附近低回声区,大小约5.2 cm×2.2 cm(图1A)。CTA检查提示移植肾周围、右侧腹膜后血肿形成,范围30 cm×8 cm,移植肾动脉与右侧髂外动脉吻合口对比剂外溢,范围约3.7 cm×2.1 cm,考虑假性动脉瘤并破裂出血(图1B)。患者有失血性休克表现,立即予以输血、补液等对症支持治疗,联合介入科急诊行移植肾动脉造影,见移植肾动脉两处假性动脉瘤,较大位于吻合口上方近移植肾动脉处,可见明显对比剂外溢,较小位于移植肾动脉与右侧髂外动脉吻合口处(图1C)。行右髂外动脉、移植肾动脉内覆膜支架植入+假性动脉瘤封堵术,置入两枚覆膜支架(大小分别为7 mm×50 mm、7 mm×5 mm),造影显示较大瘤体未见显影,较小瘤体显影明显变淡,血流速度变慢(图2D)。次日,患者24 h 尿量恢复至2300 ml,血肌酐轻度上升至189 μmol/L,eGFR 为34.37 ml/min。3 d 后患者开始出现低热,最高可达37.8℃,白细胞计数(white blood cell,WBC)为10.15×109/L,中性粒细胞百分比(neutrophil granulocyte,NEU%)为77.6%,C 反应蛋白(C-reactive protein,CRP)为81.87 mg/L,降钙素原(procalcitonin,PCT)为0.331 ng/ml,血培养以及中段尿培养报告热带念球菌,中段尿培养亦报告屎肠球菌,移植肾周血肿穿刺引流液培养阴性,根据患者eGFR 给予万古霉素(0.75 g,1/d)联合卡泊芬净(50 mg,1/d)抗感染治疗,疗程为病原学转阴后再使用2 周左右,同时停用霉酚酸酯,更改他克莫司为环孢素,并辅以丙种球蛋白等治疗。由于患者动脉瘤破裂出血,早期并未立即予以抗血小板治疗。4 d 后患者体温恢复正常,WBC 为9.34×109/L,NEU%为76%,CRP 为29.9 mg/L,PCT为0.235 ng/ml,但24 h 尿量减少至1300 ml,血肌酐升高至376 μmol/L,eGFR 降低至14.97 ml/min,复查中段尿培养转阴后停用万古霉素,给予甲强龙冲击抗排斥反应治疗,并恢复既往免疫移植维持方案(他克莫司+霉酚酸酯+泼尼松),患者尿量恢复正常,血肌酐持续下降。入院后第7、15、23 天复查患者中段尿以及血培养均为阴性,WBC、NEU%均恢复正常,CRP 下降至9.9 mg/L,PCT 为0.15 ng/ml,eGFR 稳定于30 ml/min 左右,予出院,嘱阿司匹林联合波立维抗血小板治疗3 个月。
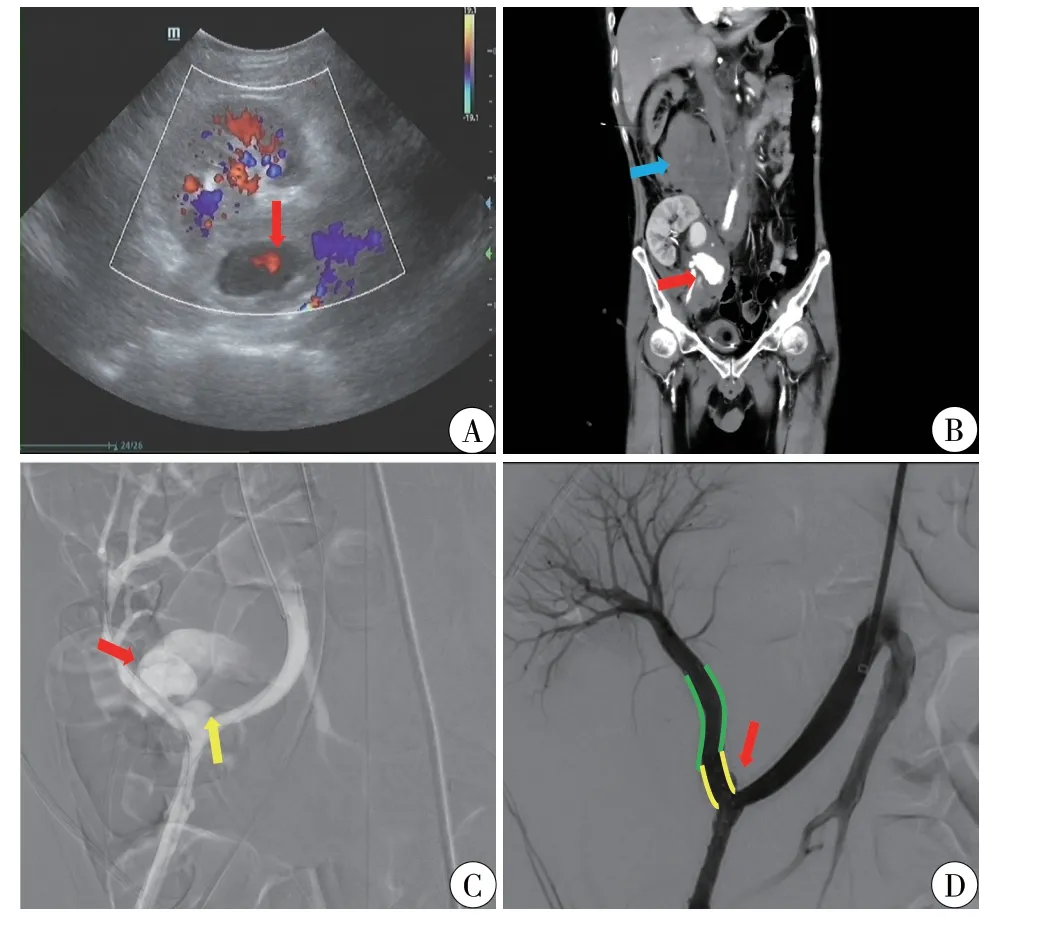
图1 移植肾假性动脉瘤影像表现
2021 年4 月患者诉尿量减少2 d,入院查eGFR 为11.40 ml/min。移植肾彩超提示移植肾动脉支架内透声差,不排除部分血栓形成,予低分子肝素皮下注射。入院后第3 天,患者尿量减少至300 ml/d,eGFR 降至5.29 ml/min,予血液透析治疗后再次行移植肾动脉造影。术中可见移植肾动脉与右侧髂外动脉吻合口处明显狭窄(图2A),经导丝进入移植肾动脉近肾门处后造影,可见移植肾内分支血流通畅(图2B),经球囊扩张移植肾动脉狭窄处后置入裸支架,造影后可见移植肾血流恢复通畅(图2C)。次日,患者低热,尿量24 h 尿量恢复至3000 ml,WBC 为6.42×109/L,NEU% 为83.5%,CRP 为38.62 mg/L,PCT 为0.362 ng/ml,血培养报告热带念球菌,予卡泊芬净(50 mg,1/d)抗感染治疗,疗程同样为病原学转阴后再使用2 周左右。入院后第10、14 天血培养均为阴性,第15 天,WBC 为4.8×109/L,NEU% 为58.1%,CRP 下降至7.26 mg/L,PCT 为0.169 ng/ml,eGFR 恢复至23.07 ml/min。出院后服用氟康唑(100 mg,1/d)维持6 个月,同时阿司匹林+氢氯吡格雷抗血小板治疗3 个月后,单用阿司匹林治疗至今。
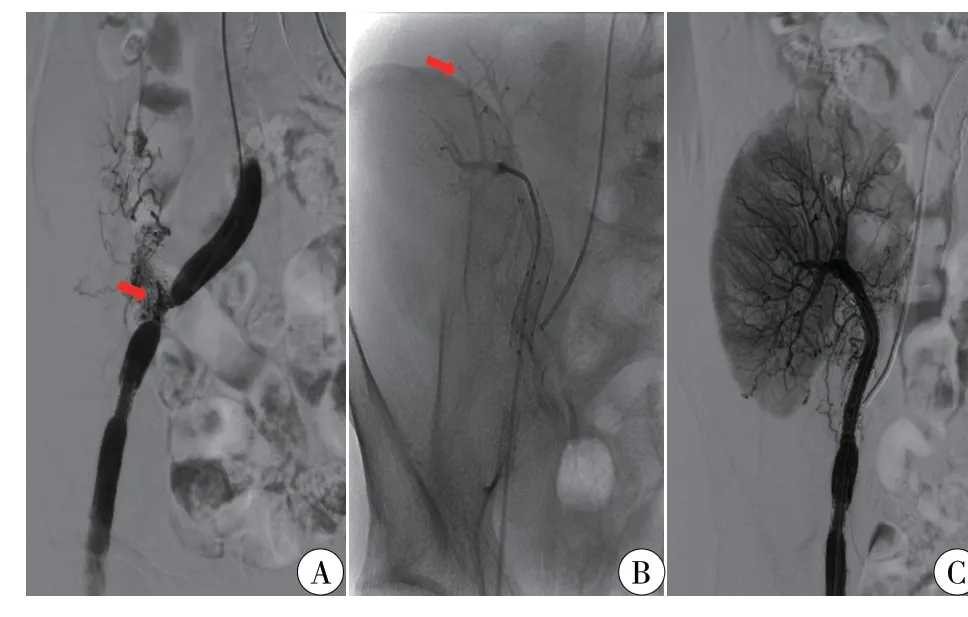
图2 移植肾动脉造影表现
截至投稿日,患者移植肾功能稳定,eGFR 波动于30 ml/min 左右,无感染征象,尿蛋白(-),尿白细胞(-)。2021 年9 月13 日复查CTA 提示瘤体封闭,支架血流通畅。
2 讨 论
肾移植术后血管并发症是早期移植物丢失的重要原因之一,较为常见的有移植肾动脉狭窄、动脉血栓形成、静脉血栓形成、动静脉瘘、肾动脉假性动脉瘤等,发生率约3%~15%[2]。其中,移植肾动脉假性动脉瘤并破裂出血的病情更为凶险,并直接威胁移植肾和患者的存活。吻合口处假性动脉瘤最常见的原因为供体或受体来源的真菌感染[4]。常见的外科因素包括吻合口张力大或者有渗漏、取肾或修肾过程中肾动脉外膜或内膜损伤、吻合口非动脉壁全层缝合等亦可导致假性动脉瘤形成[5-6]。此患者两次入院血培养均发现热带念球菌,合并低热、感染指标升高等征象,假性动脉瘤发生的主要原因考虑为真菌感染。
本例患者移植肾假性动脉瘤形成并破裂出血的临床症状可表现为:① 移植肾区或移植侧腰部突发疼痛,可为一过性剧烈疼痛,或血肿压迫下的胀痛。② 休克表现:尿量减少、血压进行性下降、血红蛋白进行性下降以及心率明显加快等。移植肾彩超为假性动脉瘤早期筛查的重要无创检查手段,但其无法明确瘤体发生部位。CTA 可为介入医生提供更准确的瘤体位置、瘤体尺寸、毗邻结构等相关信息,方便术前准备适合受者血管的支架材料。移植肾动脉数字减影血管造影(digital subtraction angiography,DSA)则是是确诊移植肾假性动脉瘤的金标准[5]。患者入院时即有休克征象,结合病史及腰痛、少尿症状,本中心立即予以补液等对症处理,通过CTA 证实移植肾假性动脉瘤破裂出血并立即与介入医生取得联系,抢救迅速,介入手术预后良好。
早年多数中心报道,移植肾动脉感染性吻合口假性动脉瘤的最佳手术治疗方案包括移植肾切除术和假性动脉瘤切除术并重建血管[6-7]。虽然开放手术是为保留移植物和肢体循环的动脉重建提供多种可能性的金标准,但手术并不容易,尤其是在术后早期,由于广泛的黏连,合并感染下,血管重建具有挑战性[8]。对于具有良好解剖结构的高危手术患者,应考虑血管内治疗[9]。随着介入医学技术的发展,越来越多的病例报道通过介入性血管腔内修复成功挽救移植肾功能。1991 年,Parodi 等首次应用覆膜支架成功治疗腹主动脉瘤,目前覆膜支架已成为治疗动脉瘤的常规方法[10]。Smeds MR 等人使用覆膜支架成功治疗非感染性吻合口假性动脉瘤,成功保留了移植肾的动脉血流,并在 1 个月的CT 血管造影监测中显示了良好的支架通畅性[11]。张伟等[12]报道的3 例移植肾假性动脉瘤通过采用覆膜支架“烟囱”介入技术治疗后,1 例因术后感染死亡,2 例移植肾功能维持良好。Zavos 等[13]学者甚至认为介入治疗有望成为移植肾假性动脉瘤的首选方法。但介入治疗感染性移植肾动脉假性动脉瘤报道较少。
近期国外有文献报道认为,肾移植受者的真菌性假性动脉瘤在自发破裂的情况下可出现大量出血和死亡的风险。早期血管内支架置入术可成为血流动力学不稳定患者的治疗方法,并强烈建议进行有效的抗真菌治疗[14]。高小林等[15]报道2 例移植肾假性动脉瘤合并白假丝酵母感染,均为同一供者,1 例行移植肾、移植肾动脉切除术+髂外动脉端端吻合术,术后10 d 再发出血行血管重建,1 例行右髂外动脉、移植肾动脉内覆膜支架植入+假性动脉瘤封堵术,术后结合抗感染治疗后,移植肾功能恢复良好。因此,本例患者移植肾术后常规使用米卡芬净预防真菌感染,术后1 个月仍发生热带念球菌突破性感染,考虑两性霉素B 对肾功能影响较大,氟康唑影响免疫抑制剂浓度,我们更换为卡泊芬净50 mg,1/d,待病原学转阴后维持治疗约2 周,出院后更换为口服药物治疗约6 个月。针对屎肠球菌,本中心根据肌酐清除率计算万古霉素使用剂量,维持万古霉素(0.75 g,1/d)直至病原学转阴,同时降低免疫抑制强度,并辅以丙种球蛋白等治疗,待患者血色素平稳,予以波立维联合阿司匹林抗血小板治疗,病原学检查1 周内转阴。由于抗感染药物的肾毒性以及免疫抑制强度的降低,患者出现一过性移植肾功能下降,万古霉素停药和免疫移植强度恢复后,移植肾功能部分恢复。
此外,本例患者在本中心与检验科、介入科以及临床药学多学科合作下,积极抗感染治疗,带来保留移植肾功能的长期获益。但介入术后8 个月,因原覆膜支架内部分血栓形成致管腔狭窄,患者发生移植肾功能急性衰竭,不排除前期丙种球蛋白的使用、抗血小板药物使用不规律以及2 型糖尿病等基础疾病所致。考虑本次为支架内官腔狭窄,并未发生再发动脉瘤,介入术中只需置入裸支架后,患者移植肾功能得到快速恢复,术后使用卡泊芬净抗真菌治疗,为防止再次复发,予以小剂量氟康唑维持性治疗6 个月。
综上所述,移植肾真菌性感染性假性动脉瘤合并破裂出血属肾移植术后早期危重并发症,接诊医师应根据患者病史和特征性临床征象迅速予以生命支持和相关辅助检查确诊病因。结合本次病例,经影像学诊断明确后,尽早行血管内介入手术可最大程度地保留移植肾并使患者长期获益,为临床类似病历提供较为可靠的治疗手段。而为获得远期效果并防止再发破裂,使用覆膜支架较为安全可靠,术后积极抗感染治疗不可忽视。为避免支架内血栓形成,排除患者潜在出血风险下,合理的抗血小板治疗同样重要。另外,本次病例我们并没有采取开窗技术置入覆膜支架,即建立类似于“T”字形覆膜支架,更符合血管走行以及血液流动学,主要考虑到患者有两个瘤体,其中较大瘤体已破裂出现活动性出血,经输血、输液以及血管活性药物使用后生命体征维持尚平稳,但仍有随时出现失血性休克,危及生命的可能;开窗技术需体外建立,且对术者的操控精确度要求较高,为尽快抢救生命,选择尽早封堵破裂的瘤体。因此,我们仍亟需大规模的临床对照试验以证实移植肾感染性假性动脉瘤介入治疗的优效性,并推动手术指征及禁忌证、术后管理相关诊疗规范的制定,使患者最大受益。

