CYP3A5 基因多态性对肾移植受者他克莫司代谢及预后的影响
王钰雄,齐可心,王远涛,周洪澜,李红芹(吉林大学第一医院泌尿外二科,吉林长春 130061)
肾移植经过超过60 年的飞速发展,已经成为现今终末期肾病最经济有效的治疗方案[1]。他克莫司(tacrolimus,Tac)作为一种免疫抑制剂,自20 世纪末被批准用于肝移植术后的免疫抑制以来,已经是移植领域使用最为广泛的基石药物[2]。他克莫司通过口服的方式进入体内后,抑制了免疫细胞内钙调神经磷酸酶(calcineurin,CN)活性,使多种炎性细胞因子表达下调,进而有效地抑制了宿主抗移植物免疫反应[3-4]。上述他克莫司的药理作用使其在器官移植中发挥了强有力的免疫抑制作用。然而,他克莫司因其具有较低的吸收效率、狭窄的治疗窗、个体差异较大的血药谷浓度,使之成为术后随访工作中的主要关注和调整对象。如何解决这些问题,进而使其免疫抑制剂量和药物的不良反应达到最优化的平衡点,是临床移植研究的热点。
细胞色素P450 酶系3A5 (cytochrome P450 3A5,CYP3A5)基因的翻译产物是CYP3A5 代谢酶(7q22.1)[5],其在消化道小肠细胞和肝脏内参与代谢移植患者体内的大部分Tac。已有报道表明,CYP3A5 基因的突变体代谢产物对免疫抑制剂代谢的影响尤为显著。但这种突变导致的表型多态性与移植个体间异质性较大的临床预后的关系,仍缺乏高证据等级的定论[3,6-7]。因此,本课题回顾性连续地收集了在2016 年1 月至2018 年12 月在吉林大学白求恩第一医院完成肾移植患者的临床资料,通过增加患者的随访时间和预后指标,弥补了国内相关研究在随访时间上的不足,进而探讨并分析了该基因突变引起的表型异质性在实际临床工作中对移植术后服用免疫抑制剂的指导作用。
1 资料与方法
1.1 研究对象及分组:本研究共纳入152 例合乎标准的肾移植受者,根据通过PCR 序列特异性引物(sequence specific primer,PCR-SSP)分析法确定的CYP3A5*1 的表达情况,将总体患者分为CYP3A5*1 表达组(AA、AG)与CYP3A5*1 非表达组(GG),分别为28 例、124 例。各组患者的基因型均符合哈-温遗传平衡检验。通过电子病案系统及纸质病案中调取相关临床资料,对每位患者规律随访2 年以上。纳入标准:① 首次行肾移植的成年患者;② 免疫治疗方案为Tac + MMF +激素。排除标准:① 术后使用了可能影响Tac 浓度的药物;② 有肝脏疾患或其他导致转氨酶升高的肝脏疾病;③ 随访期间失访;④ 术后半年内去世的;⑤ 术后随访期间调整Tac 剂型或换药的。
1.2 随访方案:本中心早期勤随访,中后期规律随访策略。通常的随访要求为术后45 d 内,每周至本科室肾移植随访室随访1 次;术后45 ~90 d,每隔2 周到科随访1 次;术后90 d 至半年,每3 周到科随访1 次;术后半年至1 年,每月到科随访1 次;术后2 年内,则按每年6 次的频率随访;移植2 年以后,则按每年4 次的频率随访。本研究的随访时间点为术后第2 周、第1 个月、第3 个月、第6 个月、第1 年和第2 年。纳入研究的随访内容包括他克莫司谷浓度、他克莫司服药剂量、血肌酐、尿素氮、转氨酶、白蛋白、血红蛋白、血糖水平,以及随访期内肾穿刺病理类型、术后并发症。除有终止事件外(死亡、失功等),其余患者均随访满2 年。
1.3 数据分析:所有的研究数据采用SPSS 25.0 统计,计量资料先正态性检验,如满足,则用均数±标准差(±s)表示,用学生t 检验完成对组间比较;若不符合正态性分布,表示方法则用中位数(四分位数)〔M(QL,QU)〕,比较组间的分析方法采用Mann-Whitney U 检验。计数资料视数据的理论频数不同情况,采用卡方检验、Fisher 确切概率法。若P <0.05,则表示组间具有统计学差异。
2 结 果
2.1 纳入肾移植受者术前的基本特征:女性52 例(34.21%),平均年龄为(43.90±10.81)岁,平均体重为(65.51±12.02)kg。CYP3A5*1 表达组(AA、AG)和非表达组(GG)的术前基本资料见表1,显示两组间的基本临床资料差异较小(P >0.05),具有同质性和可比性。

表1 CYP3A5*1 表达组与非表达组肾移植受者的一般临床特征
2.2 CYP3A5*1 表达组在术后随访点的他克莫司C0/D 值明显低于CYP3A5*1 非表达组:由于C0/D值呈现偏态分布,故而采用中位数(四分位数)〔M(QL,QU)〕表示。他克莫司C0/D 值为全血他克莫司血药浓度(ng/ml)与他克莫司体重标准化后的每日口服量〔mg/(kg·d)〕的比值所得。在术后早期,CYP3A5*1 表达组的C0/D 值均显著低于CYP3A5*1 非表达组(P <0.01,表2)。

表2 不同CYP3A5 基因型患者在肾移植术后不同时间点的C0/D 值〔M(QL,QU)〕
2.3 各组患者在术后的肾功能:在术后各个时间点,两组患者在血肌酐的差异均无统计学意义。在术后第3、6 个月,CYP3A5*1 表达组中,仅血尿素氮的水平显著低于CYP3A5 非表达组(P <0.05);而在剩余4 个时间点,两组之间的比较无显著差异(见图1)。
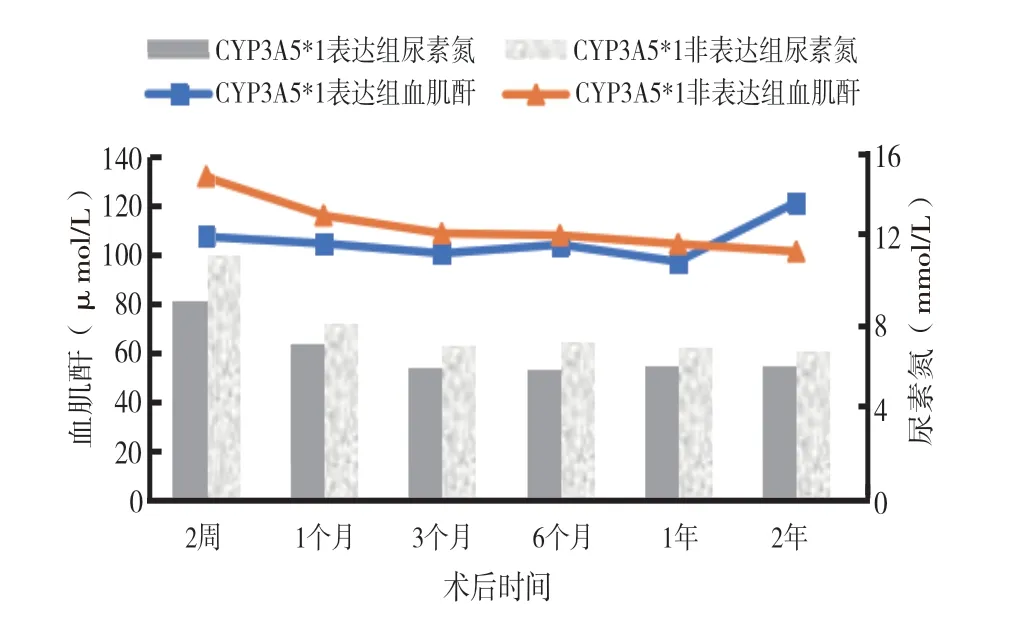
图1 各组患者术后肾功能的比较
2.4 不同CYP3A5 基因型患者在肾移植术后不同时间点的肝功能:在术后随访期的6 个常规时间点,两组间ALT、AST 和白蛋白水平的差异均无统计学意义(图2、3,均为P >0.05)。
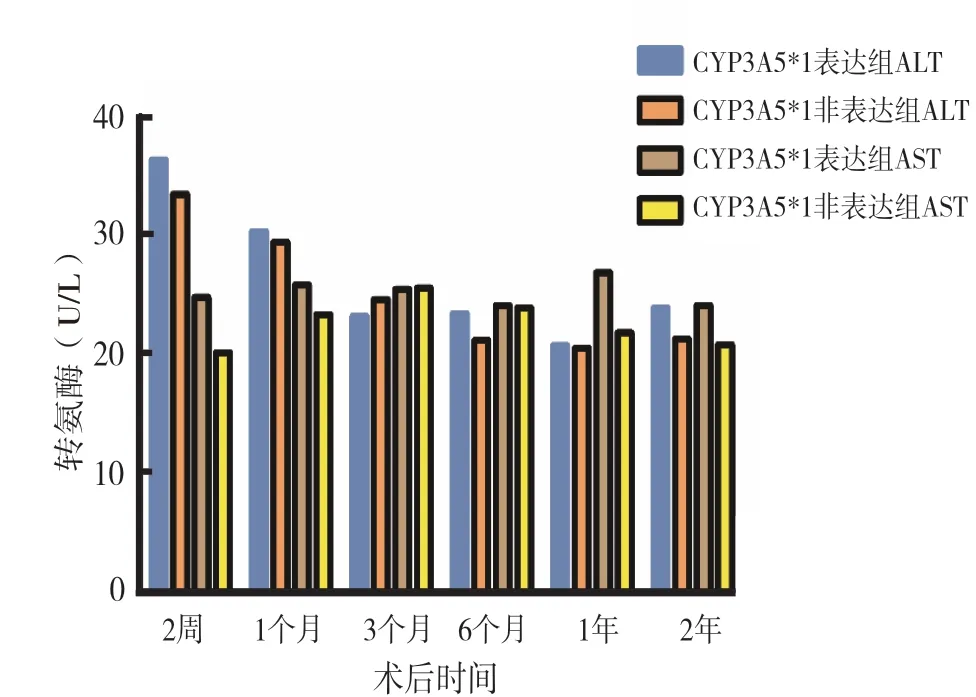
图2 各组患者术后肝功能的比较

图3 各组患者术后白蛋白的比较
2.5 不同CYP3A5 基因型患者在肾移植术后不同时间点的血红蛋白及空腹血糖水平:在本研究的术后6 个随访时间点,两组间的血红蛋白和空腹血糖水平未见统计学差异(图4、5,均为P >0.05)。
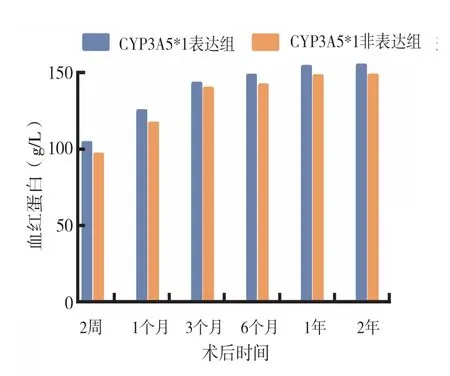
图4 各组患者术后血红蛋白的比较

图5 各组患者术后空腹血糖的比较
2.6 比较三组患者的移植肾穿刺病理:随访期间,共有41 例在不同时间点进行了54 例次的移植肾穿刺活检。其中CYP3A5*1 表达组10 例次(8 例,28.57%),CYP3A5*1 非表达组44 例次(33 例,26.61%),两组在穿刺人次的比较上无统计学差异(c2=0.044,P >0.05)。相关病理结果见表3,两组患者在移植肾穿刺病理类型上,未见统计学差异。

表3 不同CYP3A5 基因型患者在肾移植术后的移植肾穿刺病理〔例(%)〕
2.7 两组肾移植受者的术后并发症未见统计学差异:随访期内共发生4 例患者去世,呼吸系统感染是主要死亡原因,间质性肺炎占2 例,是首要感染类型。整体上肾移植术后并发症主要为肺部和尿路感染。两组患者肾移植术后的并发症未见统计学差异(P >0.05),具体并发症例数和占比见表4。
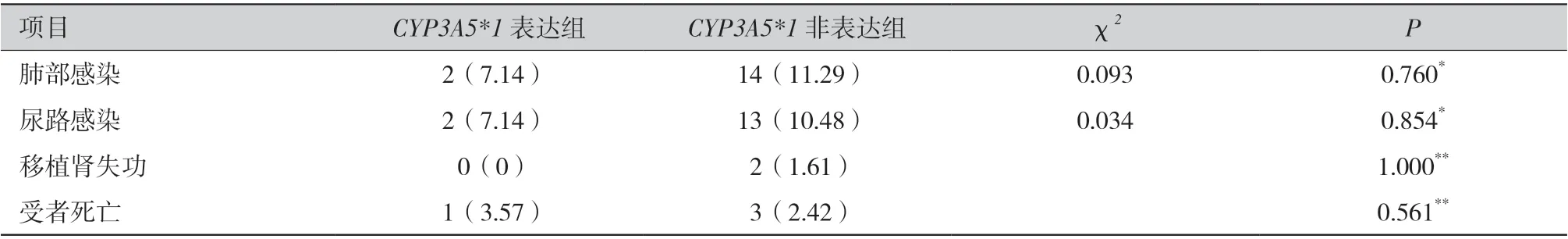
表4 不同CYP3A5 基因型患者的肾移植术后并发症〔例(%)〕
3 讨 论
自20世纪90年代随着移植规模逐渐扩大以来,他克莫司已然广泛应用于抗排斥反应治疗、成为移植术后的用药基石[8-9]。在携带CYP3A5*3 突变体基因的患者中,其表达的蛋白CYP3A5 的药物代谢能力降低或失活,从而使其水解代谢药物的下降,药物在不同个体的浓度差异性进一步增大[10-11]。主要药物代谢酶的编码基因由于基因多态性使其对免疫抑制剂的代谢有显著差异,这是他克莫司具有明显个体差异性的主要原因。国内外大量关于细胞色素P450 酶系影响Tac 药物浓度的临床研究表明,携带CYP3A5*1 的患者体内由于具有高药物代谢清除率,如不更换其他一线抗排斥反应药物,则往往使患者服用相较于其他类型患者更高的药物剂量[12-14]。本研究通过研究152 例肾移植患者术后2 年内的他克莫司血药代谢表明,相较于CYP3A5*1非表达组,CYP3A5*1 表达组的患者他克莫司C0/D值明显更低,并且随着术后时间延长,两组C0/D值均有升高趋势。就他克莫司单日服药剂量而言,本研究发现CYP3A5*1 表达组比非表达组增加约0.02〔mg/(kg·d)〕,这与一项Meta 分析的结果相似[15]。国内外多项临床研究表明,尽管我们在术后随访过程中对携带CYP3A5*3 纯合子的患者用了不同的手段调整其体内的药物浓度,但由于患者间存在代谢酶工作能力的差异,使这类患者的药物浓度仍然显著高于野生型和其他突变类型[16-20]。本研究的结果显示,在6 个随访时间点上,CYP3A5*1 表达组的他克莫司全血浓度均值均低于CYP3A5*1 非表达组,而仅在2 个时间点的差异具有统计学意义。这可能是由于通过我中心较为高效且积极的个体化药物剂量调整,能较快的使快代谢患者的血药浓度维持在正常水平。
Rojas 等[21]完成的一项的Meta 分析表明,CYP3A5*1 表达者具有更高的急排发生风险(OR =1.32,95% CI =1.02 ~1.71,I2=3%)。同样,国内研究人员Tang 等[13]的Meta 也表明,在肾移植术后早期临床研究中(首月),CYP3A5 表达者的移植肾急性排斥发生率可能高于非表达者。然而另一方面,与上述的研究结论相反,多项单中心临床研究表明,尽管细胞色素酶系基因多态性对他克莫司的药物代谢存在显著影响,但肾移植患者术后的经活检证实的急性排斥反应的发生与受者的CYP3A5 基因多态性无关[7,17,22-25]。另有一些研究表明,肾移植患者术后的急性排斥发生率可能与人种、他克莫司药物浓度变异度等因素相关[26-27]。本研究对肾移植术后所行的移植肾穿刺活检病理结果表明,CYP3A5*1 表达组与非表达组的各病理类型大致相当,未见统计学差异。这可能是由于本研究中CYP3A5*1 表达组所纳入的样本量较少,也可能是本中心患者随访积极,能够及时通过调整他克莫司服药剂量从而使他克莫司浓度维持在合理范围,有效抑制T 淋巴细胞在术后活化,避免了因抗排斥药物浓度不足所引起的急慢性排斥反应的发生。
根据研究目的和临床研究的需要,本研究同时分析了CYP3A5 基因多态性对肾移植患者术后的多个指标的影响程度(包括肾功能、肝功能、血红蛋白、血糖水平、术后并发症等指标)。结果表明,尽管由于CYP3A5*1 的存在导致患者出现他克莫司高代谢率,进而需要服用更高剂量的他克莫司;但是与CYP3A5*1 非表达组相比,两组患者在上述指标上面的差异并未见显著的统计学差异。术后移植肾穿刺病理活检表明,两组患者少见他克莫司肾毒性。上述对肾移植术后恢复的相关结果表明,通过定期随访,积极调药,在维持Tac 处于正常范围的同时,并不会恶化CYP3A5*1 表达组患者的相关临床指标。与本研究结果相似的是,国内临床研究者李冰玉等[28]人研究了药物代谢酶类和转运体分子的变异情况,其单中心研究结果表明,与未感染组相比,感染组患者的CYP3A5 的突变情况无统计学差异,并且突变与否并非感染的危险因素。
他克莫司剂型对患者血药浓度是存在影响的,每日1 次的缓释剂型正为更多的移植中心所接受。考虑到我中心的患者主要服用普通剂型,因此在纳入排除标准中,我们舍弃了一部分服用他克莫司缓释剂型的患者。有关肾移植患者服用他克莫司不同剂型的研究表明,服用他克莫司缓释剂型,可能更有利于改善患者血肌酐和肝功能(ALT,AST),并且,相较于普通剂型,服用缓释剂型的组内患者FK 血药浓度更平稳,变异度小,尿路感染的患病率无明显增加,更利于术后整体随访[29]。在五酯胶囊等P-糖蛋白抑制剂药物的临床研究中发现,五酯胶囊对Tac 血药浓度的影响仍然与CPY5A3 的突变类型有关,具体而言,CYP3A5*3 携带者在应用五酯胶囊后,C0/D 值较CYP3A5*1/*1 型升高更显著,由此可以降低这类患者免疫抑制剂用量,减轻药物毒性[30]。
综上,本研究表明,相较于CYP3A5*1 非表达组,CYP3A5*1 表达组在纳入的各个临床随访时间点上对他克莫司的代谢更快、需要更高的Tac 服药剂量才能达到目标血药浓度,而在其他临床随访项目中,我们发现肾移植受者CYP3A5 基因多态性对本研究纳入的术后各项随访指标无显著影响。但是,本研究的不足之处在于,较多的CYP3A5*1 型表达者在随访过程中更换了一线免疫抑制剂或者加用了五酯软胶囊等药物,使符合本研究纳入条件的CYP3A5*1 表达者患者较少。本文通过统计学分析,对CYP3A5 基因多态性在肾移植术后预后指标等学术界存在争议之处,尚需更多数据支持。

