赤芍总苷通过Nrf2/HO-1通路对糖尿病肾脏病大鼠肾纤维化的改善作用研究*
王 鑫,申 亮,王培珍
(1.衡水市中医医院,河北 衡水 053000;2.华北医疗集团峰峰总医院,河北 邯郸 056200;3.河北省沧州中西医结合医院,河北 沧州 061000)
糖尿病肾脏病(diabetic kidney disease,DKD)是糖尿病常见的慢性微血管并发症,也是导致糖尿病患者死亡的最重要原因[1-2]。DKD临床最初表现为尿白蛋白(albumin,Alb)排泄增加,随后肾小球滤过率逐渐下降,最终发展为终末期肾病[3]。形态学上DKD表现为肾小球基底膜增厚、系膜基质增宽及细胞外基质(extracellular matrix,ECM)积聚,导致肾小球硬化和肾小管间质纤维化(tubulointerstitial fibrosis,TIF)[4]。其中纤维化是与DKD相关高发病率及高死亡率的核心[5]。DKD发病机制复杂,因此评估DKD发病机制并制定有效的治疗措施具有重要意义。转录因子NF-E2相关因子2(transcription factor NF-E2 related factor 2,Nrf2)/血红素加氧酶1(heme oxygenase 1,HO-1)通路为抗氧化应激经典信号途径[6],该通路激活可改善糖尿病诱导的肾组织纤维化损伤[7]。赤芍总苷(total paeony glycoside,TPG)为单萜苷类化合物,是中药赤芍的主要活性成分,具有抗炎、抗氧化、调节免疫及调控血糖和血脂等药理活性[8]。目前TPG临床应用相对有限,关于TPG是否可通过Nrf2/HO-1通路改善DKD大鼠肾纤维化尚未见报道,故本研究拟通过构建DKD大鼠模型,探讨TPG对DKD大鼠肾纤维化病理损伤的改善作用及可能作用机制,以期为DKD治疗策略提供参考。
1 材料与方法
1.1 实验动物 SPF级雄性8周龄SD大鼠60只,体质量(200±20)g,由济南朋悦实验动物繁育有限公司提供,动物生产许可证号:SCXK(鲁)2019-0003。于24 ℃恒温,相对湿度45%~55%环境下普通饲养,12 h光照-12 h黑暗交替,适应性培养1周,并给予充足洁净饮水和普通饲料。研究方案经衡水市中医医院实验动物伦理委员会批准(伦理编号:IACUC2020031),实验过程遵循实验动物3R原则并给予人道主义关怀。
1.2 药物与主要试剂 赤芍购自张仲景大药房,经河北省沧州中西医结合医院中药药学部王培珍鉴定为正品;二甲双胍(纯度≥98%,批号:1115-70-4)购自宝鸡市国康生物科技有限公司;HE染色试剂盒(批号:G1120)、链脲佐菌素(streptozotocin,STZ)(批号:S8050-1)、过碘酸-雪夫(PAS)染色试剂盒(批号:G1280)、Masson染色试剂盒(批号:G1340)、丙二醛(MDA)含量检测试剂盒(批号:BC0020)、超氧化物歧化酶(SOD)含量检测试剂盒(批号:BC0170)、BCA蛋白浓度测定试剂盒(批号:PC0020)均购自北京索莱宝科技有限公司;Alb ELISA试剂盒(批号:ZK-R4044)购自深圳子科生物科技有限公司;细胞质/细胞核蛋白提取试剂盒(批号:ALH387-DWP)购自北京百奥莱博科技有限公司;Nrf2 抗体(批号:ab92946)、HO-1抗体(批号:ab68477)、平滑肌肌动蛋白(alphasmooth muscle actin,α-SMA)抗体(批号:ab7817)、纤连蛋白(fibronectin,FN)抗体(批号:ab268020)均购自美国Abcam公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG二抗(批号:WK400)购自北京博奥森生物技术有限公司。
1.3 主要仪器 XPR106DUH/AC型电子天平[梅特勒托利多科技(中国)有限公司];VHX-7000N型电子显微镜[基恩士(中国)有限公司];E0987型组织包埋机、E0972型全自动石蜡切片机均购自上海碧云天生物技术有限公司;BX53M型光学显微镜(日本OLYMPUS公司);HY-1508型石蜡切片机(德国QIAGEN公司);AU5800型全自动生化分析仪(美国贝克曼公司);5425R型高速离心机(南京贝登电子商务有限公司);MultiskanTMFC型多功能酶标仪(美国赛默飞世尔科技有限公司);1658040型垂直电泳槽(美国BIO-RAD公司);Fluor Chem E化学发光凝胶成像系统(美国ProteinSimple公司)。
1.4 TPG制备 通过乙醇回流法提取TPG[9]:清理赤芍表面杂质,粉碎过筛,70%乙醇回流提取并浓缩,过吸附柱,3倍量蒸馏水洗,然后3倍量乙醇洗脱,收集20%洗脱组分,减压回收乙醇,剩余浸膏于真空干燥器中干燥。TPG纯度达95%以上。
1.5 造模、分组及给药 随机选择10只大鼠作为对照组,剩余50只大鼠用于构建DKD模型[10]:大鼠禁食12 h,连续2 d单次腹腔注射STZ(柠檬酸缓冲液稀释至pH值为4.5),60 mg/kg,注射3 d后尾静脉采血检测大鼠空腹血糖(FBG),连续3 d的FBG≥16.7 mmol/L视为糖尿病模型构建成功,1周后进行尿Alb定性检查,尿蛋白阳性提示肾功能损害,表明成功构建DKD大鼠模型。对照组大鼠仅腹腔等量注射柠檬酸缓冲液(pH值为4.5)。成功建模43只DKD模型大鼠,随机选择40只大鼠,并随机分为模型组、TPG低剂量组、TPG高剂量组及二甲双胍组,每组10只。其中TPG低、高剂量组大鼠灌胃剂量分别为100、200 mg/(kg·d),二甲双胍组[11]大鼠灌胃剂量为250 mg/(kg·d);对照组及模型组大鼠灌胃等体积生理盐水,连续给药12周。
1.6 观察指标
1.6.1 样本采集与处理 末次给药结束后,观察大鼠一般体征,称量体质量(body weight,BW);各组大鼠均被放置于单独的代谢笼里,收集24 h尿液以检测尿Alb含量;然后禁食12 h,腹腔注射2%戊巴比妥钠(30 mg/kg)麻醉大鼠,尾静脉采血检测FBG;采集眼眶血,4 ℃,2 500 r/min离心20 min,取上清液并保存于-80 ℃,以检测血肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)水平;处死大鼠,摘取肾脏,生理盐水冲洗右肾并擦拭干净后称量肾脏质量(kidney weight,KW),然后将各组大鼠右肾保存于4%多聚甲醛溶液以用于组织病理学染色;左肾保存于液氮中用于氧化应激因子及Western blotting检测。
1.6.2 大鼠肾脏指数(kidney index,KI) 测定大鼠KI以评估肾功能损害程度,KI=KW/BW×100。
1.6.3 24 h尿Alb含量 收集24 h尿液,4 ℃,3 000 r/min离心15 min,收集上清液。使用ELISA法检测,设置标准品孔和样本孔:标准品孔加不同浓度标准品50 μL,样本孔先加5倍稀释的尿液50 μL,后于各孔加入HRP标记的抗体,37 ℃温育1 h,洗板,加入底物A、B避光孵育15 min,终止液终止反应,450 nm波长处测定各孔OD值。绘制标准曲线并计算Alb含量。
1.6.4 肾组织HE染色 肾组织经4%多聚甲醛固定24 h后,经常规石蜡包埋制备成3 μm肾组织石蜡切片,二甲苯、梯度乙醇及蒸馏水脱蜡,0.5%苏木精染液染色2 min,1%盐酸乙醇分化5 s,1%伊红染色3 min,脱水、透明,中性树胶封片,镜下观察并采集图片。
1.6.5 肾组织PAS染色 肾组织切片经二甲苯、梯度乙醇及蒸馏水脱蜡,碘酸氧化溶液脱蜡5 min,希夫试剂脱蜡15 min,苏木精染色1 min,1%盐酸乙醇分化3 s,脱水、透明封片,中性树胶封片,镜下观察并采集图片。PAS糖原阳性呈紫红色,用于评估基底膜、系膜基质变化情况。
1.6.6 肾组织Masson染色 肾组织切片经0.5%苏木精染色5 min,洗涤,0.5%盐酸酒精分化20 s,洗涤,Masson复合染色液染色5 min。0.2%乙酸溶液洗涤,5%磷钼酸溶液反应5 min,0.2%乙酸溶液洗涤,2%苯胺蓝溶液浸泡20 s,无水乙醇洗涤并干燥,中性树胶封片,镜下观察并采集图片。肾间质区胶原染色呈蓝色,用于评估肾纤维化。
1.6.7 肾组织MDA含量及SOD活性 取200 mg肾脏组织,按质量利用生理盐水将其制备为10%组织匀浆,离心后取上清液0.5 mL,硫代巴比妥酸比色分析法测定MDA含量;黄嘌呤氧化酶法测定SOD活性。
1.6.8 肾组织中Nrf2、HO-1、α-SMA、FN蛋白相对表达量 取液氮保存的肾脏组织,研钵碾碎,根据全蛋白提取试剂盒及细胞质/细胞核蛋白提取试剂盒说明书提取肾组织全蛋白及核蛋白。测定蛋白浓度并加热变性蛋白,SDS-PAGE电泳,转膜,将PVDF膜于5%脱脂乳中37 ℃封闭2 h后,直接放于一抗(均1∶1 000稀释)内4 ℃孵育过夜;次日洗膜,多次换液后,将PVDF膜于二抗(1∶8 000稀释)内孵育2 h,多次洗膜后,利用ECL显影试剂于化学发光凝胶成像系统显影,并拍照记录。采用Image J软件分析条带灰度值,以目的蛋白总Nrf2、核Nrf2、HO-1、α-SMA及FN与内参GAPDH灰度值比值表示蛋白的相对表达量。
1.7 统计学方法 采用SPSS 22.0软件分析数据,计量资料以“均数±标准差”(±s)表示,多组间样本比较采用单因素方差分析,进一步组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠一般体征及KI变化情况 与对照组比较,模型组大鼠精神萎靡,运动迟缓,被毛粗糙无光泽,多饮多食,体型消瘦;与模型组比较,TPG低、高剂量组及二甲双胍组大鼠上述症状均有所好转。5组大鼠KI比较,差异有统计学意义(P<0.05)。模型组大鼠KI高于对照组(P<0.05);TPG低、高剂量组及二甲双胍组大鼠KI均低于模型组(P<0.05);TPG高剂量组及二甲双胍组大鼠KI均低于TPG低剂量组(P<0.05);二甲双胍组大鼠KI低于TPG高剂量组(P<0.05)。(见图1)
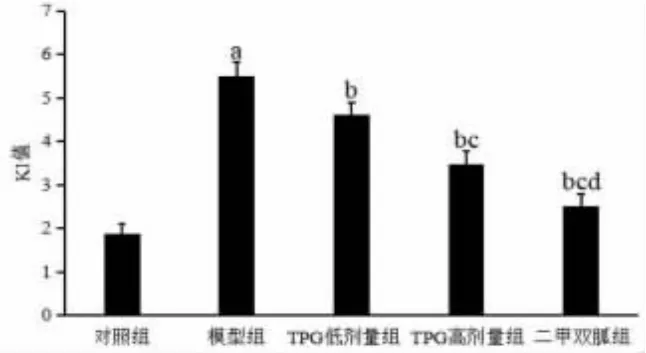
图1 各组大鼠KI 比较 (±s,n=10)
2.2 各组大鼠24 h尿Alb含量比较 5组大鼠24 h尿Alb含量比较,差异有统计学意义(P<0.05)。模型组大鼠24 h尿Alb含量高于对照组(P<0.05);TPG低、高剂量组及二甲双胍组大鼠24 h尿Alb含量均低于模型组(P<0.05);TPG高剂量组及二甲双胍组大鼠24 h尿Alb含量均低于TPG低剂量组(P<0.05);二甲双胍组大鼠24 h尿Alb含量低于TPG高剂量组(P<0.05)。(见图2)
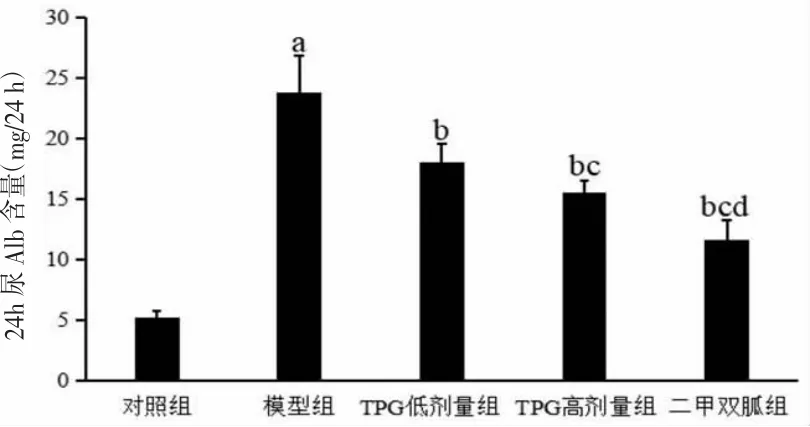
图2 各组大鼠24 h 尿Alb 含量比较 (±s,n=10)
2.3 各组大鼠FBG、Scr、BUN水平比较 5组大鼠FBG、Scr、BUN水平比较,差异有统计学意义(P<0.05)。模型组大鼠FBG、Scr、BUN水平均高于对照组(P<0.05);TPG低、高剂量组及二甲双胍组大鼠FBG、Scr、BUN水平均低于模型组(P<0.05);TPG高剂量组及二甲双胍组大鼠FBG、Scr、BUN水平均低于TPG低剂量组(P<0.05);二甲双胍组大鼠FBG、Scr、BUN水平均低于TPG高剂量组(P<0.05)。(见图3)

图3 各组大鼠FBG、Scr、BUN 水平比较 (±s,n=10)
2.4 大鼠肾脏组织形态学变化 HE染色结果显示,对照组大鼠肾小球大小正常,形状规则,结构完整,肾小管管腔无渗出,上皮细胞排列整齐;与对照组比较,模型组大鼠肾小球膨出、囊腔变小,部分肾小管上皮细胞空泡变性、萎缩坏死,炎症细胞浸润明显增多;与模型组比较,TPG低、高剂量组及二甲双胍组大鼠肾组织病理损伤情况逐渐好转,炎性渗出逐渐减少,肾小球大小、形状及结构逐渐恢复正常。(见图4)

图4 各组大鼠肾组织HE 染色图 (×400)
2.5 大鼠肾脏组织系膜基质、基底组织学变化 PAS染色结果显示,对照组大鼠肾脏组织结构正常。与对照组比较,模型组大鼠肾组织有大量红染糖原沉积;TPG低、高剂量组及二甲双胍组大鼠肾小球基底膜逐渐变薄,系膜区域范围减小,糖原沉积逐渐减少,肾小管管状结构逐渐恢复正常。(见图5)

图5 各组大鼠肾组织PAS 染色图 (×400)
2.6 大鼠肾脏组织胶原蛋白沉积情况 Masson染色结果显示,对照组大鼠肾脏组织结构正常。与对照组比较,模型组大鼠肾小球及肾小管间质病变处胶原蛋白过度沉积,呈深色蓝染,肾纤维化严重;与模型组比较,TPG低、高剂量组及二甲双胍组大鼠肾组织胶原纤维蓝染变淡,范围减少,肾纤维化程度逐渐减弱。(见图6)

图6 各组大鼠肾组织Masson 染色图 (×400)
2.7 各组大鼠肾组织中MDA含量及SOD活性比较 5组大鼠肾组织中MDA含量及SOD活性比较,差异均有统计学意义(P<0.05)。模型组大鼠肾组织中MDA含量高于对照组(P<0.05),SOD活性低于对照组(P<0.05);TPG低、高剂量组及二甲双胍组大鼠肾组织中MDA含量均低于模型组(P<0.05),SOD活性均高于模型组(P<0.05);TPG高剂量组及二甲双胍组大鼠肾组织中MDA含量均低于TPG低剂量组(P<0.05),SOD活性均高于TPG低剂量组(P<0.05);二甲双胍组大鼠肾组织中MDA含量低于TPG高剂量组(P<0.05),SOD活性高于TPG高剂量组(P<0.05)。(见图7)
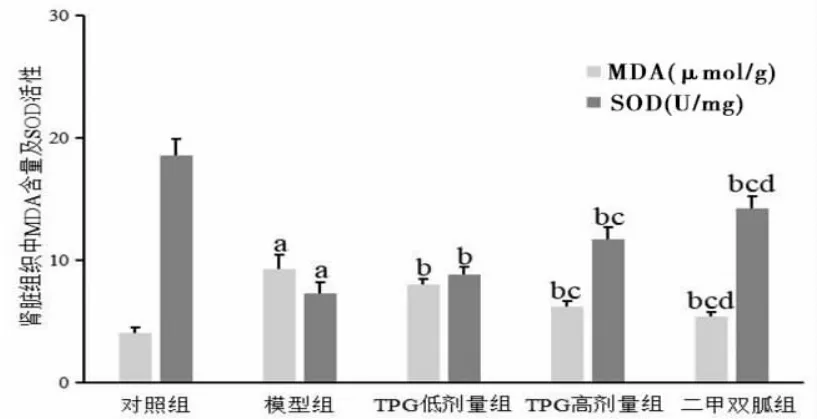
图7 各组大鼠肾脏组织中MDA 含量及SOD 活性比较(±s,n=10)
2.8 各组大鼠肾组织中Nrf2、HO-1、α-SMA、FN蛋白相对表达量比较 5组大鼠肾组织中总Nrf2蛋白相对表达量比较,差异无统计学意义(P>0.05);5组大鼠肾组织中核Nrf2、HO-1、α-SMA、FN蛋白相对表达量比较,差异均有统计学意义(P<0.05)。模型组大鼠肾组织中核Nrf2、HO-1蛋白相对表达量均低于对照组(P<0.05),α-SMA、FN蛋白相对表达量均高于对照组(P<0.05);TPG低、高剂量组及二甲双胍组大鼠肾组织中核Nrf2、HO-1蛋白相对表达量均高于模型组(P<0.05),α-SMA、FN蛋白相对表达量均低于模型组(P<0.05);TPG高剂量组及二甲双胍组大鼠肾组织中核Nrf2、HO-1蛋白相对表达量均高于TPG低剂量组(P<0.05),α-SMA、FN蛋白相对表达量均低于TPG低剂量组(P<0.05);二甲双胍组大鼠肾组织中核Nrf2、HO-1蛋白相对表达量均高于TPG高剂量组(P<0.05),α-SMA、FN蛋白相对表达量均低于TPG高剂量组(P<0.05)。(见图8~9)

图8 各组大鼠肾组织相关蛋白表达Western blotting 图
3 讨 论
有研究表明,改善糖尿病肾脏病炎症反应、清除炎症因子可达到改善TIF的作用[12]。但据其他文献报道,氧化应激在TIF及系膜硬化、足细胞异常和壁上皮细胞损伤引起的肾小球硬化中同样具有重要驱动作用[13]。TIF作为进行性肾脏病常见途径,其特点为ECM蛋白在肾单位间隙中积聚,为肾功能下降指标,标志着不可逆肾损伤[14]。这提示抗氧化应激反应也是DKD治疗策略的重要参考机制之一。
持续高血糖水平可促进肾小球脂质过氧化和系膜细胞中H2O2的产生,导致氧化应激反应[15]。本研究中大鼠经连续单次腹腔注射STZ后,FBG水平持续升高并出现尿蛋白阳性,提示成功诱导构建DKD大鼠模型。与对照组比较,模型组大鼠机体状态不佳,KI、尿Alb、Scr及BUN水平等肾脏功能障碍指标均升高,提示高FBG可驱动糖尿病大鼠肾脏损伤及机体状态失常。二甲双胍为双胍衍生物,已成为治疗2型糖尿病的首选一线口服降糖药[16]。本研究结果显示,经低、高剂量及二甲双胍治疗后,DKD大鼠FBG水平降低,提示TPG具有降血糖作用;且大鼠KI、尿Alb、Scr及BUN水平等肾功能障碍指标均降低,机体一般体征逐渐好转,提示TPG可能通过降低血糖改善肾功能障碍。病理组织学染色显示:模型组大鼠肾组织出现明显病理变化,提示DKD大鼠肾功能障碍可能由肾组织结构病理损伤及肾纤维化引起;经低、高剂量及二甲双胍治疗后,DKD大鼠肾组织病理改变均明显好转,提示TPG可能通过降血糖作用促进DKD大鼠肾组织病理损伤的恢复,并减轻纤维化进展。
氧化还原稳态是维持正常生理的重要组成部分。MDA、SOD为氧化应激标志物,MDA是脂质过氧化的终产物,SOD是一种清除氧自由基的金属酶,两者均可反映体内氧化应激水平[17]。研究[18]发现,模型组大鼠MDA含量显著升高,SOD活性显著降低。二甲双胍可通过降低血糖增强机体抗氧化状态[19]。本研究结果显示,模型组大鼠肾组织中MDA含量高于对照组,SOD活性低于对照组,提示机体存在氧化应激反应,且抗氧化能力较弱;经低、高剂量TPG及二甲双胍治疗后,DKD大鼠肾组织中MDA含量降低,SOD活性升高,提示TPG可通过降低氧化应激因子表达,提高抗氧化酶活性,进而提高DKD大鼠机体抗氧化能力。Nrf2是哺乳动物细胞响应内源性和外源性压力的关键细胞保护调节剂。生理条件下,Nrf2被其抑制性胞质蛋白即Kelch样ECH相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)灭活;氧化损伤时,Nrf2从Keap1释放并转移到细胞核中,Nrf2与细胞核中的抗氧化反应元件结合并调节抗氧化基因(如HO-1)的转录,HO-1诱导被认为是对氧化应激的适应性细胞反应[20]。本研究结果显示,模型组大鼠核Nrf2、HO-1蛋白相对表达量低于对照组,而经低、高剂量TPG及二甲双胍治疗后,DKD大鼠核Nrf2、HO-1蛋白相对表达量均升高,提示TPG可能通过激活Nrf2/HO-1通路提高机体抗氧化水平。研究发现,Nrf2/HO-1信号通路激活可减轻肾纤维化[7],α-SMA为肌成纤维细胞标记物,肌成纤维细胞是ECM的主要来源[21];ECM主要由FN、胶原蛋白、层黏连蛋白和蛋白聚糖4组成,葡萄糖水平升高可导致FN基质组装显著增加[22]。本研究结果显示,模型组大鼠肾组织中α-SMA及FN蛋白相对表达量均高于对照组,提示肾纤维化严重;经低、高剂量TPG及二甲双胍治疗后,DKD大鼠肾组织中α-SMA及FN蛋白相对表达水平均降低,提示TPG可能通过激活Nrf2/HO-1通路减轻DKD大鼠肾纤维化。
综上所述,TPG可改善DKD大鼠机体状态及组织病理损伤,减弱肾纤维化程度,降低血糖,增强肾功能,其机制可能与激活Nrf2/HO-1通路,提高DKD大鼠抗氧化能力有关。

