阿霉素致肺损伤小鼠心脏毒性的代谢组学研究
吴 婧,于心悦,徐 燕,黄 寅*,张语馨
(1中国药科大学南京鼓楼医院,南京 210008;2中国药科大学药物分析系,南京 210009)
肿瘤严重危害人类生命健康。过去30 年中,肿瘤治疗方法取得长足进展,患者生存时间显著延长、病死率持续下降[1]。然而,肿瘤治疗导致的相关疾病的发病率却逐年上升,尤其是化疗所致心脏毒性,因其致死率高而引起广泛关注[2]。以阿霉素(doxorubicin,DOX)为代表的蒽环类药物被广泛用于治疗实体瘤和血液系统恶性肿瘤,其抗肿瘤机制主要为通过插入DNA 链形成DOX-DNA-拓扑异构酶Ⅱ三元复合物来阻断DNA 的合成[3]。但是,DOX 与心肌组织的亲和力显著高于其他组织,导致其在心脏中蓄积,引起进展性且不可逆的心脏毒性[4]。美国的一项回顾性研究表明,当DOX累积剂量达55 mg/m2时,心力衰竭的发生率大于26%,病死率高达30% ~ 50%[5]。对此,科学家们采用分子生物学和多组学技术开展了深入研究,发现DOX 可通过激活Toll 样受体、抑制AMPK 信号通路、扰乱线粒体代谢稳态等多种机制诱导心肌损伤[6-7]。
目前,针对抗肿瘤药心脏毒性的研究大多聚焦于心脏或心肌细胞,而忽视了其他脏器的作用。肺功能异常与心脏疾病的发生紧密关联。如COVID-19 患者通常表现为呼吸道感染症状和体征,但包括心肌损伤征象在内的心脏临床表现也十分常见[8]。肿瘤患者发生肺损伤的原因主要有两方面:一是自身疾病,如肺部感染或肺动脉高压等;二是抗肿瘤治疗,如一些肺癌或乳腺癌患者接受放疗后会出现肺损伤[9]。针对肺功能不全的患者,DOX心脏毒性是否会加重?毒性作用靶点和通路是否有所改变?这些问题尚未见研究报道。
为此,本研究采用经典的、具有肺毒性的化疗药物博莱霉素(bleomycin,BLM)构建小鼠肺损伤模型,继而给予DOX 诱导心脏损伤,采用血清标志物和组织病理学检查评价心脏损伤程度;整合运用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)和液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)联用技术对心脏进行代谢组学分析,通过多元统计分析筛选差异代谢物并聚焦关键代谢通路。研究结果将为深入阐明蒽环类药物对肺损伤状态下的心脏毒性及作用机制提供科学参考。
1 材 料
1.1 试 剂
N-甲基-N-(三甲基硅烷基)三氟乙酰胺(MSTFA,含量大于99.9%)、盐酸甲氧胺(MOX,含量大于99.9%)、吡啶、内标十七酸(美国Sigma-Aldrich公司);甲醇、乙腈及乙酸乙酯(色谱纯,德国Merk公司);内标格列苯脲(中国食品药品检定研究院,批号:121633-201017);注射用盐酸多柔比星(阿霉素,深圳万乐药业有限公司,批号:H44024359);博莱霉素(日本化药株式会社,批号:410730);注射用生理盐水(安徽双鹤药业有限责任公司);水合氯醛(国药集团化学试剂有限公司);多聚甲醛固定液(武汉塞维尔生物科技有限公司);脑利钠肽(brain natriuretic peptide,BNP)和心肌肌钙蛋白(cardiac troponin I,cTn-I)试剂盒(南京森贝伽生物科技有限公司)。
1.2 仪 器
UFLC-IT-TOF/MS 液质联用仪、GC/MSQP2010Ultra 气质联用仪(日本岛津公司);CentriVap®离心浓缩仪(美国Labconco 公司);TMS-200恒温混匀仪(杭州奥盛仪器有限公司);5430R冷冻离心机(德国Eppendorf 公司);Milli-Q 纯水制备系统(美国Millipore 公司);Infinite 200 Pro 酶标仪(瑞士Tecan 公司); Eclipse Ti-U 倒置显微镜(日本尼康株式会社)。
1.3 动 物
SPF 级雄性C57BL/6J小鼠36 只,体重(21 ± 2)g,7 ~ 8 周龄,购自杭州子源实验动物科技有限公司,许可证号SCXK(浙)2019-0004。动物实验遵循中国药科大学伦理委员会批准的《实验动物管理方法》等相关规定。小鼠每日光照12 h,温度(24 ± 2)℃,湿度(50 ± 5)%,给予标准饲料及饮用水,以充分适应环境。
2 方 法
2.1 动物实验
小鼠适应性饲养1 周后,根据体重随机分为以下4 组:对照组(CON,6 只)、博莱霉素组(BLM,8 只)、阿霉素组(DOX,10 只),阿霉素+博莱霉素组(DOX + BLM,12 只)。实验方案如图1-A 所示:第1 天,小鼠腹腔注射4%水合氯醛麻醉,BLM 以5 mg/kg 剂量滴入气管,翻动小鼠使其在小鼠体内均匀涂布,其余组小鼠以相同方式滴注生理盐水;第2 天开始,每周注射1 次7.5 mg/kg DOX,共注射两次,累积剂量为15 mg/kg;其余组小鼠腹腔注射等体积生理盐水。在实验期间,隔天测量动物体重并记录动物死亡时间;第15天,眼底静脉丛采血后处死小鼠,取胫骨测量长度,收集心脏、肺组织样本,称重并适当保存。
2.2 心肺损伤程度评价
取小鼠心脏底部约1/3 部分以及肺右前叶,多聚甲醛中固定,石蜡包埋并切片(5 μm),切片脱蜡水化后经苏木精-伊红(H&E)染色,于倒置显微镜下观察损伤程度。血清脑利钠肽(BNP)和心肌肌钙蛋白(cTn-I)采用酶联免疫分析(ELISA)试剂盒(南京森贝伽生物科技有限公司)测定,实验步骤及计算均按试剂盒说明书操作。取小鼠肺右下叶称重,并在60 ℃条件下干燥72 h后再次称重,以两次重量计算肺湿/干重比。
2.3 非靶向代谢组学分析
2.3.1 样品前处理 心脏匀浆液制备:准确称重心脏置于匀浆管中,按1∶10 比例加预冷的80%甲醇,利用匀质仪(振动速度6.5 m/s,10 s 循环3 次,间隔30 min)使心脏样本匀质化,高速离心(14 000 r/min,4 ℃,10 min)两次,取上清液供后续分析。
LC-MS 样品前处理:取心脏匀浆液40 μL,加甲醇(含内标格列苯脲10 μg/mL)40 μL,涡旋混匀后,两次高速离心(14 000 r/min,4 ℃,10 min),将上清液转移至进样小瓶,待LC-MS分析。
GC-MS 样品前处理:精密量取心脏匀浆液10 μL,加甲醇(含内标十七酸5 μg/mL)100 μL,涡旋混匀后,两次高速离心(14 000 r/min,4 ℃,10 min)。取上清液80 μL 至1.5 mL 棕色反应管中,加含MOX 的吡啶溶液(10 mg/mL)25 μL 进行肟化反应,振荡反应1.5 h(37 ℃,1 200 r/min);于50 ℃真空干燥2 h;加MSTFA 试剂120 μL(MSTFA-乙酸乙酯,1∶1)进行硅烷化反应,振荡反应2 h(37 ℃,1 200 r/min)。反应完成后,高速离心(14 000 r/min,4 ℃,10 min),将上清液转移至进样小瓶,待GC-MS分析。
质控样本的制备:从每只动物的组织匀浆液中取等体积样本混匀后制得QC 样本。分析过程中,每间隔10个真实样本插入1个QC样本。
2.3.2 LC-MS 分析 色谱柱为XSelect®HSS T3 XP 柱(2.1 mm×100 mm,2.5 μm,美国Waters 公司);流动相A 为0.01%甲酸水溶液,B 为甲醇;流速为0.3 mL/min;柱温:40 ℃;进样器温度:4 ℃;进样量:5 μL;梯度洗脱程序:0 ~ 4 min,95% ~ 50%A;4 ~ 10 min,50% ~ 15% A;10 ~ 15 min,15% ~0% A,15 ~ 20 min,0% A;20 ~ 21 min,0% ~ 95%A,21 ~ 30 min,95% A。电喷雾离子源(ESI)正、负离子切换模式采集数据,质量扫描范围:m/z70 ~1 000;检测电压:1.85 kV;离子源接口电压:正离子模式4.5 kV,负离子模式−3.5 kV;曲线脱溶剂管(CDL)和加热模块温度:200 ℃;雾化气(氮气)速率:1.0 L/min;干燥气(氮气)压力:0.1 MPa;二级扫描模式时,能量设为30和45 eV。
2.3.3 GC-MS 分析 色谱柱为SH-Rxi-5sil MS 柱(30 m × 0.25 mm,0.25 μm,日本岛津公司);进样口温度:250 ℃;进样量:1 μL;分流比:50∶1;载气(氦气)流速:36.7 cm/s;升温程序如下:0 ~ 2 min,70 ℃;2 ~ 27 min,70 ~ 320 ℃;27 ~ 29 min,320 ℃。电子轰击离子源(EI)电压:70 eV;离子源温度:200 ℃;接口温度:250 ℃;扫描范围:m/z45 ~ 600。
2.4 数据处理与统计分析
采用Profiling Solution 软件(日本岛津公司)对GC-MS 和LC-MS 采集的原始谱图进行峰提取和峰对齐。将所得数据矩阵导入R Studio(ver. 4.2.0)中,使用muma 包(ver.1.4)进行单变量统计分析,根据每个变量是否成正态分布(Shapiro-Wilk 检验)分别采用t-test 或Mann-Whitney U Test 检验其组间差异的显著性,并计算组间的倍数变化(fold change,FC);分别利用factoextra 包(ver. 1.0.7)和ropls 包(ver. 1.24.0)进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal projection to latent structures-discriminant analysis,OPLS-DA),以变量投影重要性(variable importance in projection,VIP)反映各变量对分组的贡献大小。最终以P< 0.05、VIP > 1 以及FC > 1.2 或< 1/1.2 为阈值,筛选差异变量。通过与HMDB 数据库(http://www.hmdb.ca)、NIST11谱库以及实验室自建数据库比对,初步鉴定可能的代谢物结构;利用标准品对部分代谢物进行进一步确证。
脏器系数、生化指标等数据导入Prism 8.0 软件(GraphPad,美国)进行统计分析和绘图。采用单因素方差分析(One-way ANOVA)进行显著性差异检验,以P< 0.05认为具有统计学意义。
3 结 果
3.1 DOX和BLM对小鼠心肺的影响
在临床上,DOX 与BLM 联用是治疗霍奇金淋巴瘤的一线方案,BLM 可损伤肺部造成肺纤维化或严重的间质性肺病,即肺毒性。动物实验过程中,CON组与BLM组未出现动物死亡,DOX组死亡2 只,DOX+BLM 组死亡4 只;因此,3 个给药组最终均有8只小鼠存活。动物实验结果发现,BLM 对小鼠体重几乎无影响,DOX 可导致小鼠体重显著降低(图1-B),这可能与DOX具有明显的骨髓抑制作用,而BLM 对骨髓或免疫系统的抑制程度很小有关。与CON 组相比,BLM 组小鼠的肺重/胫骨长度比和肺湿/干重比显著增加(图1-C 和1-D),说明出现肺水肿。H&E 染色显示,BLM 组小鼠肺部出现了明显的肺泡壁增厚、肺泡腔缩小、结构紊乱,并伴有炎性细胞浸润(图1-E)。DOX+BLM 组小鼠的肺部也观察到了类似的变化,而DOX 组则没有。这些数据说明,利用BLM 成功构建了肺损伤小鼠模型且DOX 对肺没有明显毒性。进一步评价了各组小鼠的心脏损伤情况(图1-F ~ 1-H),发现:与CON 组相比,BLM 组小鼠仅一个血清指标(cTn-I)显著升高,组织切片等均无明显变化,说明BLM 对心脏没有明显毒性;DOX 组小鼠的心脏重量/胫骨长度之比显著下降,血清BNP 和cTn-I 水平显著增加,同时H&E染色可观察到心肌纤维排列紊乱、间隙增大,偶见细胞质嗜酸性增强,提示心肌组织损伤明显(图1-I);在DOX+BLM 组中同样观察到了明显的心脏损伤,且与DOX 组相比,心肌纤维间隙增大更加显著(图1-I),心肌损伤更明显,但仅依靠这几个指标仍无法判断肺损伤状态下DOX 诱导的心脏毒性是否更加严重。
3.2 代谢组学数据可靠性
经“80%规则”筛选、缺失值填补等前处理后,分别从GC-MS 和LC-MS 的原始图谱(图2-A)中提取到1 536 和4 439 个离子。利用无监督的PCA 方法查看QC 样本等分布情况,结果如图2-B 所示,在GC-MS 和LC-MS 的PCA 得分图上QC 样本聚集良好,且不同样本中内标的响应稳定,几乎都在2 倍标准偏差范围内波动(图2-C)。这些数据表明分析方法稳定、可重复,所得数据可靠。
3.3 差异代谢物和关键通路
为寻找DOX 诱导肺损伤小鼠心脏毒性相关的代谢特征,首先对CON 组和BLM 组的样本进行有监督的OPLS-DA 和单变量统计分析。结果显示,散点图上这两组样本重叠度很高;在GC-MS 数据中未筛选出同时满足P< 0.05、VIP > 1且FC > 1.2或< 1/1.2 的变量,在LC-MS 数据中仅鉴定出4 个差异代谢物(表1)。这些结果表明,CON 组和BLM组小鼠心脏的代谢轮廓无显著差别。这与BLM 无明显心脏毒性这一认知相符合。因此,后续重点比较分析CON 组与DOX 组以及DOX 组与DOX+BLM组的差异。
3.3.1 CON 组与DOX 组小鼠心脏的代谢差异OPLS-DA 散点图上(图3-A),CON 组和DOX 组样本有着明显区分,说明DOX 使小鼠心脏的代谢轮廓发生了非常显著的改变。共鉴定出26种差异代谢物,其中6 种来自GC-MS 分析,18 种来自LC-MS分析,2 种(天冬氨酸、谷氨酸)被两种分析手段同时检出。从表1可见,DOX心脏毒性相关的物质主要集中于氨基酸、脂肪酸、磷脂以及有机酸等与能量代谢相关的代谢物。例如,与CON 组相比,DOX组中支链氨基酸(亮氨酸和异亮氨酸)、溶血磷脂(LysoPE)以及不饱和脂肪酸(C22:5 和C24:6)等的含量显著升高,而葡萄糖、肌苷酸和谷氨酸等代谢物含量显著降低(图3-B),提示DOX改变了心脏中的供能方式。利用Metaboanalyst 5.0 进行代谢通路富集分析,发现DOX 心脏毒性主要与支链氨基酸代谢、苯丙氨酸代谢以及磷酸戊糖途径等代谢通路失调有关(图3-C)。

Figure 1 Doxorubicin (DOX) and bleomycin (BLM)-induced toxicity on mouse hearts and lungsA: Schematic of the animal model; B: Body weight changes of mice during the experiment; C, D: Lung indicators of mice among four groups; E: H&E staining of lung tissues; F: Heart indicators; G, H: Cardiac markers of mice; I: H&E staining of heart tissues (± s, CON, n = 6; BLM, n = 8; DOX, n =8; DOX+BLM, n = 8). One-way ANOVA*P < 0.05, **P < 0.01
3.3.2 DOX组与DOX+BLM 组小鼠心脏的代谢差异 进一步比较了DOX 组中有肺损伤与无肺损伤小鼠的心脏代谢差异。GC-MS 和LC-MS 数据的OPLS-DA 散点图(图4-A)共同显示,DOX 组和DOX+BLM 组样本区分明显,说明其代谢轮廓有显著差别。同时结合PCA 得分图(图2-B),DOX+BLM 组样本与CON 组相距最远。这些数据共同表明,在小分子代谢物层面肺损伤可能加剧DOX 的心脏毒性。在此基础上,进一步鉴定出13 个差异代谢物(图4-B),包括缬氨酸、异亮氨酸、赖氨酸等,主要涉及支链氨基酸代谢、氮代谢等通路(图4-C)。其中,赖氨酸、葡萄糖、LysoPE(16∶0)等物质是文献中已报道的、与DOX 心脏毒性密切相关的代谢标志物[10-11],它们的含量在DOX+BLM 组中变化更为显著,这进一步说明肺损伤状态下DOX的心脏毒性可能会增强。值得注意的是,支链氨基酸的含量在CON、DOX 和DOX+BLM 3 组中总体呈升高趋势(图5),且支链氨基酸代谢通路均被富集分析所发现(图3-C和图4-C)。支链氨基酸是必需氨基酸,不能由人体直接合成,需要通过饮食摄入。本研究中DOX 给药组小鼠的饮食量较健康组有所减少,故推测心脏中支链氨基酸的蓄积可能是由于DOX 抑制其分解代谢,而且肺损伤可能会进一步加剧这种抑制作用。这一发现还需更多的实验和临床数据验证。
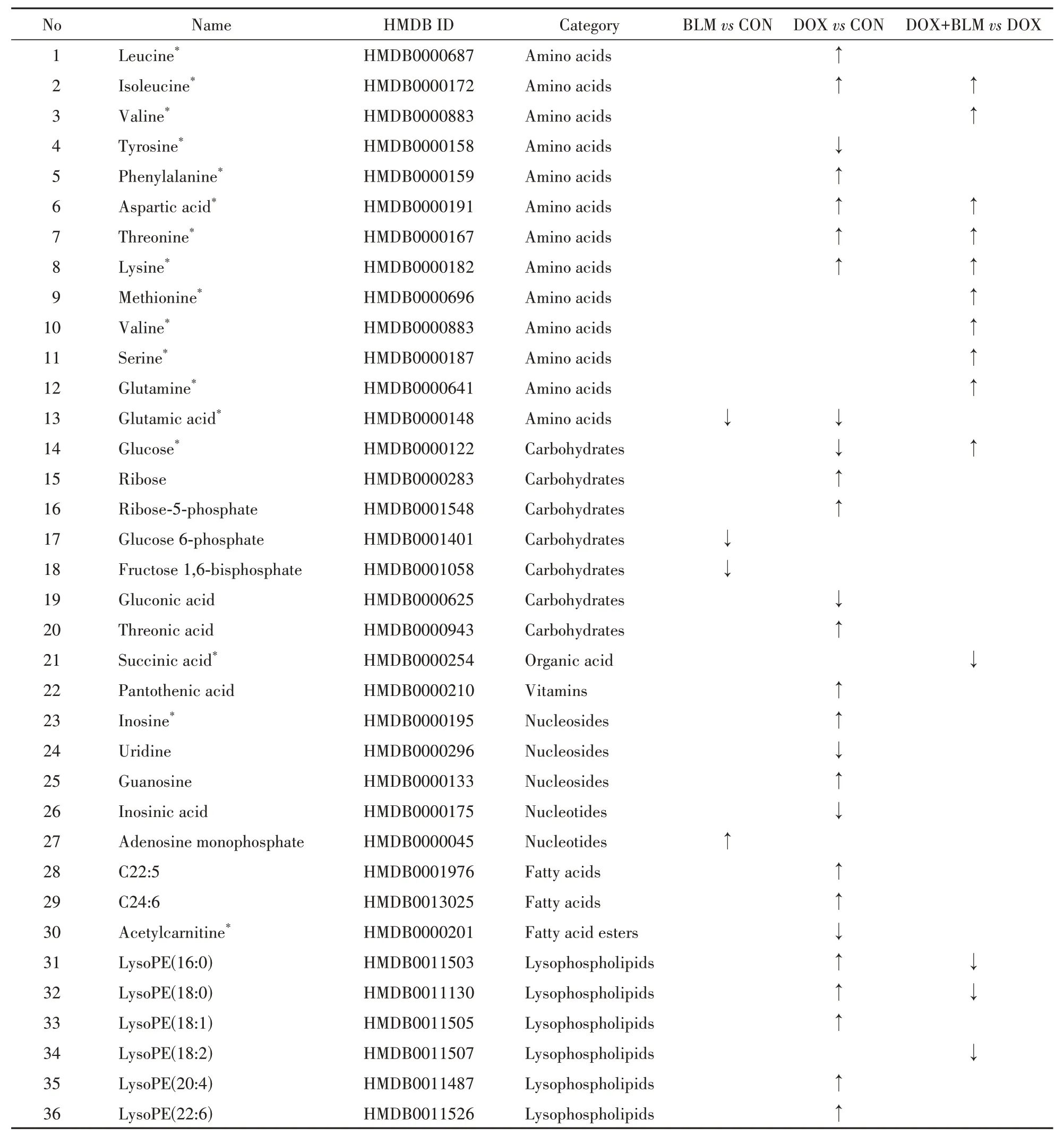
Table 1 Differential metabolites in mouse hearts after administration
4 讨 论
4.1 动物模型的构建
研究肺损伤状态下的抗肿瘤药心脏毒性,构建合适的动物模型至关重要。作者在前期研究基础上[12],结合临床给药方案和已有文献,设计了先用BLM 诱导肺损伤、再用DOX 诱导心脏损伤的小鼠模型。BLM 在临床上以肌肉或皮下注射、静脉注射等形式给药,给药剂量为15 ~ 30 mg,给药频次可依病情调整,通常为每周2 次[13]。按照正常人(60 kg)单次给药剂量换算的小鼠给药量约为3.1 ~ 6.2 mg/kg[14]。同时,根据文献,给予小鼠单次气管滴注2.0 ~ 5.0 mg/kg BLM 后14 ~ 28 d 内可造成肺纤维化[15]。故本研究采用5.0 mg/kg BLM气管滴注的给药方案,给药15 d 后确实观察到明显的肺损伤且心脏无异常(图1)。DOX 与其他化疗药物联用时,常用剂量为每21 ~ 28天单次静脉注射40 ~ 60 mg/m2[16],换算成小鼠给药量为13.3 ~19.9 mg/kg[14]。故 本 研 究DOX 诱 导 心 脏 毒 性 的给药方案为腹腔注射7.5 mg/kg,每周注射1 次,连续两周,累积剂量为15 mg/kg。结果表明,该方案下DOX 可诱导小鼠出现明显心脏损伤(BNP 和cTn-I 改变)同时肺部无明显变化(图1)。通过整合两种成熟的动物模型(BLM 诱导肺损伤和DOX诱导心脏损伤)获得了预期的结果,而DOX 和BLM 在临床上确有组合使用[17],因此该模型具有一定的临床转化意义。当然,动物模型给药方式与临床仍有差异,方案也还需进一步研究证实。
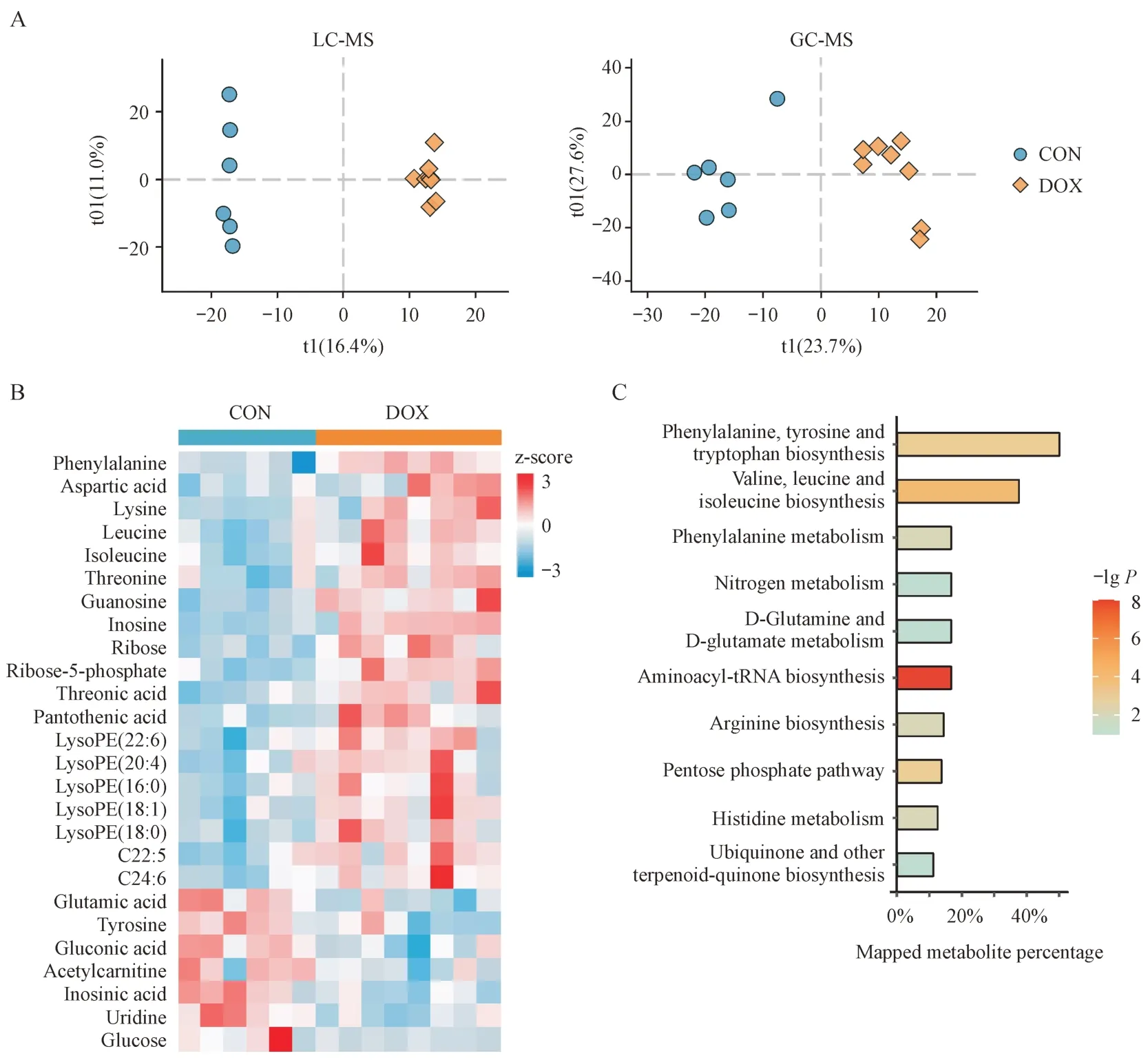
Figure 3 DOX-induces metabolic alterations in mouse heartA: OPLS-DA score plots from LC-MS and GC-MS data (LC-MS: R2X = 0.274, R2Y = 0.997, Q2 = 0.733; GC-MS: R2X = 0.514, R2Y = 0.923, Q2 =0.708); B: Heatmap of 26 differential metabolites between CON and DOX groups; C: Enriched pathways by the differential metabolites
4.2 差异代谢物的生物学意义
非靶向代谢组学分析发现,在仅发生心肌损伤的小鼠心脏中,DOX 毒性相关物质主要集中于氨基酸、脂肪酸、糖类等。长链脂肪酸是健康心脏中主要的能量代谢底物,它们通过线粒体β-氧化磷酸化为心脏提供约40% 的三磷酸腺苷(ATP)[18]。前期研究已证明[18],当DOX 诱导的心脏毒性发生时,过氧化物酶体增殖物激活受体(PPARs)被抑制,线粒体β-氧化速率降低,导致脂肪酸蓄积。研究还发现DOX 可导致小鼠心脏中支链氨基酸、芳香氨基酸、谷氨酸等一系列氨基酸等水平发生显著改变。令人意外的是,相比于DOX组,在DOX+BLM 组小鼠心脏中,本研究并未观察到脂肪酸出现更严重的蓄积,但支链氨基酸的水平却进一步升高。支链氨基酸代谢是近年来在心脏病理生理方面的研究热点之一,有研究利用基因敲除的动物模型证明,支链氨基酸代谢酶的缺失会促进心力衰竭进程,还会加重心脏由缺血再灌注造成的损伤[19]。此外,最近的研究表明,在急性心肌梗死模型中,激活支链氨基酸代谢可降低血管阻力、保护心脏[20]。这些研究说明,支链氨基酸代谢通路抑制可能是多种因素诱导心脏损伤的共同代谢特征。但是,该通路中关键的调控靶点有哪些?肺损伤如何影响这些靶点?这些问题仍需更深入的研究。
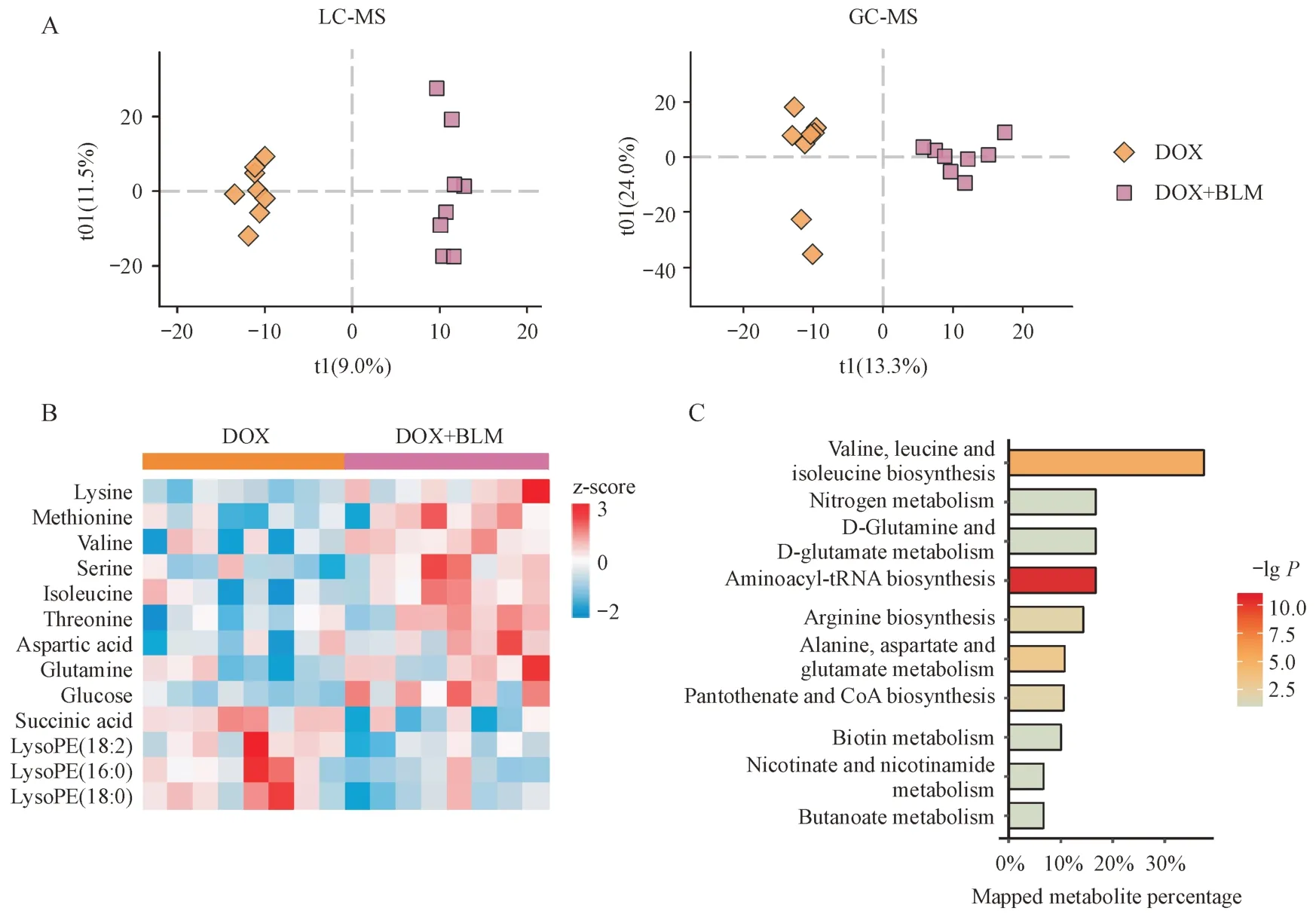
Figure 4 DOX-induced metabolic alterations in the hearts of mice with lung injuryA: OPLS-DA score plots from LC-MS and GC-MS data (LC-MS: R2X = 0.205, R2Y = 0.992, Q2 = 0.383; GC-MS: R2X = 0.374, R2Y = 0.943, Q2 =0.587); B: Heatmap of 13 differential metabolites between DOX and DOX+BLM groups; C: Enriched pathways by the differential metabolites
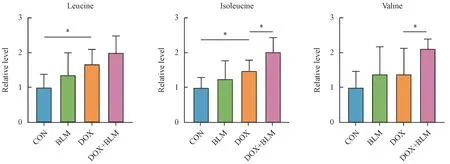
Figure 5 Relative cardiac levels of branched-chain amino acids in the mouse hearts among four groups (± s, CON, n = 6; BLM, n = 8; DOX, n = 8;DOX+BLM, n = 8)Mann-Whitney U Test, *P < 0.05
5 结 论
本研究建立了肺损伤叠加心肌损伤的小鼠模型,对DOX 和BLM 给药后小鼠心脏样本进行了非靶向代谢组学分析。结果发现在肺损伤状态下,DOX可导致心脏代谢轮廓发生更显著的变化,并初步聚焦于支链氨基酸代谢通路。研究结果为进一步探讨蒽环类抗肿瘤药物心脏毒性机制奠定了基础,也为DOX和BLM的临床合理应用提供参考。

