安徽省中药注射剂生产企业监督检查情况分析与改进策略*
王 浩,胡士高,袁建龙
(1. 安徽省药品审评查验中心,安徽 合肥 230051; 2. 福建省药品审评与监测评价中心,福建 福州 350003)
中药注射剂是在中医药理论指导下,经现代科技从天然药物的单方或复方中提取有效物质制成的可注射于人体的灭菌制剂[1]。相对于传统的中药剂型,中药注射剂因生物利用度高、疗效好、起效快,且适用于无法口服给药的患者,在心脑血管疾病、肿瘤类疾病、病毒感染类疾病等的治疗中发挥着重要作用[2]。但中药注射剂多以药材或饮片为原料经提取制备而成,客观上存在杂质、有效物质含量差异较大、易带入热原等问题,且药品不良反应(ADR)发生率高。随着药品生产质量管理规范(GMP)认证的取消,药品监管部门由5年1 次的认证检查改为随时对GMP执行情况进行检查,以监督企业的合规性。根据《药品生产质量管理规范(2010年修订)》《药品检查管理办法(试行)》《药品生产监督管理办法》《安徽省中药生产专项检查工作实施方案》的相关规定,安徽省药品审评查验中心受省药品监督管理局委托,对全省6家中药注射剂生产企业进行监督检查。本研究中分析了GMP 认证取消后安徽省中药注射剂生产企业的监督检查情况,旨在为促进中药注射剂质量管理水平与产品质量的提升提供参考。现报道如下。
1 生产现状
安徽省现持有中药注射剂批准文号的生产企业共8 家,持有批准文号最多的企业为安徽凤阳科苑药业有限公司(9 个),其次为安徽华润金蟾药业股份有限公司(2个)、安徽金太阳生化药业有限公司(1个)、上海华源安徽锦辉制药有限公司(1 个)、芜湖杨燕制药有限公司(1个)、安徽天洋药业有限公司(1个)、马鞍山丰原制药有限公司(1 个)、安徽省百春制药有限公司(1 个)。其中,马鞍山丰原制药有限公司、安徽省百春制药有限公司所持品种为长期不生产品种,不在监督检查范围内。其余6家企业常年生产的品种为伊痛舒注射液、白花蛇舌草注射液(安徽凤阳科苑药业有限公司),华蟾素注射液(安徽华润金蟾药业股份有限公司),复方麝香注射液(安徽金太阳生化药业有限公司),丹参滴注液(上海华源安徽锦辉制药有限公司、安徽天洋药业有限公司),驱虫斑鸠菊注射液(芜湖杨燕制药有限公司)。
2 检查情况
2.1 总体情况
2021年对上述6 家中药注射剂生产企业进行监督检查,检查结果为符合要求或基本符合要求;均未发现关键处方工艺与注册申报不一致等严重问题;共发现缺陷70 项,包括主要缺陷4 项(5.71%)、一般缺陷66 项(94.29%),无严重缺陷,平均每家企业缺陷约12项。
缺陷主要集中于质量控制与质量保证、文件管理、附录无菌药品3 个章节,分别有14 项(20.00%)、12 项(17.14%)、10 项(14.29%),提示安徽省中药注射剂生产企业在实施GMP 及其相关附录规定时存在部分共性的问题。详见表1。
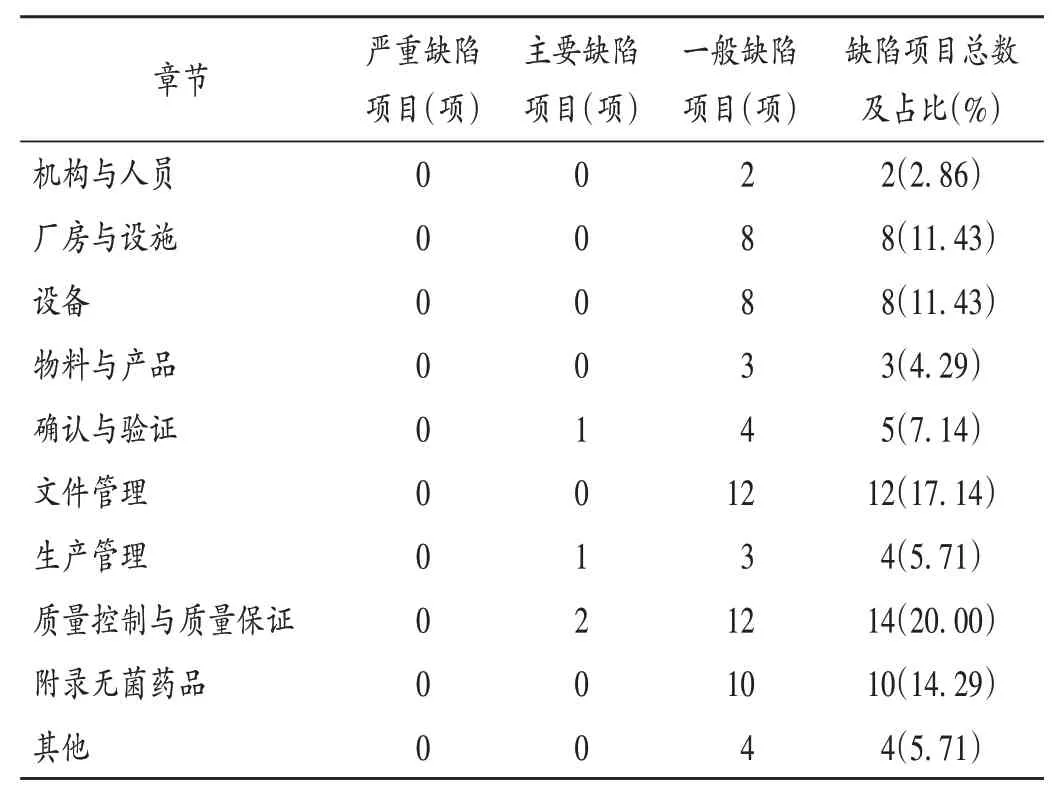
表1 缺陷项目分布Tab.1 Distribution of defective items
2.2 缺陷情况
质量控制与质量保证:质量控制与质量保证是保障药品质量的关键要素[3],缺陷主要体现在变更控制、偏差处理、取样、确认与验证4个方面。相关缺陷及举例见表2。

表2 质量控制与质量保证缺陷类型及举例Tab.2 Defective item types and examples of quality control and quality assurance
文件管理:文件管理章节的缺陷主要为未按要求进行文件管理,其次为文件规定或记录信息不全面或缺失。相关缺陷及举例见表3。

表3 文件管理缺陷类型及举例Tab.3 Defective item types and examples of quality management
附录无菌药品:中药注射剂同其他无菌药品一样,灭菌工艺、无菌操作、除菌过滤等生产步骤是保证产品无菌关键工艺的控制点。检查发现,中药注射剂生产企业在附录无菌药品执行方面存在无菌保证水平不足的情况。相关缺陷及举例见表4。

表4 附录无菌药品缺陷类型及举例Tab.4 Defective item types and examples of Annex 1:sterile medicinal products
2.3 ADR 监测制度执行情况
6家中药注射剂生产企业均设置了ADR监测部门,并指定专人负责相关工作,建立了药物警戒、ADR 监测方面的文件制度,对ADR 进行收集、分析、报告,定期通过国家药品不良反应监测系统提交药物警戒年度报告。
3 主要缺陷分析与改进建议
3.1 主要缺陷分析
根据《药品生产现场检查风险评定指导原则》,将缺陷分为严重缺陷、主要缺陷和一般缺陷,当与GMP 要求有较大偏离,且给产品质量带来较大风险时,可认定为主要缺陷[3]。
缺陷举例:2021年安徽省中药注射剂生产企业监督检查共发现以下4项主要缺陷。1)未对针剂车间最终灭菌生产线药液配滤系统中药、化学药品注射液共线生产情况分别制订清洁操作规程,清洁验证理化检测项目仅为总有机碳测试,未考虑化学药品残留对中药注射剂的交叉污染;2)企业规定滤芯应专用,实际检查发现企业为多品种共用;3)未对药液配制结束至灌装完成时限由12 h延长至17 h进行变更控制;4)未对中药精制液灭菌时间出现异常的偏差进行充分的质量评估。
缺陷原因分析:1)企业质量风险管理意识薄弱,仅认为最终产品检验合格即可,对生产过程中产品共线生产问题等部分环节的风险未采取防控措施;2)文件执行力度不足,不能严格按文件对滤芯进行管理;3)企业对变更控制和偏差处理不深入,不能及时评估风险并采取纠正预防措施。
企业纠正与预防措施:针对中药与化学药品共线清洁验证不充分的问题,企业进行共线生产风险评估,并选择目标化学残留物质重新开展清洁验证;针对滤芯未专用的问题,企业按品种采购过滤器,并开展除菌过滤工艺验证;针对变更控制和偏差处理不深入的问题,企业按规定进行评估控制,并采取纠正与预防措施。
3.2 改进建议
1)强化风险意识,切实做好确认与验证。确认与验证是确保企业按可靠的标准运行的基础。企业应不断强化风险意识,针对关键生产工艺、设备、清洁方法等进行充分的风险评估;同时结合中药注射剂的特点,确定确认或验证的范围和程度,科学制订验证方案和分析评价验证数据,切实做好确认与验证工作[4]。建议企业在设计工艺时,通过风险评估的方法识别关键工艺参数,以便在后续的工艺确认阶段针对性地摸索具体参数设置范围,并保证生产过程的持续稳定。对于最终灭菌中药注射剂,应重点关注水浴式灭菌柜的确认情况。涉及多品种共线产品的,清洁验证应综合考虑设备使用情况、所用清洁剂和消毒剂、取样方法和取样位置及相应的取样回收率、残留物的性质和限度、残留物检验方法的灵敏度等因素。中药提取用溶剂需回收使用的,应制订回收操作规程,并验证回收乙醇的使用次数,制订与其预定用途相适应的质量标准。
2)规范变更控制和偏差处理,保证质量体系稳定运行。变更控制和偏差处理是否得当、有效,是评价企业质量保证能力的重要评估指标,也是质量管理体系是否具有持续改进能力的重要评价因素[5]。发生变更时,应根据变更对药品安全性、有效性和质量可控性产生影响的风险进行评估,对变更进行分类分级控制,参考相关变更研究技术指导原则,开展必要的研究,如变更所需验证、额外的检验及稳定性考察[6]。对产品质量存在潜在影响的偏差,尤其是重大偏差,应由质量管理部门会同其他部门进行彻底调查,并撰写调查报告。对偏差处理不及时或不到位的缺陷进行原因分析,制订切实可行的纠正预防措施,并对该措施执行的效果进行跟踪确认。
3)提高文件管理水平,确保文件的适用性。文件管理是质量管理体系和风险管理体系的重要组成部分,对实际生产是否安全、规范起决定性作用[7]。首先,企业应精心设计、制订、审核和发放文件,确保与企业的实际情况相配套,不能生搬硬套GMP 条款,记录的设计及制订要按实际生产工艺规程和检验规程等进行。建议企业在起草文件时,组织有关部门共同参与,确保制订的文件既符合各部门内部工作需要,又符合整体要求,有助于各部门在严格履行各自职责的同时又能与相关部门的工作进行顺利承接。其次,质量管理人员要充分履行职责,保证GMP 的有效实施,严格进行质量把关,及时提出存在的问题,并给予解决方法[8]。
4)重视过程控制,保证产品无菌。企业应结合自身产品工艺特点,开展常规性的风险评估,从环境洁净度监测、灭菌工艺、无菌操作、过程取样等生产和质量管理方面进行风险识别,评估无菌保证措施的有效性和适用性,不断完善质量管理体系[9]。非最终灭菌产品涉及除菌过滤工序时,除菌过滤工艺验证和培养基模拟灌装试验是关键。目前,多数企业的除菌过滤工艺验证委托第三方检测机构或生产厂家进行,建议企业在充分把握过滤工艺验证要求的基础上,评估过滤工艺风险,确定需要验证的项目和程度,明确委托试验协议中的具体验证项目、验证方法、分析方法等,确保过滤工艺验证的完整性[10];同时,建议企业将除菌过滤器作为对产品质量有直接影响的主要物料纳入供应商管理,进行必要的审计,并签订质量协议。培养基模拟灌装试验应考虑无菌生产过程所涉及的工艺、设备、人员、操作时限等因素,尽可能模拟实际无菌生产全过程,特别是暴露操作、人工干预等高风险过程。
5)严控物料管理和生产管理。企业应依法履行供应商审核责任,严格按相关药品标准(必要时包括补充检验方法)及要求对作为原料的中药材和中药饮片进行检验。对明显低于市场采购价格的原药材,企业应重点关注,核查票据是否真实,且是否与物料、账册、资金流向相符。按药品标准规定的处方工艺投料生产,严禁使用不合格中药材和中药饮片,更不得使用掺杂掺假、染色增重、霉烂变质、被污染或提取过的中药材和中药饮片。外购中药提取物应按处方要求及规定备案或批准,不得违规替代中药饮片。生产过程的变更应经过研究、评估和验证,并符合变更管理相关规定,不得未经审批、备案擅自实施重大、中等变更。
6)加强ADR 监测。中药注射剂不良事件产生的原因主要是质量参差不齐及临床不合理应用。2021年,国家药品监督管理局发布了《药物警戒质量管理规范》,规范和指导药品上市许可持有人开展药物警戒活动。药品上市许可持有人应指定专门机构或人员负责中药注射剂的ADR 报告和监测工作,主动收集ADR,及时分析ADR和调查质量投诉,对于存在安全隐患的药品应主动召回,确保临床用药安全。中药注射剂生产企业应按《药品说明书和标签管理规定》的要求,结合原卫生部、原国家食品药品监督管理局、国家中医药管理局《关于进一步加强中药注射剂生产和临床使用管理的通知》,尽快完善药品说明书的用法、ADR、注意事项、配伍禁忌等内容,指导临床合理用药,降低临床使用风险[11]。
7)持续开展中药注射剂研究工作。中药注射剂由于其独特的性质,成分复杂,活性成分不明确,生产过程中不稳定因素多,且中药材质量受产地、种植、采收季节等的影响,故应最大限度地保留有效物质,清除有害物质,减少微生物的污染,确保产品达到无菌要求。2009年,原国家食品药品监督管理局发布了《关于做好中药注射剂安全性再评价工作的通知》,要求相关单位、部门和药品生产企业对此项工作全面贯彻落实。中药注射剂生产企业应对照《中药注射剂安全性再评价质量控制要点》《中药注射剂安全性再评价基本技术要求》,全面排查中药注射剂生产环节可能产生的风险,主动采取有效措施,切实控制中药注射剂的安全风险;同时,要求生产企业积极开展中药注射剂质量标准的研究,确保中药注射剂产品的质量。2017年,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,其中第二十五条提到:“对已上市药品注射剂进行再评价,力争用5 至10年左右时间基本完成。上市许可持有人须将批准上市时的研究情况、上市后持续研究情况等进行综合分析,开展产品成分、作用机制和临床疗效研究,评估其安全性、有效性和质量可控性。”在国家对中药注射剂管理日趋严格的形势下,与国家对化学药品的一致性评价要求类似,不能通过中药注射剂再评价的品种将被淘汰。故各企业应重视对中药注射剂的安全性再评价工作[1]。建议企业建立中药材生产基地,使药材生产加工规范化、标准化,逐步完善中药材质量评价体系;按中药注射剂再评价要求,积极研究原料、中间体和制剂的质量标准,提高企业内控标准,保证产品批间的一致性。对于多家企业生产的同一中药注射剂,鼓励生产企业、科研单位和行业协会联合研究,共同提高产品质量标准。
中药注射剂是中医药精髓的创新和传承[12],技术门槛高,质量要求严,具有其他剂型不可替代的突出优势。企业应高度重视中药注射剂的生产质量管理,严格执行GMP,重点关注提取环节的生产质量管理,保证生产投料与批准处方工艺的一致性。同时,开展相关质量研究,对变更、偏差进行充分评估,降低产品质量风险。目前,GMP 认证虽已取消,但监管标准和要求并未降低[13]。药品监督管理局作为监督管理部门,应积极推动企业落实履行主体责任,严格完成中药注射剂专项检查任务,发现企业缺陷并及时提出,督促企业整改,以防质量不合格药品流入市场,保证患者用药安全、可靠。

