口腔癌前病损转化微环境中IL-1β/Treg、Th17/Treg、Th1/Th2免疫失衡的机制研究
郭 琦 薛 鹏 尹恒山 李正阳
口腔癌属于头颈部恶性肿瘤,口腔癌发病率受生活习惯影响,不同地域间相差较大,我国口腔发病率相对较低,但由于饮食结构和喜好的改变,其发病率逐年攀升。口腔癌恶性程度较高,近年随着医疗技术的发展,口腔癌手术、化疗等治疗方式不断更迭、进化,但口腔癌患者的5年生存率仍难以达到50%[1]。部分口腔癌的发展可经由口腔白斑等癌前病损发展而来,故分析口腔癌前病损的发生与发展机制,早期诊断并治疗口腔恶性肿瘤,防止癌前病损持续发展为口腔癌对改善口腔癌患者预后意义重大[2]。既往研究显示,肿瘤所处环境中免疫因子、细胞等提供的免疫微环境为肿瘤生长、侵袭、转移的关键因素,免疫微环境的改变,各细胞因子间动态平衡的破坏与癌症的发生与发展密切相关[3]。T细胞亚群为人体重要的免疫细胞,其免疫应答作用不仅可抵御细菌入侵,控制炎症反应,还可参与人体抗肿瘤免疫。既往研究显示T细胞亚群细胞的下降及比例失衡可导致肿瘤的发生与发展[4],其中调节性T细胞(Treg)可介导自身免疫应答,而单核巨噬细胞对T细胞等淋巴细胞的免疫反应有诱导作用。白细胞介素-1β(IL-1β)为由单核巨噬细胞分泌的免疫调节因子,与辅助性T细胞(Th)的免疫功能密切相关[5]。IL-1β/Treg在正常情况下均处于动态平衡状态,可维持机体正常免疫微环境,而在IL-1β/Treg失衡的情况下或可影响Th1/Th2、Th17/Treg平衡。故通过对比上述指标在口腔癌发生与发展过程中三个阶段(正常-癌前病变-患癌)的差异,旨在研究Th1/Th2、Th17/Treg、IL-1β/Treg平衡在口腔癌前病损发生与诱发口腔癌过程中的作用,探寻免疫微环境对口腔癌发生的影响,为临床口腔癌的诊治提供参考依据,现将结果报告如下。
1 材料与方法
1.1 一般资料
回顾分析2021年1月至2022年6月我院收治的60例口腔癌前病损患者的临床资料,并纳入口腔癌前病损组,纳排标准:①符合口腔癌前病损诊断标准[6];②临床资料完整;③患者对研究知情同意;④患者在院期间完善研究内容所需相关检查;⑤排除合并其余系统癌症。选取我院同期口腔癌患者43例,纳入口腔癌组,纳排标准:①经病理学等诊断为口腔癌[7];②临床资料完整;③排除研究期间接受化疗、免疫抑制剂治疗等可能对人体免疫功能造成损伤者;④患者对此次研究内容知情同意。选取我院同期健康体检者35例,纳入健康对照组,纳排标准:①排除既往有免疫系统相关疾病史;②临床资料完整;③年龄>18岁;④对此次研究知情同意。口腔癌前病损组患者年龄为39~67岁,平均为(53.67±12.85)岁;男性33例,女性27例;癌前病变类型为口腔白斑32例,口腔红斑21例,口腔扁平苔藓7例。口腔癌组患者年龄为40~68岁,平均为(54.93±13.07)岁;男性24例,女性19例;病理类型为口腔鳞癌38例,其它5例;病理分期为:Ⅰ期4例,Ⅱ期17例,Ⅲ期13例,Ⅳ期9例。健康对照组年龄为38~65岁,平均为(52.88±10.45)岁;男性19例,女性16例。3组年龄、性别对比并无显著差异(P>0.05)。
1.2 检测方法
(1)IL-1β/Treg:于被检者入院后采集其外周静脉血液,以2500 r/min的转速经离心处理后即可得到上层清液,取上层清液采用酶联免疫吸附法检测IL-1β水平。(2)采用流式细胞仪(生产厂商:基恩士;型号:BZ-X)检测患者Treg水平,具体操作:①制备单个核细胞层(PBMCs);②制备PBMC悬液并置于恒温箱中培养;③取出PBMC进行胞外染色,固定、加入破膜剂后重复进行离心、丢弃上层清液操作,于流式细胞仪上进行分析,得到Treg水平,并计算IL-1β/Treg。(3)辅助性T细胞7(Th17)/Treg、Th1/Th2水平检测均采用流式细胞仪,制备过程同②。
1.3 观察指标
对比口腔癌前病损组、口腔癌组、健康对照组IL-1β/Treg、Th17/Treg、Th1/Th2水平,使用Logistic分析模型分析IL-1β/Treg、Th17/Treg、Th1/Th2表达水平与口腔癌前病损发生、口腔癌前病损转化为口腔癌的相关性。采用Pearson分析模型分析口腔癌前病损组IL-1β/Treg与Th17/Treg、Th1/Th2表达水平的相关性。
1.4 统计学方法

2 结果
2.1 3组IL-1β/Treg、Th17/Treg、Th1/Th2水平对比
3组受试者IL-1β/Treg、Th17/Treg、Th1/Th2水平比较差异显著(P<0.05),其中口腔癌组IL-1β/Treg、Th17/Treg水平明显高于口腔癌前病损组(P<0.05),Th1/Th2明显低于口腔癌前病损组(P<0.05);健康对照组IL-1β/Treg、Th17/Treg水平明显低于癌前病损组(P<0.05),Th1/Th2明显高于口腔癌前病损组(P<0.05),见表1。
2.2 各指标水平与口腔癌前病损发生的相关性分析
经Logistic分析可得IL-1β/Treg、Th17/Treg水平与口腔癌前病损的发生呈正相关(P<0.05),Th1/Th2与口腔癌前病损的发展呈负相关(P<0.05),见表2。
2.3 各指标水平与口腔癌前病损进展为口腔癌的相关性
经Pearson分析可得,IL-1β/Treg、Th17/Treg水平与口腔癌前病损癌化呈正相关(P<0.05),Th1/Th2与口腔癌前病损癌化呈负相关(P<0.05),见表3。

表1 3组IL-1β/Treg、Th17/Treg、Th1/Th2水平比较

表2 各指标表达情况与口腔癌前病损发生的相关性

表3 各指标水平与口腔癌前病损恶化为口腔癌的相关性分析
2.4 口腔癌前病损组IL-1β/Treg水平、Th17/Treg、Th1/Th2水平的相关性
经Pearson分析可得,IL-1β/Treg水平与Th17/Treg水平呈正相关(P<0.05),IL-1β/Treg、Th17/Treg与Th1/Th2水平呈负相关(P<0.05),见表4。
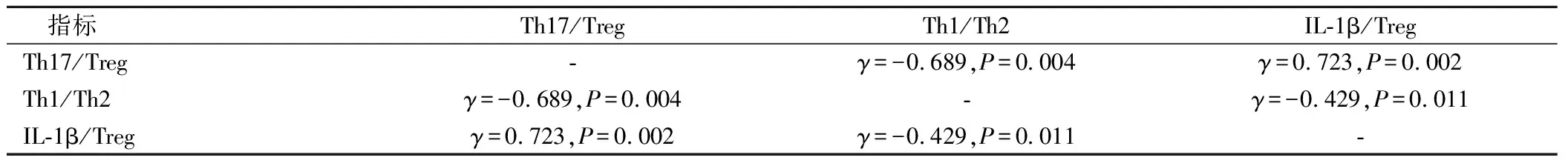
表4 Th17/Treg、Th1/Th2水平与IL-1β/Treg水平相关性分析
3 讨论
免疫因子表达异常可破坏免疫系统各细胞因子动态平衡,导致免疫微环境失衡、紊乱,与肿瘤细胞的增殖与表达密切相关[8]。
IL-1为一类由巨噬细胞分泌的细胞因子,包含IL-1α和IL-1β两种类型,其中IL-1β可参与多个系统如内分泌系统、神经系统的免疫调控。Th17细胞Treg均为参与自身抗肿瘤免疫的重要介质。本研究结果显示,癌前病变组相较于口腔癌组,其IL-1β/Treg、Th17/Treg水平更低且差异显著,而相较于健康对照组,上述指标水平则更高且差异显著,IL-1β/Treg、Th17/Treg与口腔癌前病损的发生与恶化及两指标水平均有明显相关性,这表明IL-1β/Treg、Th17/Treg可促进口腔恶性肿瘤的发展,与既往研究结果类似[9-10]。分析其原因为当肿瘤细胞侵袭正常口腔组织时,IL-1β可释放并启动炎性小体的表达,而此类炎性小体的表达可提高口腔鳞癌细胞的自我更新能力,可提高口腔癌细胞干性,而癌细胞的干性能力提高有利于肿瘤细胞的增殖与分化,干性通路的表达与活化可促使肿瘤细胞侵袭周边组织,故口腔癌患者IL-1β表达水平更高[11]。而Th17分泌的主要介质-IL-17,为恶性肿瘤细胞血管生成的重要促进物质,IL-17的表达水平上升可提示肿瘤增殖,且IL-17的分泌还可促进肿瘤细胞转录途径相关因子的活化,可延长肿瘤细胞的生存周期,减少肿瘤细胞凋亡,故口腔癌患者IL-17及Th17表达水平更高[12-13]。多研究证实Treg在恶性肿瘤的生长中可发挥促进免疫逃逸作用,肿瘤细胞侵袭正常组织时Treg水平上升以进行免疫调控,但Treg过度表达可起到免疫抑制的作用,可抑制抗肿瘤相关免疫因子的表达,故口腔癌患者Treg水平更高[14]。随着正常组织逐渐恶变,免疫平衡状态被破坏,IL-1β、Treg、Th17水平均升高,免疫微环境失衡可促进肿瘤逃逸,而在口腔癌中IL-1β、Th17表达更强势,故IL-1β/Treg、Th17/Treg比例上升。
Th1和Th2分别介导细胞免疫和体液免疫,其动态平衡为免疫功能发挥正常作用的关键因素。本研究结果显示,口腔癌前病损组相较于健康对照组,Th1/Th2更低,而与口腔癌组相比较则更高,Th1/Th2与口腔正常组织的恶变及IL-1β/Treg水平呈负相关,这表明当Th1/Th2平衡向Th2偏移时,口腔癌发生风险较大,与既往研究结果类似[15]。分析其原因为,Th1和Th2细胞均由Th0细胞分化而来,而当机体癌变时Th1细胞降低,Th2细胞表达水平升高,Th2型免疫反应占主导地位,而Th1的水平降低可促进免疫逃逸作用,且机体患癌时,Treg过度表达可导致免疫抑制,既往研究显示Treg过度表达与Th1/Th2失衡密切相关[16]。故口腔癌患者的Th1/Th2更低。
综上所述,IL-1β/Treg表达异常可导致口腔免疫微环境失衡、Th17/Treg水平上升,Th1/Th2水平降低,可促进口腔恶性疾病的进展。

