结直肠癌早期定期筛查研究进展
苏全琳,杨 萍,师 声,张 静,兰文军
齐鲁工业大学(山东省科学院) 生物医学工程研究所,山东 济南 250353
结直肠癌(colorectal cancer,CRC)作为消化系统恶性肿瘤发病率位列第二[1]。近二十年间,发达国家中结直肠癌的发生率已显著减少,但在中国呈上升趋势[2]。CRC在早期是无症状或症状不明显的,伴有间歇性肠胃不适、消化不良、大便潜血等症状,易被患者忽略,导致癌症继续发生发展、扩散转移[3]。CRC患者进展为较明显的癌前病变或发展成为癌需要5到10年甚至更长的时间[4],因此根据身体状况在这期间进行早期定期筛查尤为重要。本文对CRC早期定期筛查相关研究进展进行概述。
1 血液标志物
1.1 蛋白质标志物
CRC肿瘤标志物(tumor marker,TM)是由肿瘤细胞分泌对其生长发育有利或患者身体受肿瘤细胞胁迫所产生的一类物质,可用于衡量肿瘤细胞所处的生长分期。临床常见的TM主要有CA199、CA50、CA724、癌胚抗原(carcinoembryonic antigen,CEA)等。ATTALLAH 等[5]采用酶联免疫吸附试验(ELISA)测定患者血清CEA、碳水化合物抗原19-9(CA19-9)、CK1和MUC1,用曲线下面积法(area under the curve,AUC)评估对肿瘤的诊断价值,结果显示血清四项指标均升高,且CRC>良性疾病>健康对照组,能够反应肿瘤的分期、淋巴结浸润和远处器官转移的情况。DOU等[6]开发了用于血液II型半胱氨酸蛋白酶抑制剂(CST4)检测的抗体夹心酶联免疫吸附试验 (ELISA) 分析系统,采用实时荧光定量PCR和Western blotting蛋白质印记法分析了CST4在胃肠道肿瘤组织和细胞系中的表达情况,并纯化CST4重组蛋白,制备了抗CST4单克隆抗体,建立抗体夹心的ELISA分析系统检测CST4,发现在CRC患者中CST4-mRNA及其表达蛋白在胃肠道肿瘤组织和细胞系中的含量明显上调,ELISA检测CST4、胃癌(GC)和CRC的灵敏度和特异性明显优于临床常用的标志物CEA、CA19-9、CA72-4和CA125,表明了血液标志物CST4在早期筛查结直肠癌的临床诊断应用价值。NING等[7]使用电化学发光法检测癌抗原CA19-9、CEA、胸腺嘧啶激酶1(TK1)和糖类抗原72-4(CA72-4)的水平,评估联合检测对CRC的意义,发现TK1水平与肿瘤分化程度、远处转移、淋巴结转移、肿瘤分期及年龄显著相关。利用二维电泳,串联质谱及印记法对结直肠癌和晚期腺瘤性息肉的蛋白组学分析显示[8]:HPR、HP、ALB、KRT 1、APOA 1、FGB、IGJ、C4a等蛋白在息肉组织中的表达明显低于正常人;血浆中FGB和C4A蛋白与结直肠癌的发展呈明显相关性,提示其可作为早期诊断结直肠癌的血浆潜在生物标志物。
综上所述,血液抗原标志物可应用于肿瘤分期、术后检测和预后判断等方面,但由于早期分泌水平较低,还应进一步提升检测的灵敏度和特异性,以增加早期筛查的准确性。
1.2 核酸标志物
血液标本核酸检测主要以循环肿瘤DNA(ctDNA)、循环肿瘤细胞(CTC)和循环游离DNA(cfDNA)中BRAF(表1)、KRAS(表2)、NRAS等特定基因的突变和部分基因的甲基化(表3)、微小RNA及微卫星改变作为检测目标[9]。

表1 BRAF基因常见致癌突变类型
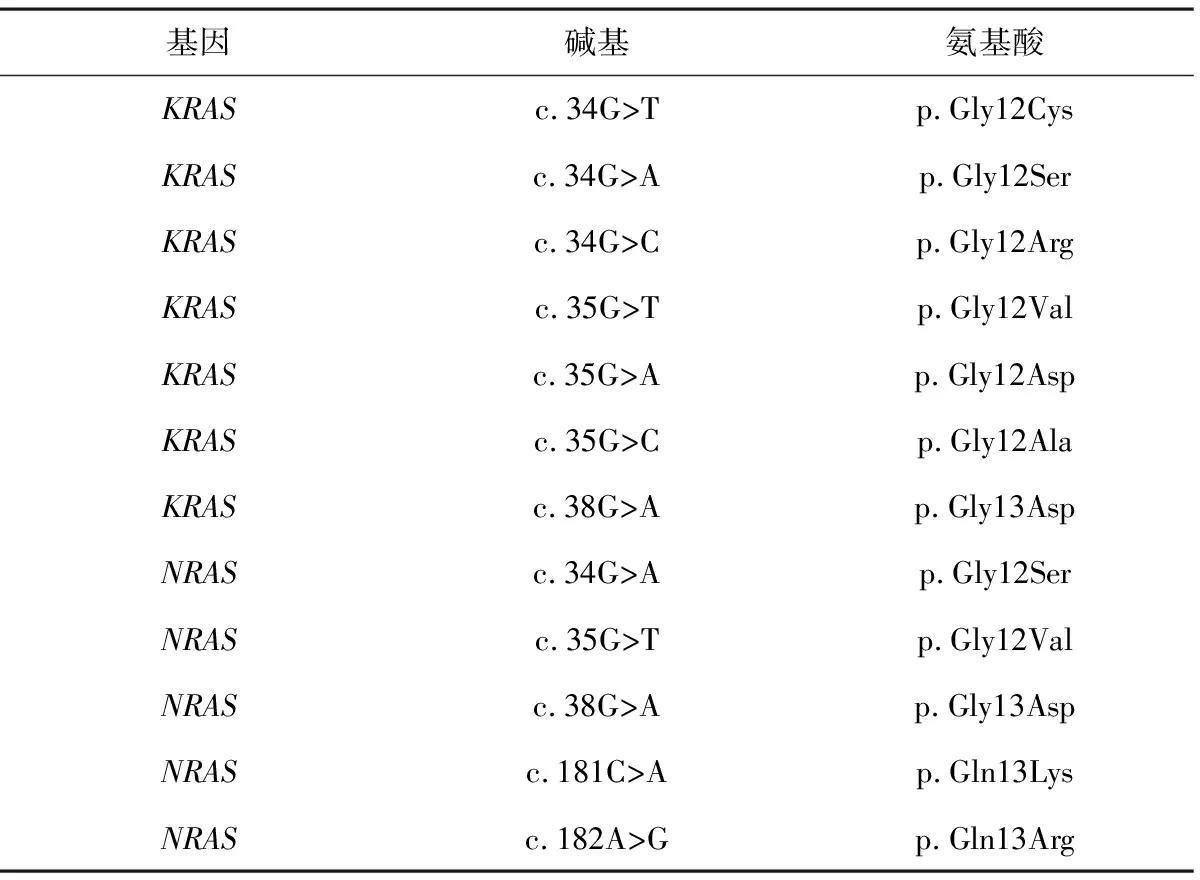
表2 RAS基因常见突变

表3 常见的甲基化位点
利用ddPCR技术对ctDNA中的RAS和BRAF的单核苷酸多态性(SNP)进行检测,JUNCA等[10]报道,RAS和BRAF的SNP对晚期突变型CRC的敏感性高,但对进展期腺瘤(AA)不敏感。XU等[11]采用real-time PCR技术,对CRC ctDNA样本中的Septin9、Syndecan-2(SDC2)和branched-chain amino acid transaminase 1(BCAT1)基因的甲基化进行检测,发现结直肠息肉患者与正常对照组ctDNA甲基化水平差异显著,预示对CRC的早筛诊断有较好的诊断价值。WANG等[12]利用基因组学分析和焦磷酸测序,进行了全基因组DNA甲基化分析,建立了一个基于CpG甲基化的CRC筛查模型,结果显示:基于cg09239744和cg12587766两个CpG位点的诊断模型对CRC和结直肠腺瘤患者的鉴别有意义,可用于结直肠癌和结直肠腺癌的早期定期筛查。ZHAO等[13]报道了以循环外泌体miRNA为结直肠癌生物标志物的研究,从165例CRC患者和153例健康人群血清中分离外泌体miR-99b-5p和miR-150-5p,用透射电镜、免疫印迹、新型外泌体粒径分析仪和RT-PCR进行验证,并对循环外泌体进行基因测序,结果显示:与健康人群和良性疾病人群相比,CRC患者的外泌体miRNA水平显著下调,结直肠癌术后又显著升高,因此血清循环外泌体miR-99b-5p和miR-150-5p可能可以用于结直肠癌的早期筛查。CAI等[14]筛选了六种在血浆和组织中具备更好待检测能力的标志物,建立了对CRC和进展期腺瘤的血液多基因位点甲基化检测方法,结果表明:相比于FIT、癌胚抗原和Septin 9单位点基因甲基化检测,这六种基因甲基化标志物联检具有显著的优势。
与单一标志物检测相比,多个CRC标志物联检的特异性和灵敏度更好,结果也更加精准。采用real-time PCR、ddPCR、基因测序等技术对血液标本中的基因突变、甲基化进行联检,具有灵敏度高、特异性好的优点,是未来CRC早期筛查的发展趋势。
2 粪便标志物
2.1 潜血相关标志物
粪便潜血现象是由于肿瘤破裂、直肠息肉破裂、消化道出血、消化道溃疡、痢疾和痤疮等原因导致粪便中含少量血液[15]。在结直肠癌早期,约有20%的患者可能出现便潜血检测阳性的现象,而CRC晚期病人的便潜血阳性概率可达到90%以上[16],所以粪便潜血检测是早期筛查结直肠癌的有效手段。目前,已被临床认可的粪便潜血检测方法主要有:化学法、免疫法、胶体金免疫层析及质谱等。
化学法是通过亚铁血红素来检测粪便潜血现象,其中愈创木酯法(gFOBT)应用最广[17]。据报道,gFOBT对结直肠癌的检测灵敏度和特异性可达79.4%和97.7%[18],但化学法检测受限条件较多,易导致结果假阴性或假阳性,目前已逐渐被粪便潜血免疫分析(faecal immunochemical test,FIT)所取代[19]。FIT是通过单克隆或多克隆抗体识别粪便中人血红蛋白抗原等血液成分,以此监测患者创口轻微出血的状况,且不受饮食、药物的干扰[16]。GUO等[20]研究表明,gFOBT检测出晚期肿瘤的频率低于FIT。对于晚期肿瘤,gFOBT的阳性检测值低于FIT,与gFOBT阴性组相比,FIT阴性组患间期癌的可能性降低77%。WIETEN等[21]研究表明,gFOBT阴性组比FIT阴性组的间期结直肠癌(iCRC)发生率更高,FIT阴性组和gFOBT阴性组分别每100 000人每年约有20和34个CRC漏检患者出现,因此FIT比gFOBT的检测价值更高。
免疫法粪便潜血检测,主要包括以免疫层析技术为基础的胶体金试纸法的定性FIT和免疫比浊法定量FIT。李佩等[22]对定性FIT和定量FIT检测性能进行了评估。其中,定性免疫法粪便潜血检测组阳性率比理论阳性率高,灵敏度可达100.00%;定量免疫法粪便潜血检测组阳性率与理论阳性率的差异无统计学意义,其血红蛋白水平与理论浓度高度相关,灵敏度为86.21%。这表明,定性FIT灵敏度高,但特异性低于定量FIT;定性FIT由于其操作简便、成本便宜更加适合广泛使用,而定量FIT可对病情做出更精准的判断。HÖGBERG等[23]研究发现:①使用定性FIT检测直肠出血的606例患者,其灵敏度为96.2%,特异性为60.2%,阳性预测值为9.8%,阴性预测值为99.7%;②1421例无直肠出血患者的相应数字分别为100%、73.6%、8.3%和100%,但FIT对高危腺瘤(HRA)的检出率不高,只有42%。FIT联合粪便钙卫蛋白(fecal calprotectin,FC)和转铁蛋白(transferrin,TF)等标志物的检测,有助于提高检测灵敏度和特异性[24]。LIANG等[25]研究发现,从粪便嗜铬梭菌中分离出来的基因标志物Lachnoclostridium(m3)比FIT的效能更高,联合FIT和m3对晚期腺瘤的灵敏度可提升至56.8%,提示m3对基于粪便的腺瘤检测有良好的效果。
综上所述,结直肠癌患者FIT法比gFOBT法早期筛查效果更佳,拥有更好的进展期腺瘤检出敏感度,是CRC大规模筛查的最佳选择。
2.2 核酸标志物
CRC肿瘤细胞生长发育迅速,细胞分裂快且粘附性差,导致肿瘤细胞不断地脱落到肠腔中。与此类似,粪便核酸检测主要是测定肠道脱落细胞中的KRAS、NRAS、BRAF等特定基因位点的突变和BMP3、NDRG4、p33ING1b等基因甲基化的表观遗传生物标志物的异常变化[26],从而判断CRC的发生发展状况[17],指导患者个性化治疗。
核酸在粪便和血液中的存在是微量的,因此需要利用实时荧光定量PCR、数字PCR和基因测序等高灵敏度高特异性的技术进行检测[27]。未知的突变致癌基因位点核酸序列的检测一般采用全基因组甲基化测序、全基因组测序、外显子测序以及RNA末端平行分析法等。对已知突变致癌基因位点的检测一般采用数字PCR技术、磁珠乳液扩增技术[28]、扩增阻滞突变系统聚合酶链反应、基于深度测序的肿瘤个体化指纹图谱、双向焦磷酸解激活的聚合反应、标记扩增深度测序和基质辅助激光解吸电离飞行时间质朴等[29]。
粪便核酸检测在CRC无创筛查中应用前景广阔。LIU等[30]研究显示,SFRP2、SFRP1、TFPI2、BMP3、NDRG4、SPG20和BMP3+NDRG4基因甲基化水平对CRC检测的敏感性为70%,特异性为80%,鉴别性与区分度良好,这些发现验证了DNA甲基化作为粪便中微创生物标志物诊断CRC和腺瘤的可行性。CARETHERS等[31]研究发现,多靶点粪便DNA(mt-sDNA)检测CRC的灵敏度为92%,且mt-sDNA检测对晚期腺瘤和无柄锯齿状息肉的检出率均比FIT检出率要高,同时总体特异性略低。通过对KRAS突变、NDRG4/BMP3启动子甲基化和血红蛋白的检测,CRC早期筛查研究也显示:mt-sDNA和FIT检测的特异性分别为89%和93%,mt-sDNA的灵敏性较优[31-32]。据报道[33],FIT-DNA联检对CRC、癌前病变和高危腺瘤的灵敏度和阳性率均高于定性胶体金法和定量免疫法,对正常健康肠道和其他性质的疾病假阳性比率也小于定性胶体金法和定量免疫法,这提示:多靶点粪便FIT-DNA联检是早期筛查CRC经济有效的方法,对提高肠镜检查的依从性和检出率有帮助。无创诊断FIT-DNA联检CRC最为准确,但对高危腺瘤(HRA)的检出率仅有42%,有极大的隐患。BARNELL等[34]研究发现,粪便真核RNA序列(stool-derived eukaryotic RNA,seRNA)是检测高危腺瘤的绝佳标志物,采用二代测序联合靶向扩增的方法,检测HRA的灵敏度为45%,特异性为87%,相较于FIT-DNA联检法具有明显的优势。
综上所述,粪便核酸标志物的检测灵敏度较高,但因存在的干扰因素较多,核酸含量较低,特异性较免疫法粪便潜血检测略低。
3 讨论与展望
结肠镜检是结直肠癌筛查的金标准,但不宜进行常规定期早筛检查。虽然基于核酸扩增和胶体金免疫层析的FIT-DNA联检在CRC早期筛查中展现出优异的灵敏度和特异性(≥90%),但多靶点表观遗传学液体活检以其取材洁净、良好的特异性和灵敏度而逐渐得到认可,后者可能成为未来CRC早期定期筛的首选方法,而DNA-RNA联检是CRC早期筛查及腺瘤鉴别的发展趋势。

