心房颤动病人射频消融术后晚期复发的危险因素及其预测价值
刘晓晨,刘恩香,李晶晶
心房颤动(atrial fibrillation,AF)是临床常见的持续性心律失常,与心脑血管并发症和死亡率增加密切相关[1]。心房颤动导管射频消融(radio frequency catheter ablation,RFCA)已成为有症状性心房颤动病人的主要治疗方案,其中肺静脉隔离(pulmonary vein isolation,PVI)是RFCA的主要策略,可以快速缓解病情[2]。但是并非所有心房颤动均起源于肺静脉周围,且肺静脉重构等并发症使得这一策略的持久性较差,阵发性心房颤动病人RFCA术后心房颤动的复发率为14%~35%,而持续性心房颤动病人RFCA术后心房颤动的复发率高达70%[3-4]。因此,探索心房颤动复发的预测因素尤为重要。本研究通过心电图变化、心脏三维超声以及经食管超声心动图(transesophageal echocardiography,TEE)评估RFCA术后晚期复发的危险因素。
1 资料与方法
1.1 研究对象 选取2018年5月—2020年5月于沧州市人民医院医院心血管内科住院并接受射频消融术治疗的心房颤动病人95例,随访1年。晚期复发是指术后空白期(射频消融术后3个月)后1年内,监测记录到的心房颤动或持续超过30 s的快速房性心律失常[5],本研究中心房颤动晚期复发率为32.63%(31/95),其中,心房颤动12例,心房扑动8例,房性心动过速4例,房性期前收缩7例。根据是否发生晚期复发分为复发组(31例)和无复发组(64例)。本研究通过医院医学伦理委员会审核,病人及家属均知情同意书并签署知情同意书。
1.2 纳入与排除标准 纳入标准:年龄>18岁;诊断为阵发性或持续性心房颤动,正在使用至少一种抗心律失常药物进行治疗[5];具有心房颤动射频消融术的临床适应证;符合2019美国心脏协会(AHA)/美国心脏病学会(ACC)/美国心律学会(HRS)心房颤动管理指南标准[5],首次进行RFCA;能配合完成TEE检查。排除标准:其他原因导致的可逆性心房颤动,如甲状腺功能亢进;既往行心房颤动消融术或起搏器植入术;瓣膜置换术或瓣膜修复后出现的心房颤动;伴随严重的心脏瓣膜疾病、心房血栓形成、病态窦房结综合征、纽约心脏病协会(NYHA)心功能分级Ⅳ级;伴随全身感染性疾病、食管静脉曲张、出血性疾病活动期。
1.3 方法 收集所有病人性别、年龄、合并证、心房颤动类型、心房颤动持续时间、伴随的结构性心脏病等一般资料;肺静脉消融点、总消融时间、手术总时间(即股静脉穿刺开始至手术结束拔出鞘管时间)等RFCA相关参数;心电图、心脏三维超声、TEE的相关指标。
1.3.1 心电图检查 使用体表心电图机(EDAN SE-1201,中国)分别在病人术前1 d和术后1 d进行检测,在病人静息状态下记录8~10个心动周期,走纸速度设为50 mm/s,增益为1 mV/mm。记录Ⅱ导联上的P波时限(P wave duration,PWD)、P波离散度(P wave dispersion,Pd)。其中PWD是指P波在开始位置与距等电位参考线的偏移之间的时间差。等电位参考线由T波末端和QRS波之间的间隔位置确定[6]。在V1导联上选取10个独立的从f波波峰至波谷的垂直距离最大的f波,利用电子标尺手动测量f波振幅,取平均值[7]。
1.3.2 心脏三维超声检查 使用心脏多普勒超声诊断仪(PHILIPS EPIQ 7C,美国),在胸骨旁左心室长轴切面采用Simpson法测量左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左心室收缩末期内径(left ventricular end systolic diameter,LVESD)、左室射血分数(left ventricular ejection fraction,LVEF);在心尖四腔心切面测量左心房直径、二尖瓣口舒张早期峰值血流速度(E)及舒张晚期峰值血流速度(A)、舒张早期二尖瓣瓣环峰值速度e′,计算E/A、E/e′;采集并存储心尖位左心长轴、心尖位四腔、心尖位两腔(帧频>50帧/s)连续3个完整的心动周期图像;应用双平面面积-长度法测量左房容积,用体表面积标准化获得相应左房容积指数(left atrial volume index,LAVI)。心脏三维超声图像示例见图1。
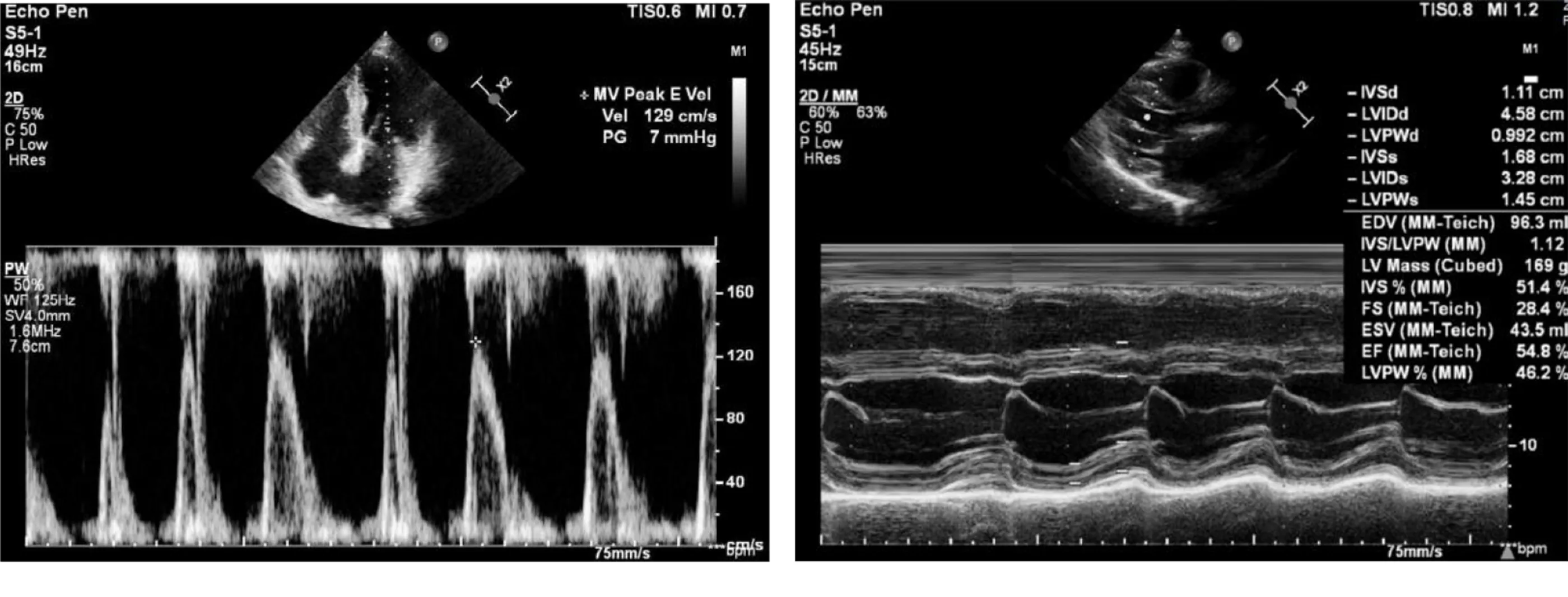
图1 心脏三维超声图像
1.3.3 TEE 使用彩色多普勒超声诊断仪(PHILIPS EPIQ 7C,美国),病人禁食、禁水8 h后,使用盐酸达克罗宁胶浆行口咽部局部麻醉3 min,病人取左侧卧位,将食管探头经咬合器置入距门齿大约35 cm处,0°~180°内连续扫查,连续记录5个心动周期,使用Qlab 10.5软件测量左心耳相关参数。包括:左心耳峰值排空流速(peak emptied velocity of left atrial appendage,LAAeV)、左心耳峰值填充流速(peak filling flow velocity of left atrial appendage,LAAfV)、左心耳射血分数(left atrial appendage ejection fraction,LAAEF)[8]。经食管超声心动图测量左心耳血流速度示例图见图2。
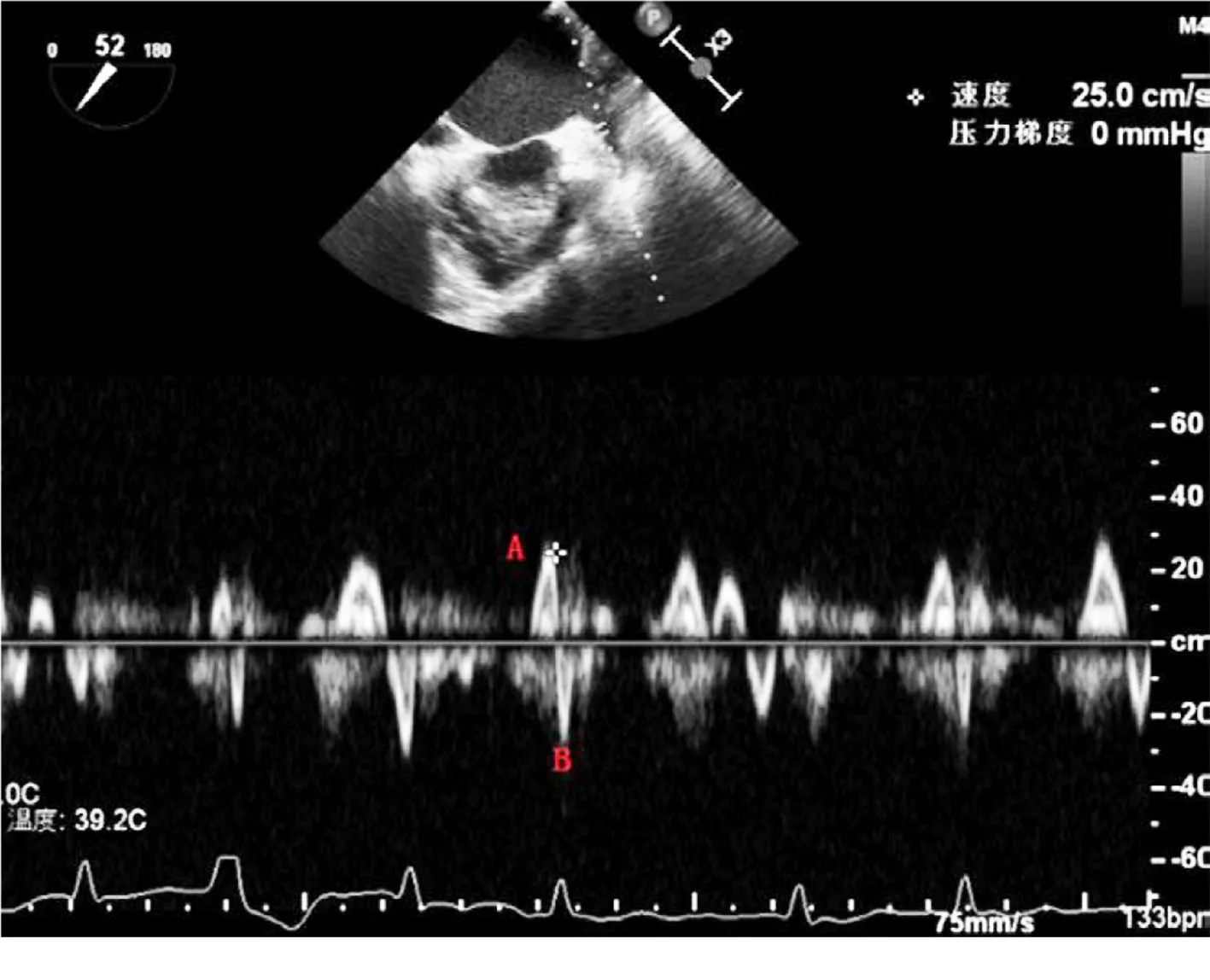
图2 经食管超声心动图测量左心耳血流速度(A峰为左心耳峰值排空流速;B峰为左心耳峰值填充流速)
1.4 治疗方案 所有具有射频消融术适应证的心房颤动病人,均通过右股静脉将冠状窦电极送入冠状窦,在CARTO系统标测下重建心房三维解剖图像,采用双侧环肺静脉隔离术的策略,根据术中情况和术者经验添加额外线性消融线。在43 ℃,35 W放电2 400 s,持续心电监测至恢复窦性心律,肺静脉内与左房电信号传导双向阻滞。术后常规给予肝素6 000 U,伊布利特1 mg静脉注射,口服抗凝药物治疗。术后病人在心前区常规给予穿戴式动态心电记录仪(浙江曲道,TE-5100Y-C型),利用手机蓝牙远端实时监测心律变化情况,每隔24 h心电结果自动上传到国家远程心电平台由心内科专家作出诊断。

2 结 果
2.1 两组一般资料比较 两组一般资料比较,差异均无统计学意义(P>0.05)。详见表1。
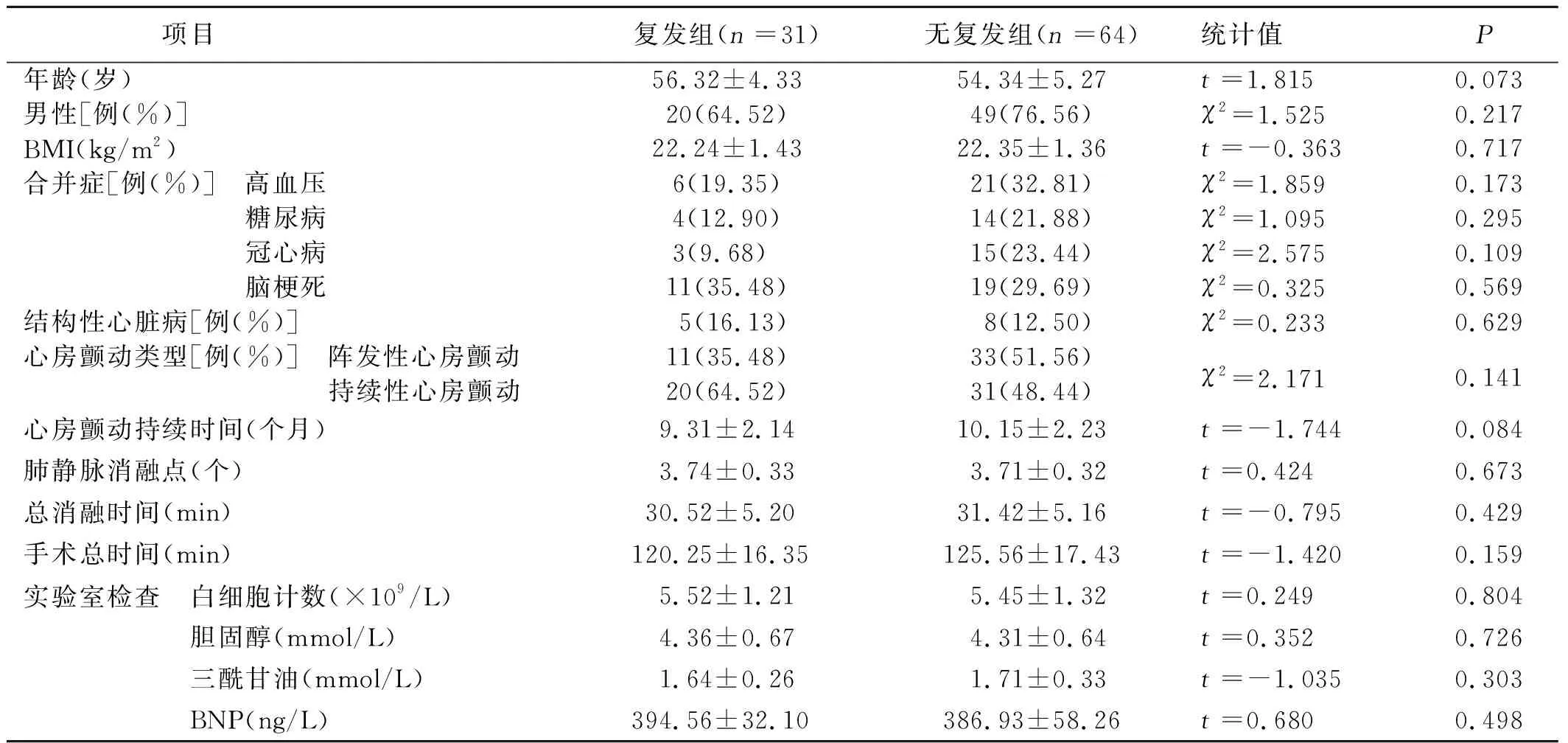
表1 两组一般资料比较
2.2 RFCA术后晚期复发的单因素及多因素分析结果 单因素分析结果显示,复发组左心房直径、LAVI、左心耳最大容积、左心耳最小容积均明显大于无复发组,而LAAEF、LAAeV、LAAfV明显低于无复发组,差异均有统计学意义(P<0.05)。详见表2。多因素分析结果显示,LAVI[OR=1.941,95%CI(1.162,3.243),P=0.011]、LAAEF[OR=0.915,95%CI(0.831,0.999),P<0.001]、LAAeV[OR=0.938,95%CI(0.877,0.998),P<0.001]是心房颤动病人RFCA术后晚期复发的影响因素。其中LAVI是预测心房颤动病人RFCA术后晚期复发的危险因素,而LAAEF、LAAeV是心房颤动病人RFCA术后晚期复发的保护因素。详见表3。
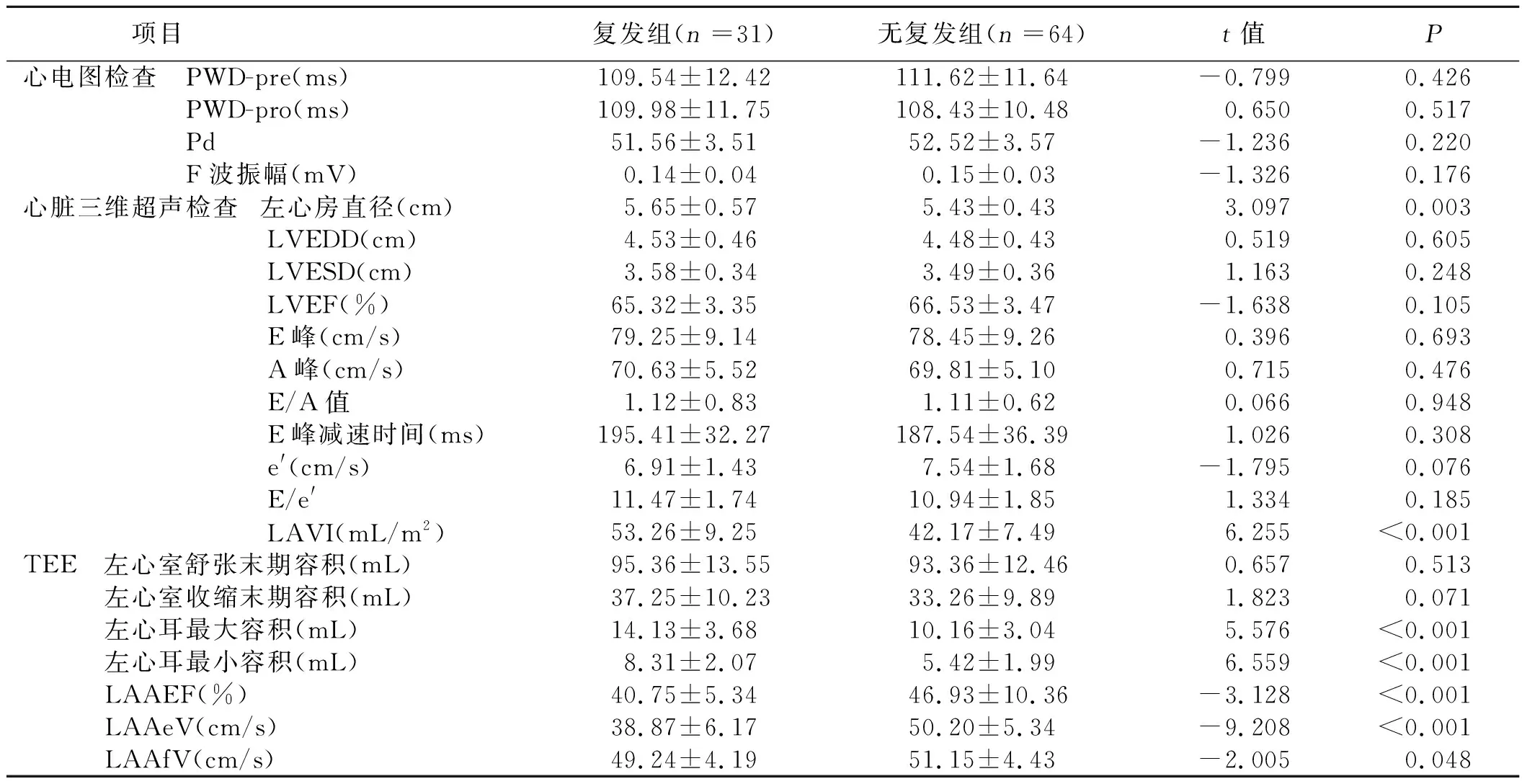
表2 两组病人辅助检查相关参数比较
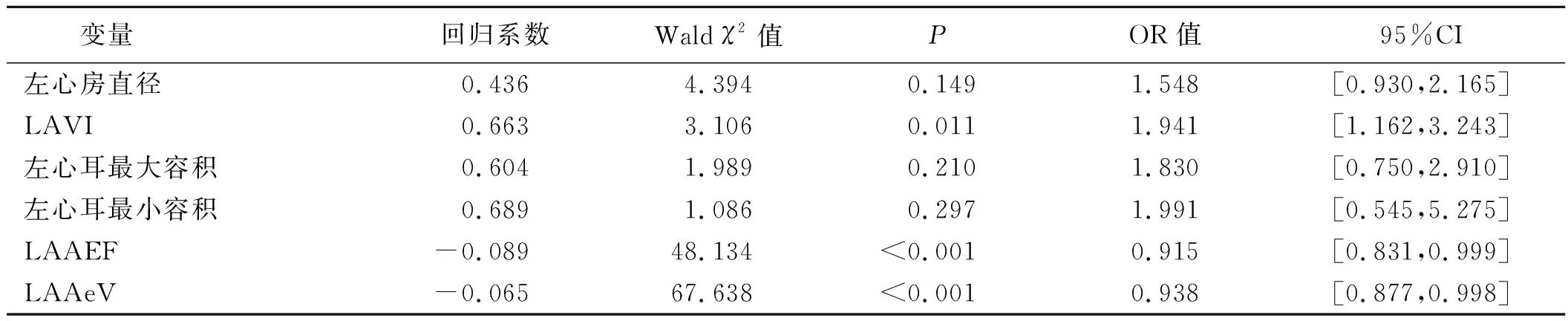
表3 心房颤动病人RFCA术后晚期复发的多因素Logistic回归分析
2.3 LAVI、LAAeV和LAAEF对心房颤动RFCA术后晚期复发的预测价值 LAVI、LAAeV和LAAEF的曲线下面积(AUC)分别为0.818、0.902和0.684。LAVI、LAAeV和LAAEF的最佳截断值分别为45.50 mL/m2、40.49 cm/s和42.47%,预测晚期复发的敏感度最高分别为0.710,0.806,0.645,特异度分别为0.687、0.734、0.641。其中,LAAeV的AUC和特异度最高,LAVI,LAAeV和LAAEF联合检测具有较高的AUC,为0.947,可以达到更高的敏感度和特异度,分别为0.805和0.858。详见图3、表4。
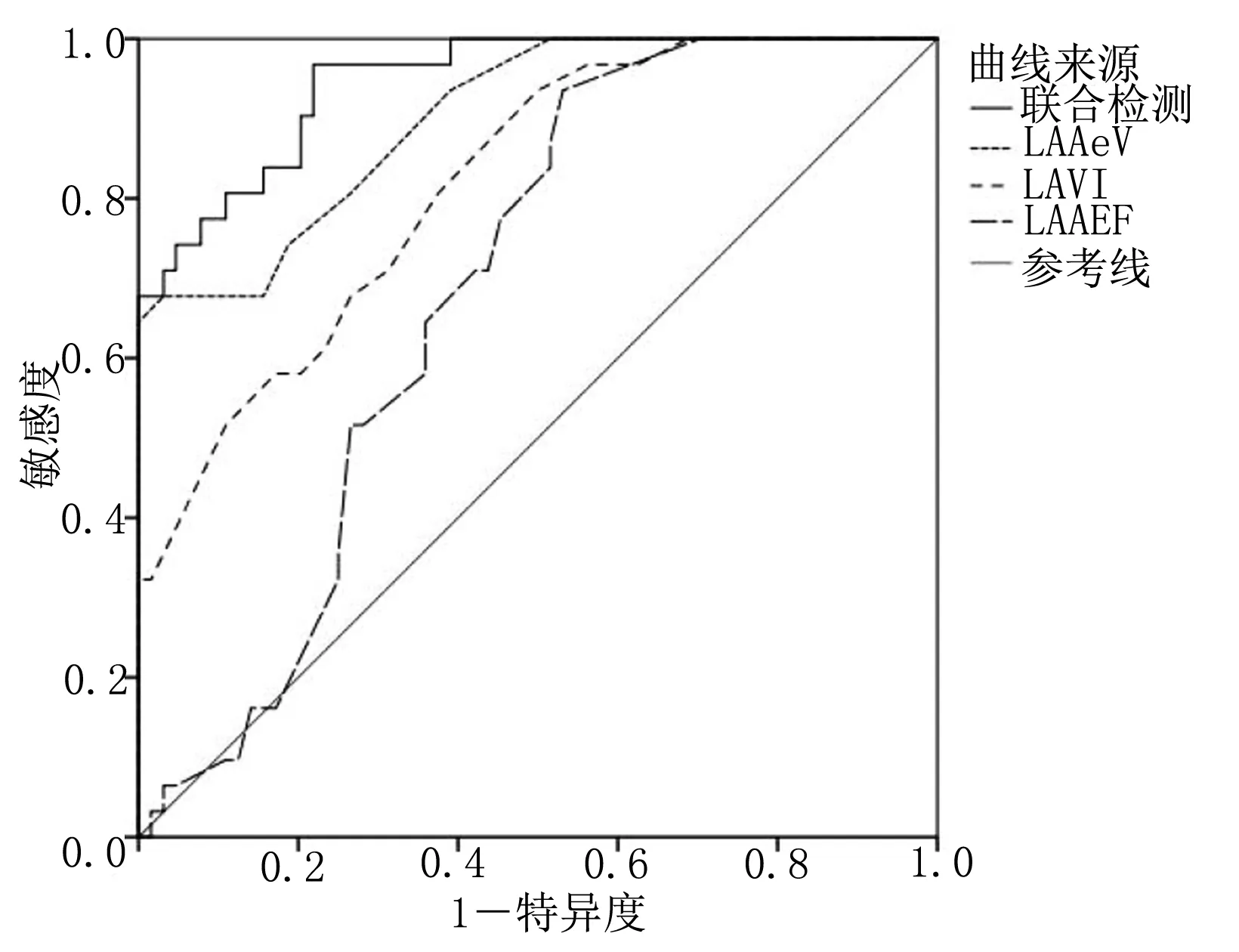
图3 LAVI、LAAeV、LAAEF预测心房颤动病人RFCA术后晚期复发的ROC曲线
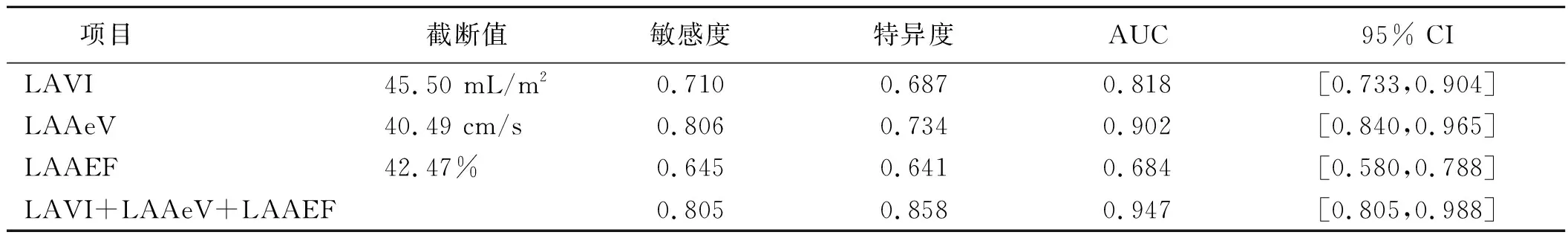
表4 LAVI、LAAeV、LAAEF预测心房颤动病人RFCA术后晚期复发的效能
3 讨 论
尽管RFCA有助于病人心房颤动的复律,但是如何在术前有效发现和预测晚期复发已经成为临床难点和热点[3-4]。在临床中,心脏三维超声心动图已经被广泛用于测量左房容积和心脏射血功能,并且TEE可以充分旋转心脏结构并通过在任何平面上切片图像来准确显示心腔,被认为是评估左心耳功能的金标准[9]。因此,本研究探讨心电图中P波形态及离散度、心脏三维超声及TEE相关指标对心房颤动病人RFCA术后晚期复发的预测价值。
本研究结果显示,心房颤动病人RFCA术后晚期复发率为32.63%,与既往研究相近[8],本研究中晚期复发率高于国内的相关研究[10],这可能是因为本研究中使用了可穿戴式的心电监测设备,可以更加及时地捕获心律失常并作出诊断,增加了无症状心房颤动的诊断率。目前,有关RFCA术后晚期复发的潜在机制尚不明确,肺静脉隔离(PVI)后发生房性反向结构和电重构,炎症和神经体液激活以及肺静脉和左心房之间的电传导恢复,也会导致心房颤动或房性心动过速的复发[11-12]。尽管多项预测研究显示,RFCA术后长期效果主要受病人特征以及射频消融策略的影响,主要包括心房颤动类型、心房颤动持续时间、LVEF、性别、年龄,存在结构性心脏病和高血压等,但在这些临床参数均不具有高水平的证据来预测晚期复发[13]。在本研究中同样未能发现这些参数是作为晚期复发的独立危险因素。
本研究单因素分析结果显示,心电图检查所获得的指标在两组之间均无差异,心电图中的P波被认为可以反映心房颤动病人的心房结构重构和电重构,而F波的振幅取决于基础电压的大小,该电压与剩余存活的心房肌的大小有关[14]。因此,低振幅F波,Pd较长以及PWD变化程度被认为是RFCA术后晚期复发的危险因素[6-7,14-15]。但是本研究中两组之间并未发现显著差异,可能是因为本研究重点关注术后晚期复发率,此时心房重构以及心肌纤维的改变仍在进行。在心脏三维超声相关指标中,复发组的左心房直径和LAVI均大于无复发组,尽管有研究显示左心房直径>50~55 mm与RFCA术后复发相关[16],但在本研究中其并不是危险因素。这是由于心房颤动诱发的扩张性左心房导致左心房形状重塑,导致在心脏三维超声胸骨旁长轴视图中通过收缩末期测得的左心房直径无法代表左心房的真实大小[17]。而LAVI可以反映左心房体积,在多因素分析中被认为是晚期复发的独立危险因素,这与既往研究结果相仿,Bajraktari等[18]的荟萃分析也证实RFCA术后左心房体积而不是左心房直径是预测心房颤动复发更准确的参数。并且ROC曲线结果显示,当LAVI>45.50 mL/m2时预测晚期复发具有较高敏感和特异度,与Istratoaie等[19]研究检测到LAVI的临界值相同,但略高于其他研究的LAVI值,如Kranert等[20]研究显示,LAVI超过36.5 mL/m2的病人更有可能出现晚期复发,LAVI的不同截断值可能归因于不同研究中的样本量和病人特征不同。
本研究单因素分析结果还显示,复发组TEE相关指标左心耳最大和最小容积较无复发组明显增加,而左心耳功能性指标如LAAEF、LAAeV和LAAfV明显降低。其中LAAeV反映左心耳的排空和收缩能力;LAAfV反映左心耳的充盈能力。研究表明,随着心房颤动的发展左心房失去节律性,左心耳在代偿过程中发生结构重塑以缓解左心房的压力变化,特征是左心耳容积增加,梳状肌萎缩和内膜弹性纤维组织增生[21-22]。尽管有研究认为左心耳容积增大后造成的电信号传导延迟以及产生更多的折返途径会导致复发率增加[23],但本研究中并未发现左心耳容积是复发的独立危险因素,这可能是由于左心耳结构重构具有一定的异质性,并且相对于左心耳的功能性指标,左心耳容积指标在预测晚期复发的能力较差[24]。多因素分析显示,LAAeV和LAAEF是晚期复发的独立保护因素,表明LAA峰值流速越高,RFCA术后窦性心律维持的可能性越大,也证实了左心耳收缩能力的下降是预测心房颤动病人RFCA术后晚期复发的可靠指标[25]。ROC曲线结果显示,即LAAeV和LAAEF的截断值分别为40.49 cm/s和42.47%时具有较高的敏感度和特异度,这与既往研究相仿,即LAAeV<39.2 cm/s,LAAEF<41.1%可以独立预测RFCA术后1年的晚期复发[8]。国内的部分研究也显示,LAAEF<44.68% 对RFCA术后复发预测价值最高[26]。由于RFCA后的术后复发受多种超声心动图参数的影响,因此,将这些多种危险因素结合起来,有助于确定RFCA术后复发的高风险病人。本研究中联合检测显示具有较高的AUC以及敏感度和特异度。
本研究局限性在于为单中心研究,样本量较小,仍需进一步多中心研究扩大样本量验证该结论。其次,本研究选用的TEE检测方法,具有一定的有创性,对左心房和左心耳功能的评估价值有限,因此还需进一步研究寻找更加适合的无创检测指标对左心房及左心耳功能进行评估。最后,尽管多项超声指标显示具有RFCA术后晚期复发的预测价值,但是由于心房颤动电生理和治疗策略的异质性,仍需对心房颤动病人进行个体化分析,结合多种参数进行复发风险的评估和预测。
综上所述,LAVI是预测心房颤动病人RFCA术后晚期复发的危险因素,LAAeV和LAAEF是心房颤动病人RFCA术后晚期复发的保护因素,LAVI、LAAeV和LAAEF的联合检测预测RFCA术后晚期复发的效率更高。

