瞬时受体电位在上气道高反应疾病神经免疫通路中的作用
张琪,赵长青,程冯丽,王艳杰
(山西医科大学第二医院 耳鼻咽喉头颈外科 山西省气道炎性疾病神经免疫重点培育实验室,山西 太原 030001)
随着生态环境的变化,上气道高反应(upper airway hyper-responsiveness,AHR)疾病发病率逐年升高,流行病学调查提示全球约30%的人群受其影响[1],严重损害患者生活质量,造成众多的经济损失及社会负担[2]。在规律用药后有约1/5的患者相关症状无法得到有效控制[3-4],根本原因是具体发病机制不明。目前AHR分为变应性鼻炎、血管运动型鼻炎、局部变应性鼻炎、嗜酸性粒细胞增多综合征等[5]。传统的免疫学理论及神经反射无法独立地对非特异性刺激所致AHR作出完整解释,神经-免疫通路填补了上述空白[6-7]。作为一个复杂的系统性疾病,神经-免疫通路经体内神经递质及免疫介质,实现神经系统与免疫细胞间复杂且精准的联系,但目前相关研究仅初露头角。
1 神经免疫通路
中枢信号可通过神经反射性调控与神经递质、炎症介质链接,调控全身多个器官(骨髓、脾脏)及免疫细胞等,实现全方面、多位点的精准调控[8]。其一主要包括刺激信号经外周传入,经中枢处理并作用于外周神经末梢及免疫细胞的闭环通路,例如持续炎症刺激下,鼻黏膜上皮细胞间、上皮下血管周围及肥大细胞(mast cells,MCs)附近含有激素肽的神经纤维密度增加[9-11]。相关研究提示,上气道高反应状态下神经肽可以相对独立地诱导呼吸道炎症[12-13]。且P物质(substance P,SP)借助神经激肽受体1(neurokinin receptor 1,NK1-R)作用于MCs,后其细胞表面另一种IgE诱导相关受体 FcεRI 的表达水平发生变化,进一步促进AHR过程[14]。二是中枢信号直接调控全身免疫系统,如在变应性鼻炎中,高级中枢的下丘脑视交叉上核通过下丘脑-垂体-肾上腺轴的内分泌调控,影响外周MCs生物钟基因Per1及相关产物实现其周期性脱颗粒[15-17]。
2 神经源性炎症
神经源性炎症中瞬时受体电位(transient receptor potential,TRP)亚家族TRPA1受体激活后,传入神经释放SP和降钙素基因相关肽等神经肽直接调控MCs脱颗粒[18-19]。前者可依赖MCs上的NK1-R及Mas基因相关G蛋白偶联受体X2在抗原介导的MCs脱颗粒中起重要作用[20]。后者在变应性鼻炎患者鼻黏膜中主要定位于MCs,也可通过相关受体激活MCs[21-23]。
轴索反射通过外界刺激诱发C神经纤维中非肾上腺素能非胆碱能神经产生双向动作电位[24]。顺向动作电位经轴突经背根神经节传入中枢的脊髓背角引起中央末端去极化,将神经递质释放到三联突触、二级神经元和近端神经胶质细胞上启动背跟反射;逆行电位传导在感觉神经纤维外周,释放感觉轴突的末端内容物、神经递质和营养因子,激活鼻黏膜腺体、微血管、趋化外周免疫细胞等,引起早期炎症瀑布样激发、鼻塞、流涕等症状,且动作电位可在轴突分支点沿多个轴突侧支传递抑制或兴奋性信息[25-26]。上述逆行动作电位诱发的神经源性炎症也可控制免疫细胞的响应功能,是神经免疫通道的重要一环。
3 免疫细胞与神经元
AHR患者的上气道黏膜神经纤维与免疫细胞的紧密作用在解剖学上也可得到一定证明。慢性炎症中大量嗜酸性粒细胞可聚集在神经轴突和副交感神经节周围,且通过释放碱性蛋白、降低神经元的激活阈值、刺激神经生长和改变神经肽表达,最终影响副交感神经及感觉神经功能,提高感觉神经的反应性[27]。另外,嗜酸性粒细胞、2型淋巴细胞、抗原提呈树突状细胞和T细胞等均在解剖关系上与感觉神经元有密切联系[28-29]。炎症诱导下的神经纤维的敏化及重塑,依赖炎症介质与神经元的相互作用,炎症状态下中速激肽释放持续增加,可引起神经纤维密度持续增加,TRPV1膜表达同时增强[30]。在组胺诱发的瘙痒中,TRPV1通道可作为pcβ3蛋白的下游靶点,引发神经元去极化动作后向中枢神经传导刺激信号[31]。辣椒素治疗由冷干空气诱发的AHR患者鼻腔高反应,是依赖阻断鼻腔黏膜TRPV1-SP伤害性信号通路产生作用[32]。
4 TRP家族的介绍及作用
TRP离子通道依据序列同源性共分为6个亚家族:TRPV、TRPM、TRPA、TRPML、TRPP、TRPC,是6个跨膜的锚蛋白结构域重复序列组成的Ca2+通道,在域5与域6之间的阳离子孔被激活后可引起细胞去极化,在体内充当细胞传感器。TRP离子通道的表达已被证实与许多免疫相关疾病的生理学及症状学有关,如呼吸道疾病:哮喘、慢性阻塞性肺疾病、皮肤病相关痒感及痛感等[33-36]。研究TRP离子通道在AHR中的作用机制十分必要,以下主要分析、描述、讨论了TRPV1、TRPA1、TRPV4 和 TRPM8 通道在上气道炎症反应中的作用。
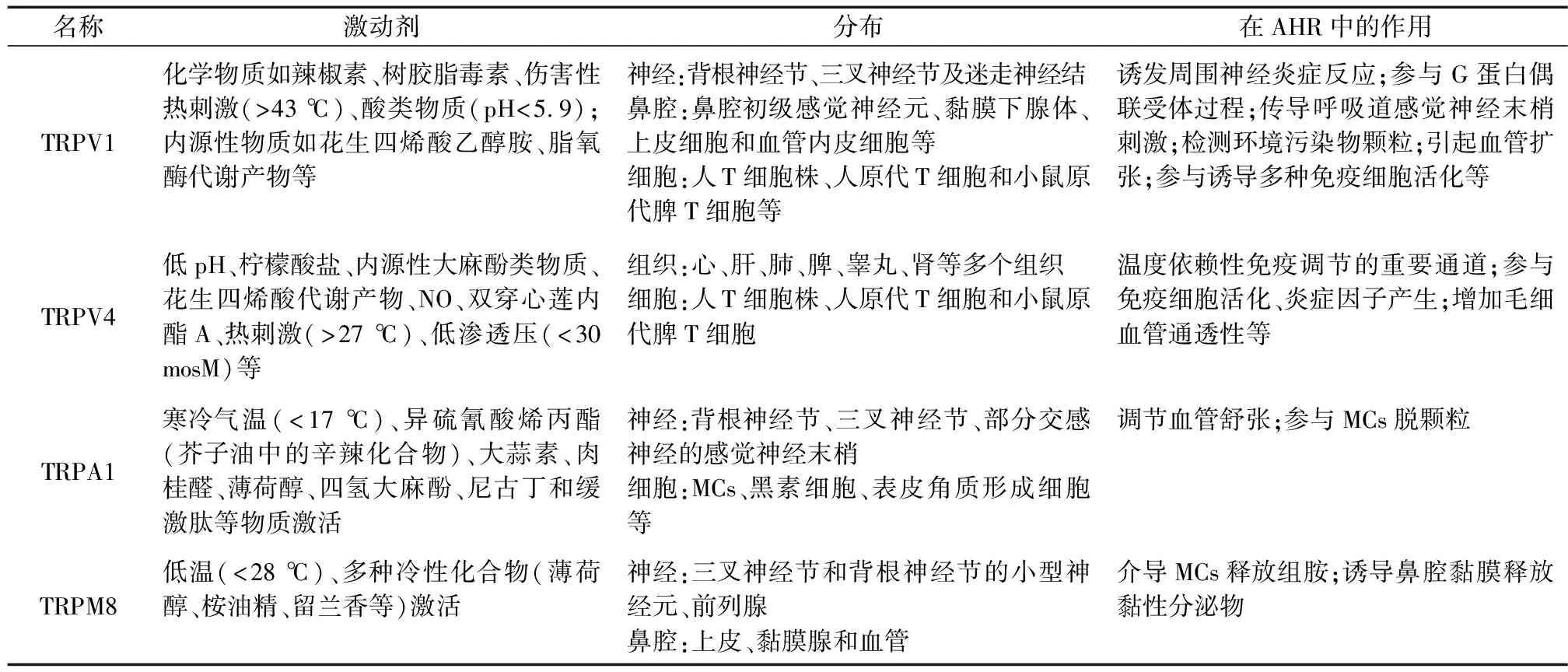
表1 TRP通道在AHR中的主要作用
4.1 TRPV1
TRPV1多位于背根神经节、三叉神经节及迷走神经结的传入神经元中,鼻腔内在初级感觉神经元、黏膜下腺体、上皮细胞和血管内皮细胞等处表达[37]。它在传导有害信号及维持炎症刺激方面表现出高度敏感性,化学物质(如辣椒素、树胶脂毒素)伤害性热刺激(>43 ℃)、酸类物质(pH<5.9)、内源性物质(如花生四烯酸乙醇胺、脂氧酶代谢产物)等都可使其活化且因对炎症因子表现出高度敏感性多被称作“病理性受体”[38]。
体内TRPV1参与周围神经炎症反应等过程。在通过药物或手术方式切断小鼠背跟神经后,分别使用辣椒素、P物质及降钙素基因相关肽注入小鼠脚掌,发现实验小鼠脚掌血流速度及脚掌厚度与正常小鼠比,前组明显减少、后组无明显差异;小鼠脚掌在使用TRPV1受体抑制剂处理后,再次注射辣椒素刺激,脚掌厚度及血流速度无明显变化。提示,TRPV1是伤害刺激传入的第一环节,刺激在传入背跟神经后可释放SP及降钙素基因相关肽引起周围神经炎症反应[39]。呼吸道高反应状态中TRPV1参与G蛋白偶联受体过程[40]、传导呼吸道感觉神经末梢刺激等作用,含TRPV1通道的神经纤维支配整个呼吸道,包括上呼吸道的鼻、喉和下呼吸道的气管、肺实质、肺泡、平滑肌和血管。使用辣椒素、柠檬酸等多种激动剂分别刺激不同组小鼠气道均可诱发小鼠产生咳嗽动作,证明TRP受体在呼吸道感觉神经末梢广泛存在;而TRPV1抑制剂可明显减少咳嗽反射,提示它影响呼吸道感觉神经末梢刺激传导[41]。甲苯二异氰酸酯(toluene diisocyanate,TDI)致敏小鼠中,TRPV1、TRPA1可与MCs共同作用,经SP通路诱导气道高反应性[42]。吸入性污染物可增加大鼠支气管中TRPV1受体基因的表达,也可检测环境颗粒物、污染物并做出反应[43]。
在对鼻腔的报道中,作为辣椒素感应受体,TRPV1已被证实可作为治疗变应性鼻炎的靶点[44]。辣椒素已在多个实验中均被证实可明显减少干冷空气刺激下的流涕等表现,TRPV1拮抗剂(Sb-705498)可降低辣椒素刺激引起的上气道症状总积分[45]。主要原因可能在于,TRPV1的表达水平与鼻腔分泌物中SP水平的增加有关,TRPV1-SP伤害性信号通路是辣椒素治疗AHR的重要扳机点[32]。TRPV1通道对鼻腔反应有一定的保护作用:TRPV 1受体基因敲除小鼠通过鼻腔吸入的变应原后,与野生型小鼠相比,其血清总IgE、白介素-4(interleukin-4,IL-4)、嗜酸性粒细胞水平明显升高,提示吸入变应原引起的2型免疫反应致敏率较野生小鼠高[46],在诱发神经源性炎症及增加呼吸道敏感性的病理发生过程中扮演着重要角色。
TRPV1也与炎症细胞密切相关,且参与了AHR的发展过程。在对人及小鼠中TRPV1通道与CD4+T 细胞的研究中发现,TRPV1通道主要在静止CD4+T细胞的质膜上表达,且可诱导CD4+T细胞活化、促进干扰素-γ(interferon-γ,IFN-γ)、IL-17A、IL-2、IL-10、IL-4等炎性细胞因子的释放,反之,TRPV1受体抑制剂可抑制CD4+T细胞的活化、炎性因子的释放,且抑制炎性因子的释放作用与CD4+T细胞凋零与否无明显相关性[47]。多种方法证实TRPV1基因、TRPV1相关蛋白均可在人鼻腔上皮细胞内表达,且呼吸道上皮细胞可被辣椒素激活相关受体,进一步产生IL-6[48]。
4.2 TRPV4
TRPV4在体内心、肝、肺、脾、睾丸、肾等多个组织细胞广泛分布,它可被低pH、柠檬酸盐、内源性大麻酚类物质、花生四烯酸代谢产物、NO、双穿心莲内酯A、热刺激(>27 ℃)、低渗透压(<30 mosM)等多种物理及化学因素激活,是一种多觉感受器通道[38]。
TRPV4通道对温度微小变化的敏感性及温度依赖活性,使其成为温度依赖性免疫调节的重要通道,且与DC的激活和成熟等免疫细胞有关[49]。采用流式细胞术和共聚焦显微镜下发现TRPV4、TRPV1通道在人T细胞株、人原代T细胞和小鼠原代脾T细胞中均有表达。TRPV通道抑制剂通过抑制肿瘤坏死因子、IL-2和IFN-γ等炎症因子的释放,调节T细胞活化及炎症因子的产生[50]。通过对TRPV4基因敲除小鼠离体背根神经的相关研究证明,TRPV4介导的致敏过程是炎症介质直接作用于初级传入神经元[51]。TRPV4通道也被证实与毛细血管的通透性有密切联系,TRPV4激动剂可通过破坏细胞基质,而增加野生型小鼠毛细血管的通透性,但对TRPV4基因敲除小鼠没有类似反应[52],虽TRPV4通道对鼻腔黏膜血管的影响暂无确切研究,但考虑鼻塞、流涕等症状均与毛细血管通透性直接相关,故推测鼻部使用TRPV4受体阻断剂可作为临床用药研究方向。
4.3 TRPA1
TRPA1与TRPV1相似,不仅可在背根神经节、三叉神经节、部分交感神经的感觉神经末梢上选择性表达,而且在MCs、黑素细胞、表皮角质形成细胞等细胞中均可测得。它可被寒冷气温(<17 ℃)、异硫氰酸烯丙酯(芥子油中的辛辣化合物)、大蒜素、肉桂醛、薄荷醇、四氢大麻酚、尼古丁和缓激肽等物质激活[38]。
TRPA1通道可链接外界刺激与感觉神经纤维,实现对血管的准确调节。研究发现,大蒜提取物和刺激性大蒜衍生物等TRPA1受体激动剂可直接激活三叉神经节和背根神经节感觉神经元上的TRPA1通道,使初级感觉神经元去极化,通过释放降钙素基因相关肽、SP及其他炎性递质以调节血管舒张[53]。
TRPA1通道与MCs脱颗粒状态息息相关。首先,TRPA1也是一种敏感的氧离子感受器,TRPA1被缺氧和高氧激活,当氧气浓度接近生理值时,TRPA1处于低活性信号,但在高氧及低氧状态下可增强感觉神经及迷走神经的放电,以适应体内氧浓度的改变,且它在相对缺氧状态下可诱导MCs产生脱颗粒动作[54]。寒冷、线粒体消耗、锌离子干扰等因素也可通过影响细胞内氧气浓度,从而刺激这一过程[55]。TRPA1在MCs中主要被定位于囊泡结构中,TRPA1通道可引起Secreto Grani III蛋白过度表达,两者的相互结合可促进MCs产生脱颗粒效果,加速炎症因子的释放[56]。
4.4 TRPM8
TRPM8在三叉神经节和背根神经节的初级传入感觉神经元以及前列腺中存在;鼻腔内多表达于上皮、黏膜腺和血管中。它可被低温(<28 ℃)及多种冷性化合物(薄荷醇、桉油精、留兰香等)激活[38]。
TRPM8可介导MCs释放组胺、诱导鼻腔黏膜释放黏性分泌物,与冷刺激下的AHR相关症状息息相关。TRPM8受体激动剂可刺激MCs释放组胺、引起变态反应,相反干扰TRPM8转录后上述症状可有明显减少[57]。TRPM 8通道是鼻腔黏液分泌的重要调节因子。鼻黏膜上皮经由免疫组化染色分析后显示TRPM8、黏蛋白5AC等均为阳性,冷刺激及TRPM8受体激动剂及作用于鼻黏膜上皮后可检测到黏蛋白5AC分泌明显增多,相反TRPM8受体拮抗剂有明显的抑制作用[58-59]。以上研究证实,冷刺激后鼻腔分泌大量清涕,可造成流涕及鼻后滴漏现象。因此,可考虑将TRPM8拮抗剂挖掘为治疗血管运动型鼻炎的新靶点。
5 小结
TRP通道在生理和病理条件下对上气道黏膜的影响研究正在逐步开展,已被证实是多种气道疾病发病机制中的重要参与者。AHR中它既作为感觉神经元上接受外界刺激的重要感受器,也进一步在神经免疫相互间起桥梁作用。目前TRPV1 阻滞剂、TRPA1 阻滞剂正逐步进入临床治疗研究,开启了TRP 通道调节剂治疗AHR的新篇章。基因敲除、选择性TRP调节剂等多重实验均证明其在鼻黏膜功能性研究中发挥重要作用,有望使生理及病理下的表达模式、调控机制等谜底被逐个揭晓,而TRP通道作为神经免疫相互作用的关键点对AHR发病机制及临床药物新靶点的研究均有广阔的前景。

