PNA与引物的连接方法以及探讨潜在的价值
农琛,刘德文,赖凤明,王太重,唐玉莲
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院检验学院,广西 百色 533000)
肽核酸(peptide nucleic acid,PNA)是一种人工合成的类似于 DNA 或 RNA的聚合物[1-2]。由于PNA不带负电荷,与核酸间不存在静电斥力,因而结合的稳定性和特异性都大有提高。同样的,PNA既不属于多肽,也不属于核酸,所以不易被蛋白酶或核酸酶水解[3]。许多研究人员利用PNA的这些特性,成功地筛选出目的基因,比如SATO Y等[4]基于PNA开发了用于检测甲型流感RNA启动子区域的荧光探针。同年,PETITI J等[5]基于PNA-PCR钳夹效应开发了一种新型、快速且廉价的检测SF3B1基因突变方法,并且该方法通过了高通量测序技术的验证。无独有偶,KAWASAKI A等[6]使用PNA钳夹选择性地与植物基因组的靶区结合,并在PCR(polymerase chain reaction,PCR)过程中抑制其扩增,成功地提高了植物组织中细菌的16S rDNA的扩增产物。由此可见,PNA无论是用于核酸的扩增还是抑制,都得到了许多科学家的认可。胎儿遗传疾病的非损伤性产前诊断(non-invasive prenatal testing,NIPT)在临床遗传学中起着至关重要的作用[7]。因此,寻找非侵入性产前诊断的方法一直备受关注[8-10]。LO Y M等[11]从母体血浆中成功提取到胎儿游离DNA(cell-free fetal DNA,cffDNA)后,为NIPT开辟了新的可能。据相关研究表明,cffDNA在妊娠第4周就可检出,占总游离DNA的10%~20%。孕早期和孕晚期的cffDNA浓度分别为25.4和292.2 基因组当量每毫升(genome equivalents/ml,GE/ml)[12]。cffDNA的长度比母源DNA短许多,99%的cffDNA<313 bp,而母源DNA则>1 kb[13-14]。自2011年以后,基于cffDNA的非侵入性产前检测已经商业化,并完成了从传统的侵入性筛查向现代化技术无创诊断的转变[15]。然而,由于仪器成本和检测范围存在差异等问题,想要引入临床实践仍具有不小的挑战[16-17]。
在这里,本研究报道了一种新型cffDNA富集的方法,理论上在混有DNA长短片段的溶液中,该方法可以选择性地扩增短片段(cffDNA)而不扩增长片段(母源DNA)。支撑该方法的理论依据主要有三点,第一点是在孕妇外周血中,cffDNA与母源DNA大小不同[14];第二点则是在PCR反应中,PNA会优先于引物与DNA模板结合,且不会受各种酶的影响[18-20];第三点,点击化学具有可选择性、结构稳定性强、易纯化和操作等优点[21-22]。基于以上三点,本研究设计两对引物,其一用于扩增SRY基因上长度小于313 bp的DNA短片段,模拟cffDNA。其二用于扩增部分包含上述短片段的DNA长片段,模拟母源DNA。将DNA长短片段混合后构建SRY基因模型。最后,通过SRY基因模型中展示PNA-引物富集cffDNA的潜力。
1 材料和方法
1.1化学药品和试剂 无水硫酸铜(CuSO4)、(R)-2-((S)-1,2-二羟基乙基)-4-羟基-5-氧代-2,5-二氢呋喃-3-醇钠、乙二胺四乙酸四钠、三(3-羟基丙基三唑基甲基)胺(THPTA)、乙醇、醋酸三乙胺均从上海比得医药科技股份有限公司购买;PBS缓冲液0.01 M(pH=7.3±0.1)、无酶无菌水均从北京索莱宝科技有限公司购买;引物由Primer 5.0 软件设计完成后外送上海生工生物工程有限公司合成;PNA从杭州泰禾生物技术有限公司购买。引物序列以及PNA序列如表1所示,部分相对位置示意图如图1所示。

表1 PNA-引物反应体系中涉及到的引物以及PNA相关信息
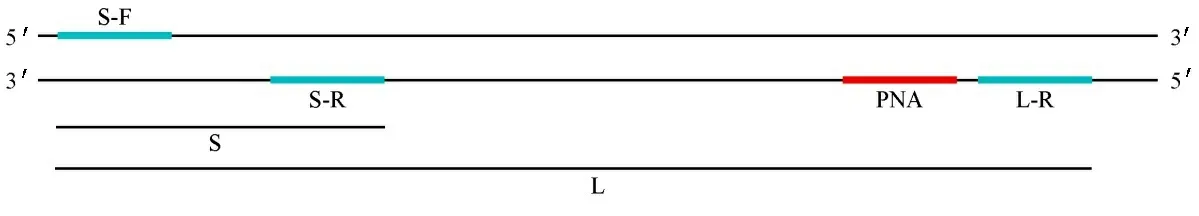
注:S表示扩增SRY基因上的DNA短片段,长度为134 bp;L表示扩增部分包含SRY基因的DNA长片段,长度为1088 bp;S-F表示扩增S和L通用的上游引物;S-R为扩增S的下游引物;L-R为扩增L的下游引物;红色条带表示PNA结合位点。
1.2PNA-引物的连接步骤和层析条件 将50 nmol的PNA(含叠氮)和50 nmol的下游引物(S-R,含炔基)溶解在含有10 nmol NaCl的10 mL PBS缓冲溶液(10 mM)中,然后将以上溶液加入到溶解有THPTA(0.5 μmol)、CuSO4(0.5 μmol)、抗坏血酸钠(2.5 μmol)的PBS缓冲溶液(10 mM)中,总体积为20 mL。在室温下反应3 h后,往以上混合物中加入2 mL的NH4OAc(5M)和50 mL乙醇,过滤后得到的固体粉末使用SCIENTZ-10ND多歧管压盖型冷冻干燥机(SCIENTZ)在-80 ℃冷冻干燥120 min。冷冻干燥后的固体溶于无菌无酶水,使用变性聚丙烯酰胺凝胶电泳(Denaturing Urea Polyacrylamide Gel Electrophoresis,Urea-PAGE)进行脱盐,同时将疑似连接产物的片段进行回收。粗产物在通过Supfex HP-C18 (250 mm×4.6 mm,5 μm,Zafex)进一步纯化,在使用Agilent 1100 series液相色谱仪(Agilent)分析过程中,流动相A为0.1 M醋酸三乙胺溶液;流动相B为80%的0.1 M醋酸三乙胺和20%的乙腈。该连接反应的化学方程式如图2所示。
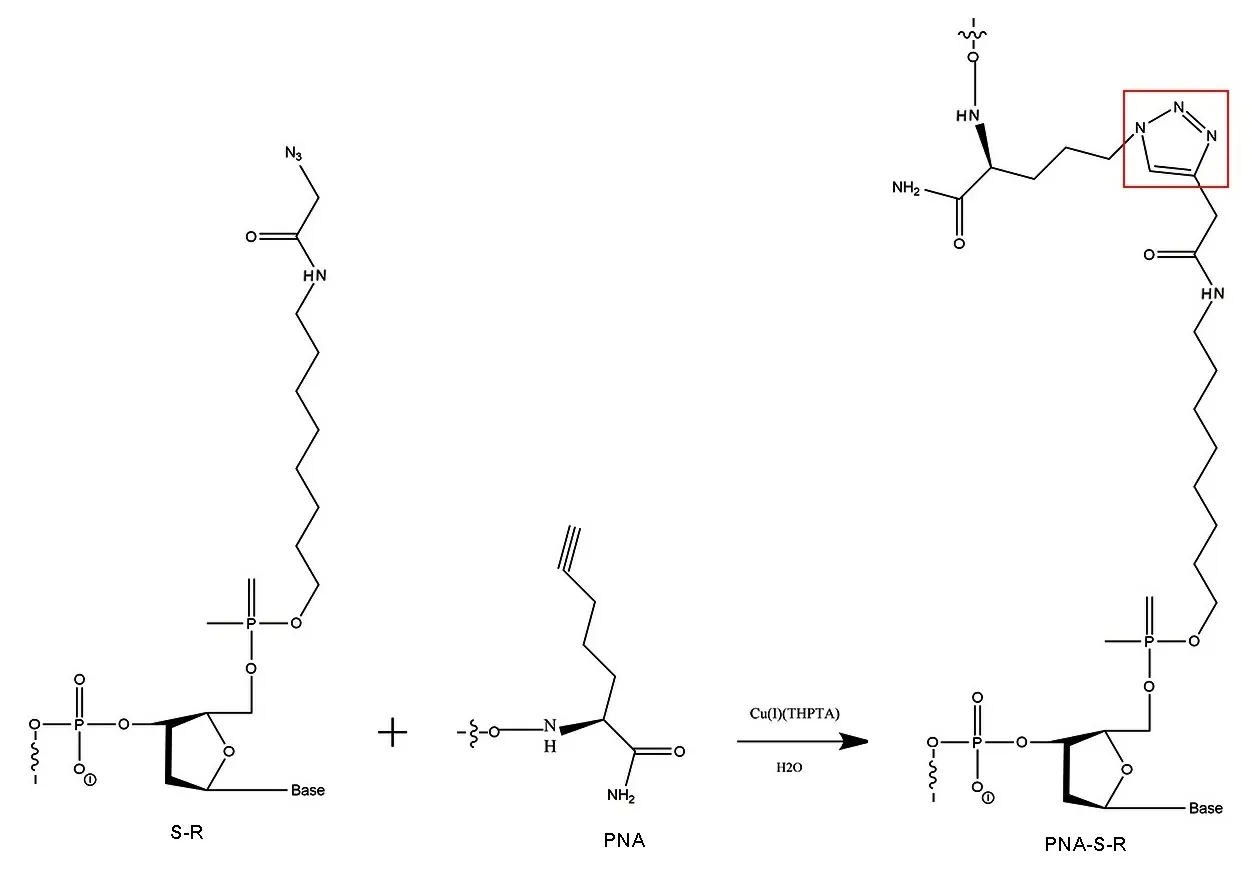
图2 PNA和引物基于点击化学反应连接的方程式
1.3PNA-引物的表征 为了明确PNA-引物是否合成成功,本研究通过质谱分析对合成的PNA-引物进行表征。利用 Thermo ScientificTMLTQ XLTM线性离子阱质谱仪对已分离纯化后的PNA-引物进行鉴定,加样条件为电喷雾电离源 (ESI) ,采集模式:电喷雾正离子或负离子模式,雾化气:氮气,离子源电压为4500 V,碰撞能量扩增(CES)为15 V,样品进样流速为5 μL/min。质谱扫描范围为M/Z 500~20 000。使用Peakview 1.2软件(美国AB SCIEX公司)对获得的结果数据进行可视化分析。
1.4SRY基因模型的构建 本次实验已经获得右江民族医学院附属医院医学伦理委员会同意(YYZY-LL-2022-89),以下实验均严格按照说明书进行。当女性怀有男性胎儿时,血浆中的SRY基因只来源于胎儿,因此以SRY基因代表cffDNA对PNA-引物的功能进行初步探讨。具体方法:取5名未妊娠的健康女性外周血,离心后收集血浆贮存于-80 ℃备用。取1名健康男性的外周血进行核酸提取(Ezup Column Blood Genomic DNA Purification Kit,上海生工生物工程有限公司),使用两对引物分别扩增SRY基因的DNA短片段和部分包含SRY基因的DNA长片段(Taq PCR Master Mix,上海生工生物工程有限公司)。经过0.1%的琼脂糖电泳后(Agarose,西班牙Biowest公司),采用切胶回收试剂盒实现DNA长片段和短片段的回收(GeneJET Gel Extraction Kit,赛默飞世尔科技公司),成功回收后再取5 μL DNA溶液进行电泳鉴定。最后使用女性血浆将DNA短片段和长片段调整至相同的摩尔质量并混匀,模拟孕妇外周血中cffDNA具有与母体DNA相同的基因片段环境,构建SRY基因模型,记为Y0溶液。
1.5分析方法的验证 在确保PNA与引物成功连接后,为了防止过量的回收DNA产物抑制PCR反应[23],同时更好地体现出PNA的阻断作用,本研究对回收的DNA片段进行50倍的等比倍比稀释,通过比较PCR的结果进行初步验证。PCR反应体系的配置为:Taq PCR Master Mix取25 μL,2 μL的上游引物(S-F),2 μL的PNA-引物,1 μL的Y0溶液,20 μL的无酶无菌水,总体积为50 μL。在其它的配置都相同的情况下,本研究将Y0溶液更换成只有DNA长片段的溶液作为对照组。聚合酶链式反应包括30个循环:94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s。经过0.1%的琼脂糖电泳后,使用UVP ChemStudio 515(Analytik-Jena,德国耶拿分析仪器股份公司)进行成像以及分析电泳条带的浓度。以marker条带的浓度作为参照物进行相对定量分析(DNA Marker,上海生工生物工程有限公司),选择性扩增短片段的富集效率计算公式如下:
DNA短片段扩增产物的富集效率(%)=[(x-y)/x]×100%
其中x表示使用PNA-引物对DNA长短片段混合物进行聚合酶链式反应获得的扩增片段浓度;y表示表示使用PNA-引物对只含有DNA长片段的模板进行聚合酶链式反应获得的扩增片段浓度。
2 结果
在本研究中,基于DNA片段的物理特性,首次尝试对PNA与引物进行连接,在不破坏每个试剂功能的前提下,通过点击化学将二者成功的连接起来,利用PNA的固定作用,极大可能地阻止了引物与相应位点的结合,从而阻断长片段自身的扩增,基于此原理(如图3所示),本次研究将DNA长片段和短片段混合,使用PNA-引物反应体系进行PCR扩增以检测选择性扩增DNA短片段的效率。本次研究对所有参与反应的些参数都进行了优化。从另一方面来说,这种新方法可以为cffDNA的分离以及纯化提供新的思路。
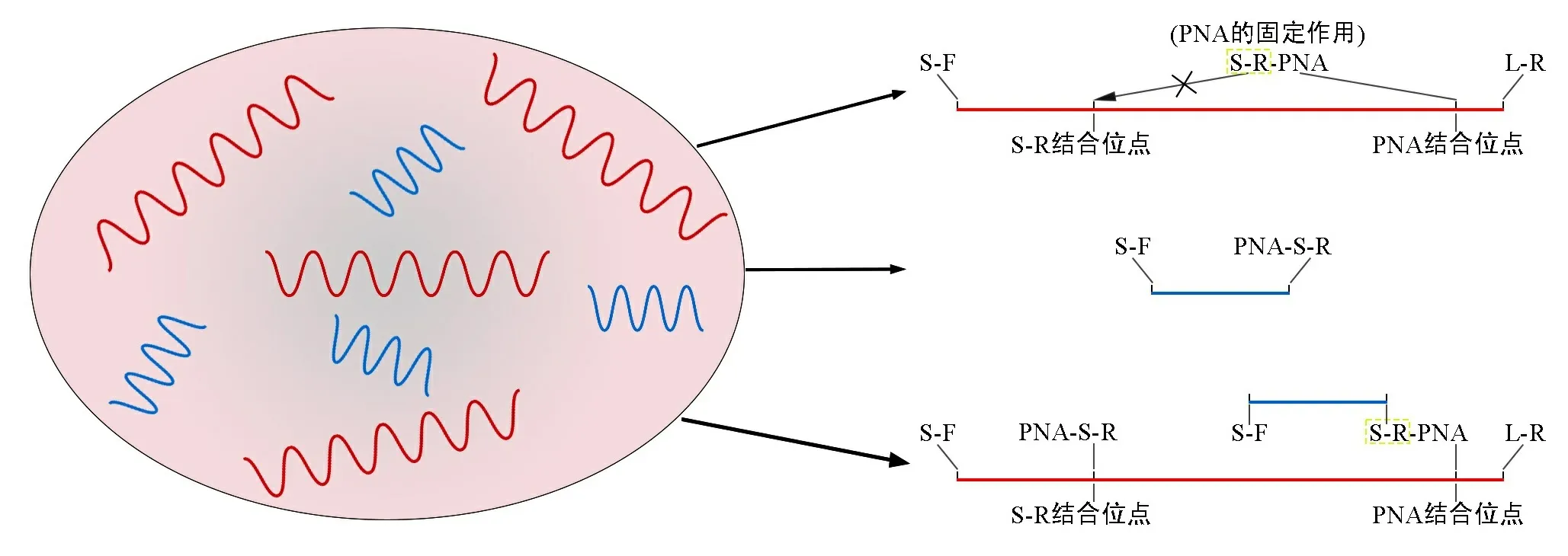
注:红色表示DNA长片段,蓝色表示DNA短片段;理论上,Y0溶液中存在以上3种扩增反应的可能。当PNA-S-R的量远远超过DNA长片段的量时,则存在第三种可能性。
2.1PNA-引物的分离以及纯化 为了判断点击化学反应能否将含有叠氮基团的PNA与含有含炔基的引物进行连接,本次研究将具有不同反应条件的溶液进行初步的处理后,通过Urea-PAGE电泳可以得知(见图4),在电泳道1中接近50 nt位置的条带极大可能就是PNA与引物的连接物,而在25 nt附近的两条条带通过与电泳道3相比,可以判断出是引物与催化剂反应所生成的副产物。随后,本次研究通过切胶回收,将疑似连接产物的电泳条带通过高效液相色谱仪(high performance liquid chromatography,HPLC)纯化后,在与单独的PNA和引物进行比较(见图5,补充图1),结果发现三者的出峰时间均不相同。
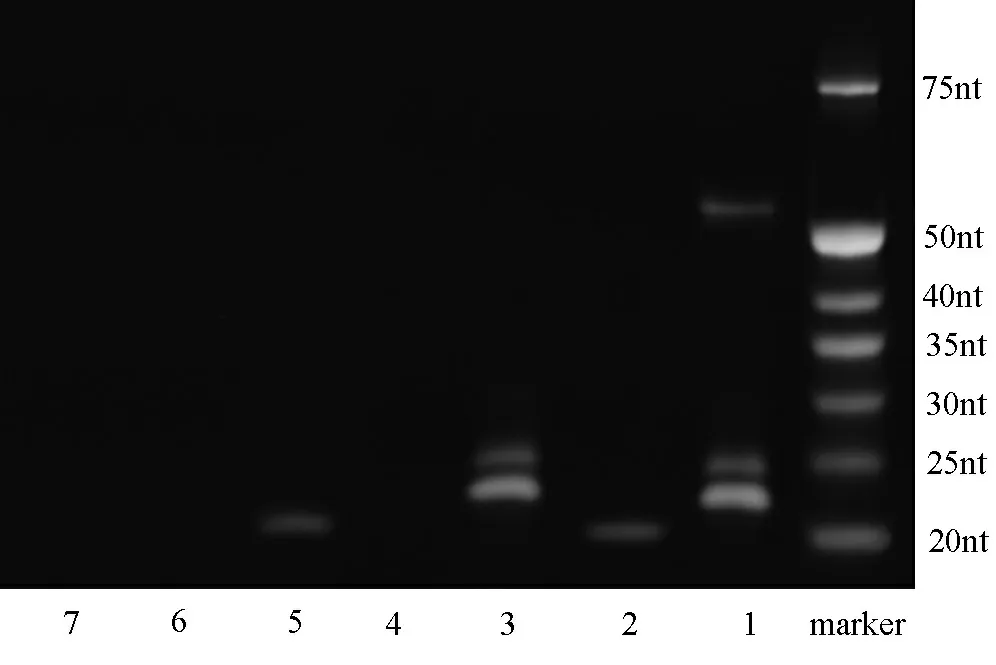
注:泳道1为PNA与引物在催化剂存在下反应3 h;泳道2为PNA与引物在没有催化剂的情况下反应3 h;泳道3为引物单独与催化剂反应3 h;泳道4为PNA单独与催化剂反应3 h;泳道5为仅有引物;泳道6为仅有PNA;泳道7为含有催化剂的反应溶液。
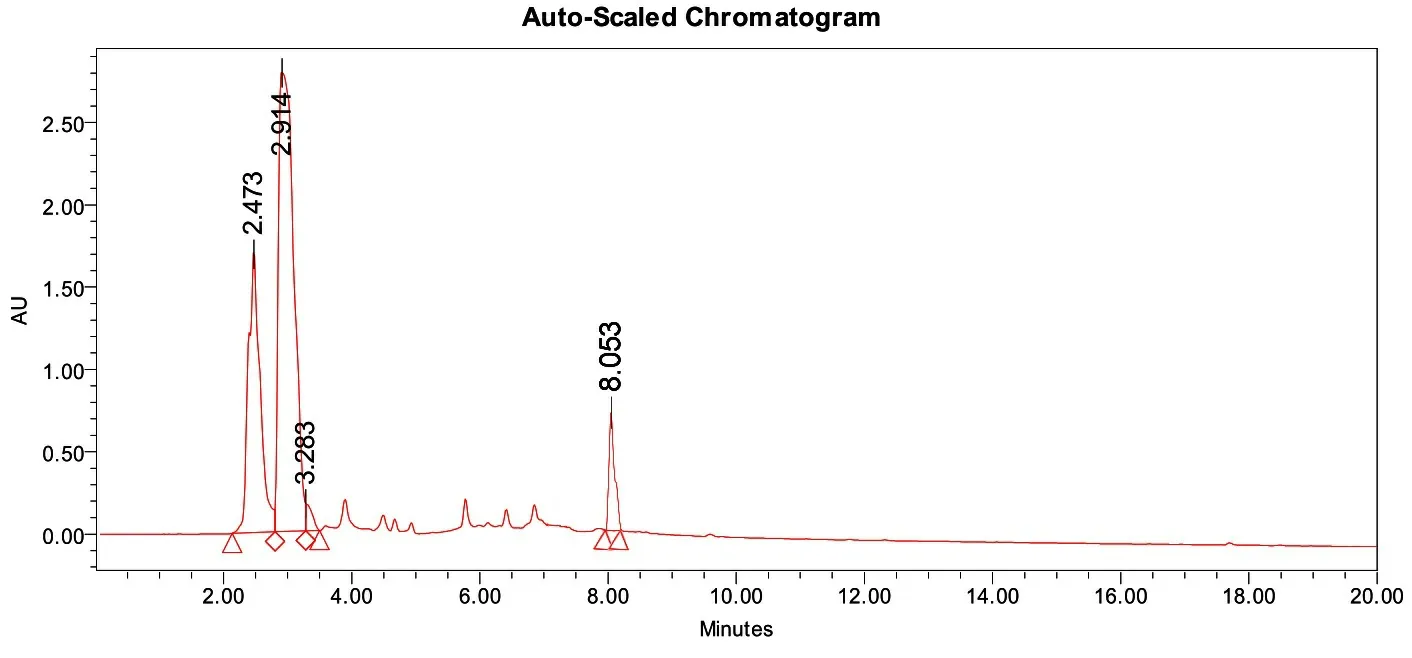
图5 PNA-引物、引物和PNA依次在HPLC中的峰值时间
2.2质谱的表征分析 为了判断生成的连接物是否就是由PNA与引物连接而成的,本次研究使用Thermo ScientificTMLTQ XLTM线性离子阱质谱仪对已经分离纯化后的PNA-引物进行表征。在质谱分析中,如图6A~图6C所示,PNA-引物的分子量理论值应该等于PNA的分子量加上引物的分子量,在误差允许的范围内,质谱仪器得出的分子量结果为10546.2 Da,其结果符合预期的理论值范围。综上所述,本次研究通过Urea-PAGE电泳实验分析、HPLC分析以及质谱分析,成功地确定了PNA-引物已经连接成功。

注:A为引物质谱分析的结果;B为PNA的质谱分析结果;C为PNA-引物的质谱分析结果。
2.3PNA-引物的富集效率检测结果 在确保PNA-引物连接成功后,本次研究首先要保证PNA和引物各自的功能都不受到影响,为此,基于前期的实验研究,使用包含了PNA碱基序列的引物(33号引物对)进行测试,如图7A所示,在电泳条带1、2号中,33号引物对能够正常扩增出产物,而加入PNA后的3、4号电泳条带却无法扩增出产物,则说明PNA阻断了引物与DNA模板的结合,同样的,在加入PNA-引物后(5、6号电泳条带),电泳的结果同样能够说明连接后的PNA功能没有改变。接下来是对引物的功能进行判定,为了防止PNA的阻断效应出现,本次研究使用短片段作为DNA模板进行扩增,结果如图7B所示,在相同的条件下,二者都能扩增出模板DNA,则说明引物的功能没有改变。最后是对PNA-引物的特异性扩增DNA短片段进行测试,等比倍比稀释后的DNA长片段经过相同浓度的引物和PNA-引物扩增后,其扩增出来的条带亮度以及扩增阈值均不相同(补充图2)。通过对Y0溶液的扩增以及电泳条带的分析,基于相对定量的方法进行浓度判断,以点对点的方法创建浓度曲线,最终结果如图4C所示,具体浓度可以从表2获得。通过两独立样本t检验(见图4D)可以得知,PNA-引物反应体系在两种不同的溶液中扩增出的产物相对浓度不同,差异具有统计学意义(P<0.0001),基于上述选择性扩增DNA短片段的富集效率计算公式,可以算出5组PNA-引物反应体系在Y0溶液中选择性扩增DNA短片段的效率分别为:72.27%、81.21%、79.51%、83.20%、79.66%。因此,虽然该新方法目前还不能做到百分之百的只扩增DNA短片段而不扩增DNA长片段,但从目前的结果来看,这依然是一个非常具有潜力的新方法,可以为cffDNA的富集提供新的视角和研究方向。
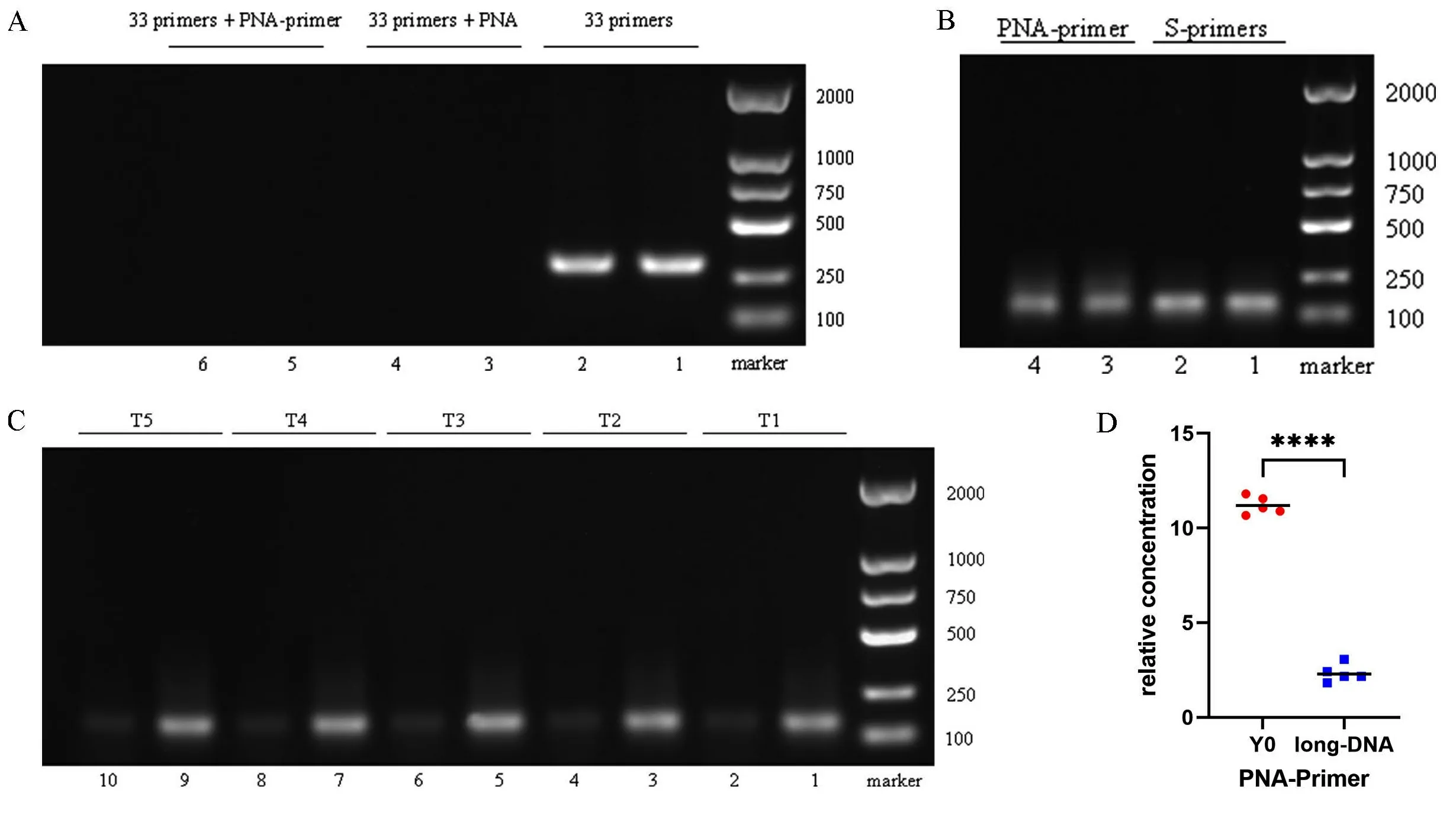
注:A为PNA性能的测试;B为引物的性能测试;C~D为PNA-引物在5组Y0溶液和DNA长片段溶液中的扩增效率比较;****P<0.0001。

表2 每条电泳带的相对浓度值
3 讨论
肽核酸因其高度的灵活性,可以通过广泛的构象来结合其它生物分子,并且被认为在未来的纳米生物技术中会具有至关重要的作用[24]。使用PNA来代替探针中的DNA,可以提高探针的亲和力、靶标特异性和抗生物降解性[25-26]。与传统的northern印迹杂交、微阵列和逆转录聚合酶链式反应等技术相比,使用PNA探针技术不需要核酸的提取和扩增,可以直接检测细胞中的核酸成分[27-28]。因此,通过点击化学反应,将PNA与引物进行连接,并且保留各自的性能不被破坏,生成的PNA-引物在未来的纳米生物技术具有非常大的潜力。
利用孕妇外周血中胎儿游离DNA进行无创性产前诊断已成为产前诊断的目标,NIPT既可以获得完整的胎儿遗传信息,同时又能避免对母婴的风险。因此,为了从母体循环中获取稀有的胎儿细胞,开发高效的分离技术是必要的[29-30]。然而从母亲血浆中有效地分离cffDNA是一个至今没有解决的技术难题,现有的cffDNA分离技术主要有大规模并行测序(MPS)[31-32],液滴数字PCR(ddPCR)[33-34]和物理分离法[35-36]。其中MPS的全基因组测序或靶向测序方法被认为是准金标准,ddPCR是一种新颖的技术,同样具有稳健、灵敏、高效和可靠的技术[37],但这两种方法所涉及的仪器成本高昂,距离常规临床应用,有较大的距离。物理分离法是目前已被公认的可以从母体血浆中得到高比例cffDNA的可靠方法[38],但该法的缺点是通量低,且可能产生样品污染,不是一个理想的临床常规方法。总的来说,在过去的十年里,有关cffDNA富集的方法,或通量低,或成本高,或程序复杂难以满足临床常规应用的要求。
在本次研究中,通过构建SRY基因模型,简单模拟孕妇外周血环境,其研究目的就是使用一种新方法可以选择性地将混合溶液中的DNA短片段(cffDNA)进行选择性扩增。在该实验中详细地讲解了基于点击化学将PNA与引物进行连接方法,这是一种创新的方法。然后分别通过变性聚丙烯酰胺凝胶电泳、高效液相色谱仪以及质谱仪对PNA-引物进行表征,进一步确定了PNA-引物的成功合成。最后,通过PCR反应结合电泳条带的浓度分析,初步对该反应体系的富集效率进行评估,在特定的浓度条件下,DNA短片的富集效率可以高达83.20%,这是一项令人振奋的消息。
综上所述,基于DNA片段的大小,开发了一套利用“PNA-引物”进行选择性富集DNA短片段的方法,这种新方法同时具有通量高、成本低的特点,为cffDNA的分离以及纯化提供了新的思路。然而,本研究仍然存在一些不足之处:①本研究中对于DNA长片段与PNA-引物的浓度比例选择比较苛刻,理想状态下,二者1∶1的比例是PNA能够阻断引物与DNA模板结合的最高阈值比例,若PNA-引物的量越是高于DNA长片段的量,则扩增的假阳性比例就会越多。理论上,PNA-引物的量越是低于DNA长片段的量,则特异性扩增出DNA短片段(cffDNA)的比例也就越大;②本研究仍然存在可以改进以提高扩增DNA短片段效率的空间,比如说将短片段的上游引物与另一个PNA进行连接,以增强引物对DNA短片段结合的特异性,进而降低母源DNA的干扰;③为了能够更好地验证该方法的实用性,后续的实验应构建孕妇具体的外周血模型或者在临床上使用不同孕期的孕妇进行验证,同时与MPS金标准进行比较,但受限于许多因素的影响,很遗憾,本次研究未能完成这一步的验证。

