鸭跖草水提物对H.pylori的抑制作用及其机制研究
徐佳音,黄已桃,黄干荣,,覃艳春,,罗家锱,,黄亮,黄衍强,
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院基础医学院,广西 百色 533000;3. 广西病原微生物耐药防控科技创新合作基地,广西 百色 533000;4. 广西高校耐药微生物感染防治研究重点实验室,广西 百色 533000)
幽门螺杆菌(Helicobacterpylori,H.pylori)是一种微需氧革兰氏阴性菌,菌体呈螺旋杆状,它与胃窦炎、消化性溃疡、胃腺癌和MALT淋巴瘤的发生关系密切[1]。1994年H.pylori被国际癌症研究机构(IARC)列为胃癌的Ⅰ类致癌源,据统计[2],约有90%非贲门胃癌的发生与H.pylori的长期感染有关。因三联疗法极易产生耐药,所以目前临床上用于根除H.pylori感染的首选治疗方案为四联疗法(质子泵抑制剂+铋剂+2种抗生素),然而对于抗生素滥用产生的耐药及患者严重的不良反应,是根除H.pylori失败的主要原因[3],因此H.pylori耐药形势非常严峻,急需不易产生耐药、疗效好、毒副作用少的新药物。
我国关于中药及其提取物对H.pylori感染的治疗有过许多报道,近年来有研究表明某些中药如大黄、连翘等中药及其提取物都对H.pylori有抑制或者杀灭的作用[4]。鸭跖草为鸭跖草科鸭跖草属植物鸭跖草(commelina communis)的全草,中药材鸭跖草具有清热泻火、解毒、利水消肿的功效[5]。对于鸭跖草的药理研究很多,YOUN J Y等[6]发现鸭跖草具有抑制α-葡萄糖苷酶活性,即防止血糖上升的作用;BING F H等[7]发现鸭跖草具有抗流感病毒的活性。除此之外鸭跖草还具有抑菌、抗炎、抗氧化、治疗前列腺肥大、治疗先兆流产等多种药理作用及临床应用,这可能与鸭跖草中的成分较多有关[8]。对于鸭跖草的抑菌作用,只有关于金黄色葡萄球菌、白色念珠菌等细菌的药敏检测,对H.pylori的抑制作用及其机制未见相关报道。本研究的目的为检测鸭跖草水提物对H.pylori及非H.pylori的MIC,通过对其抑制H.pylori的机制探索,以期为后续相关实验研究及临床应用提供重要依据。
1 材料与方法
1.1实验试剂 鸭跖草购于瑞丰成中药材,营养肉汤液体培养基(杭州百思生物技术有限公司,BS1002),营养琼脂培养基(杭州百思生物技术有限公司,BS1101),沙保液体培养基(上海普振生物有限公司,KLM221015),沙氏琼脂培养基(青岛海博生物技术有限公司,HB0235),Columbia blood Agar base(OXOID,lot3484622),Brain Heart infusion(BHI)培养基(OXOID,lot3555372),小牛血清[平睿生物科技(北京)有限公司,lot20220922],电镜固定液(Servicebio,G1102),无水乙醇(General Reagent,CAS64-17-5),克拉霉素(四川省旺林堂药业有限公司,220601),阿尔玛蓝(北京索莱宝科技有限公司,A7631),PBS[生工生物工程(上海)股份有限公司,B040100-0005],RIPA裂解缓冲液(碧云天生物技术有限公司,P0013B) ,蛋白酶抑制剂混合物(碧云天生物技术有限公司,P1005),RNA提取试剂盒(诺唯赞FastPure Cell/Tissue Total RNA Isolation Kit V2,RC112-01),逆转录试剂盒(Monad,MR05101M),qPCR试剂盒(Monad,MQ10301S),H.pylori标准菌株(26695、G27)由南京医科大学毕洪凯实验室赠送,H.pylori临床分离菌株(HPBS001~HPBS016)为本实验室分离,其余菌株均购自广东微生物保藏中心。
1.2鸭跖草水提物的制备 参考万京华等[9]的提取方法准确称量鸭跖草500 g,用蒸馏水冲洗泥沙,加水浸泡30 min后,煎煮3次,第一次1 h、第二次45 min、第三次30 min。使用纱布过滤3次滤液,合并进行浓缩,放入真空冷冻干燥机(四环福瑞科仪科技发展有限公司,LGJ-10C)中,干燥完成后称重,得鸭跖草水提物87.65 g,放-20 ℃冰箱密封备用。
1.3制备药物固体琼脂培养基 参考廖丽娟等[10]配制含药培养基,根据培养基配制说明书,配制营养肉汤液体培养基、沙氏液体培养基、脑心浸液(加入10%小牛血清)、营养琼脂培养基、沙氏琼脂培养基、哥伦比亚培养基,称量鸭跖草水提物将其加入已灭菌好的固体培养基中,设置100 mg/mL、10 mg/mL、1 mg/mL、0.1 mg/mL 4个浓度的含药培养基,待药物完全溶解后,倾注平板。
1.4琼脂稀释法测定 MIC受试菌株(金黄色葡萄球菌、鲍曼不动杆菌等)经复苏活化、培养后,用1.3中相应的液体培养基制备成菌液,OD=0.3(相当于1×108CFU/mL的菌液浓度),再稀释为1×106CFU/mL,其中H.pylori菌株、空肠弯曲杆菌只需稀释为1×107CFU/mL,而白色念球菌、热带假丝酵母菌、新生隐球菌需制备成浓度OD=0.5(相当于5×106CFU/mL的菌液浓度),最终稀释为1×103CFU/mL。取上述菌液各1 μL,接种到100 mg/mL、10 mg/mL、1 mg/mL、0.1 mg/mL及未加药对照组的琼脂药板上,将相应剂量的液体培养基接种于含药培养基中作为阴性对照,其中热带假丝酵母菌、新生隐球菌等真菌置于30 ℃恒温培养箱中孵育48 h,H.pylori菌株、空肠弯曲杆菌置于三气培养箱中孵育72 h,其余置于37 ℃恒温培养箱中孵育24 h,观察实验结果,判断实验终点,MIC为抑制细菌生长的最低药物浓度,实验重复3次。
1.5扫描电子显微镜标本制备 将H.pyloriG27培养至对数期,菌液浓度制备为OD=0.3(相当于1×108CFU/mL的菌液浓度),取8 mL加入鸭跖草水提物至工作浓度为10 mg/mL、0 mg/mL,两者共孵育12 h、24 h,离心取沉淀并用电镜固定液于4 ℃固定过夜,使用30%、50%、70%、90%、100%的乙醇进行梯度脱水10 min,100%乙醇脱水2次,离心取沉淀进行冷冻干燥,将样品喷金并于扫描电子显微镜(北京中科科仪股份有限公司,KYKY-EM8100)观察。
1.6鸭跖草水提物对H.pylori生物膜的作用 将G27培养至对数期,菌液浓度制备为OD=0.1(相当于0.33×107CFU/mL的菌液浓度),加入0.5毫升/每孔至24孔平底培养板中(蛋白含量测定为0.2毫升/每孔至96孔平底培养板),在微需氧条件(85%氮气、5%氧气、10%二氧化碳)下孵育3 d形成生物膜。加入鸭跖草水提物至工作浓度为200 mg/mL、100 mg/mL、50 mg/mL、0 mg/mL,克拉霉素作为阳性药物对照,孵育24 h后吸出药液,PBS洗生物膜2~3次后加入没有药物的脑心培养基0.3 mL。阿尔玛蓝实验为每孔加入30 μL阿尔玛蓝,于微需氧条件下培养4 h观察颜色变化。蛋白含量测定为每孔加入50 μL裂解液(RIPA裂解液∶蛋白酶抑制剂∶EDTA=100∶1∶1),裂解30 min后使用BCA蛋白试剂盒进行蛋白测定并使用多功能酶标仪(BioTek,America)进行定量。
1.7RNA提取及qPCR实验 使用上述1.5的药物与菌液共孵育方法,按照TNA提取试剂盒说明书提取菌体RNA,并于-80 ℃冰箱保存。然后根据逆转录试剂盒说明书将RNA逆转录成cDNA,qPCR根据试剂盒说明书在实时荧光定量PCR仪器(Roche,LightCycler96)上进行,95 ℃预变性30 s,95 ℃变性10 s,60 ℃火延伸30 s,40个循环。分析解离曲线以验证产物的均匀性。16S rRNA扩增子用作内部对照。通过相对定量2-△△Ct方法确定转录水平的变化。引物序列见表1。
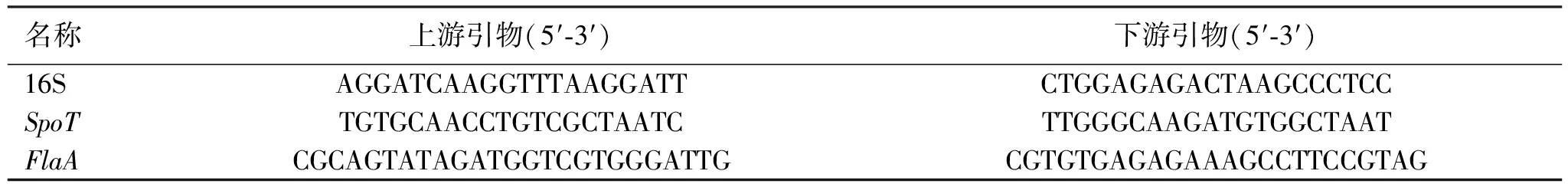
表1 引物序列
2 结果
2.1鸭跖草水提物的抑菌作用 鸭跖草水提物对H.pylori有很好的抑制效果,除对H.pyloriG27和H.pyloriHPBS006的MIC为100 mg/mL外,其余均为10 mg/mL,见表2。对于非H.pylori菌株如肺炎克雷伯菌、白色念球菌、大肠杆菌、新生隐球菌,鸭跖草水提物的MIC>100 mg/mL,对其余菌株均为100 mg/mL(除空肠弯曲杆菌为10 mg/mL),见表3。说明鸭跖草水提物在10 mg/mL就可以对H.pylori的菌株有专一的抑制作用。
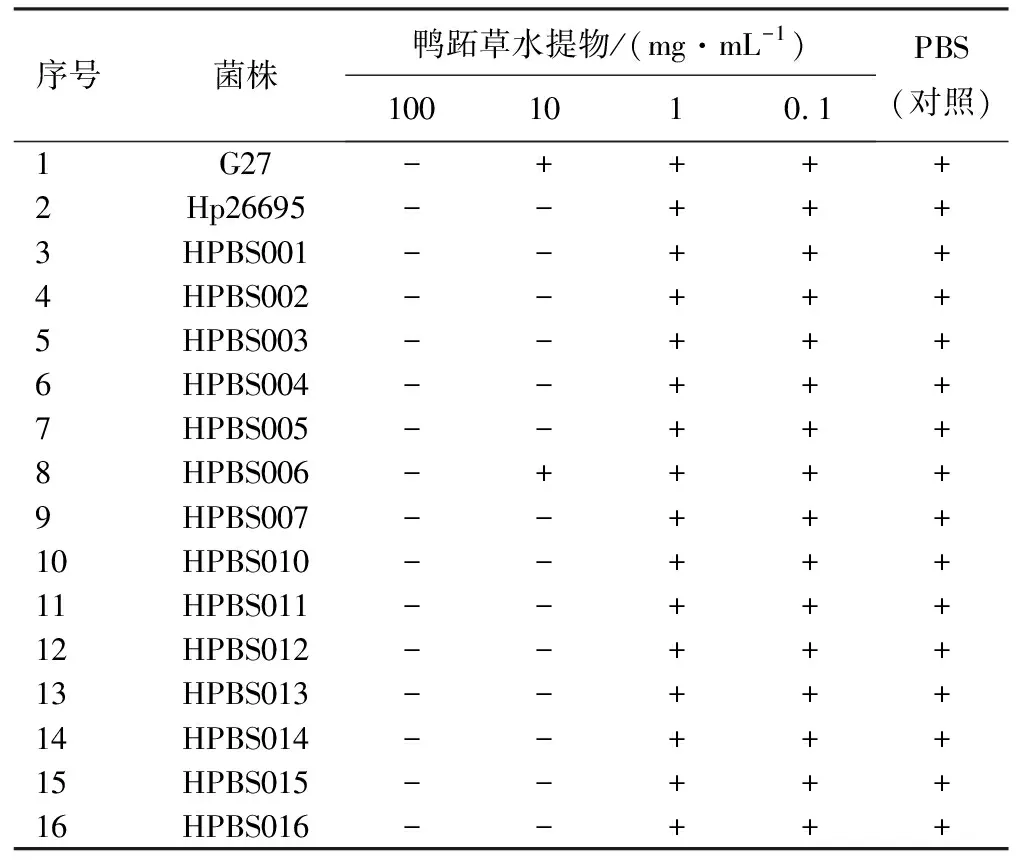
表2 鸭跖草水提物对不同H.pylori的MIC
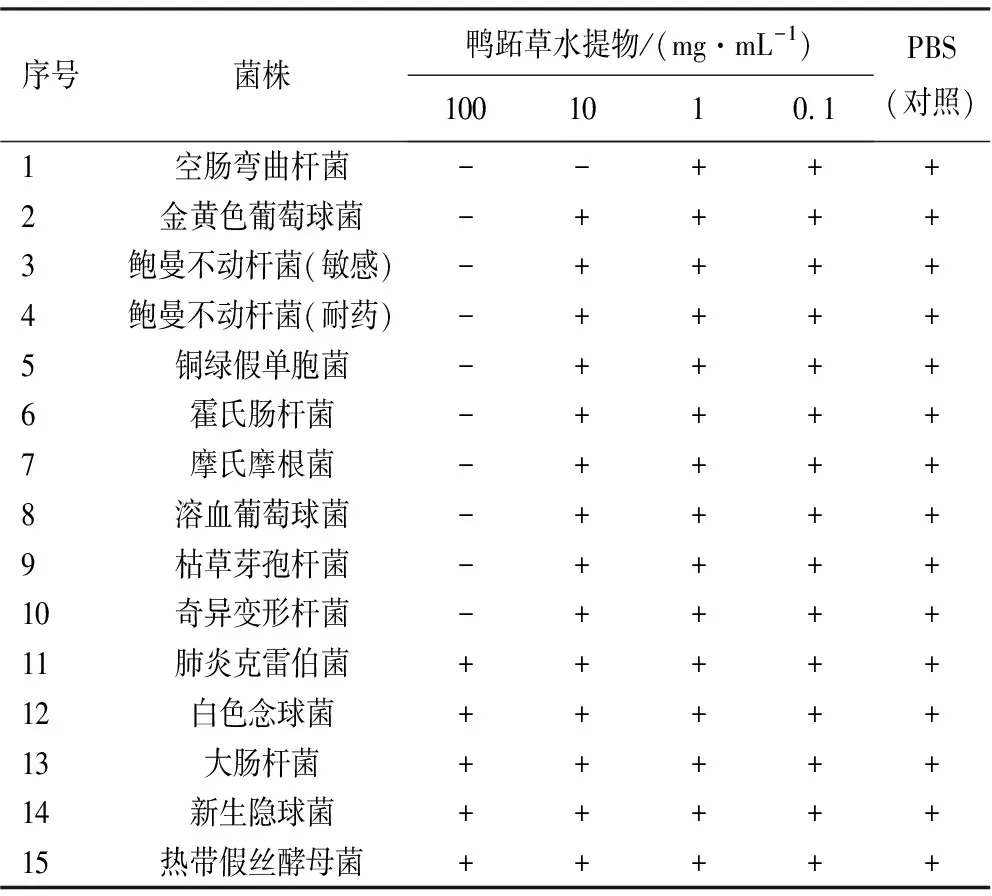
表3 鸭跖草水提物对非H.pylori菌株的MIC
2.2鸭跖草水提物对H.pylori形态结构的影响 使用扫描电子显微镜观察不同时间10 mg/mL浓度的鸭跖草水提物对H.pylori形态结构(如鞭毛)的影响。可见PBS组的H.pylori形态结构无明显变化,而随着时间的增加10 mg/mL鸭跖草水提物具有显著的使H.pylori鞭毛减少及球变的作用,见图1。
2.3鸭跖草水提物对H.pylori生物膜的抑制作用 阿尔玛蓝法检测不同浓度鸭跖草水提物对H.pylori生物膜的抑制作用,孔内颜色变化:蓝色为抑制;粉色为无效;发现在鸭跖草水提物100 mg/mL可以有效抑制生物膜,50 mg/mL可以较好抑制生物膜,与阳性药物克拉霉素颜色变化一致(见图2A)。同时,本研究检测药物作用后的生物膜蛋白含量,与PBS组相比,克拉霉素可以抑制30%的生物膜(P<0.001),200 mg/mL鸭跖草水提物可以抑制20%的生物膜(P<0.01),50 mg/mL鸭跖草水提物可以抑制10%的生物膜(P<0.05),呈浓度依赖性(见图2B)。

图1 鸭跖草水提物对H.pylori形态结构的影响(20 000×)
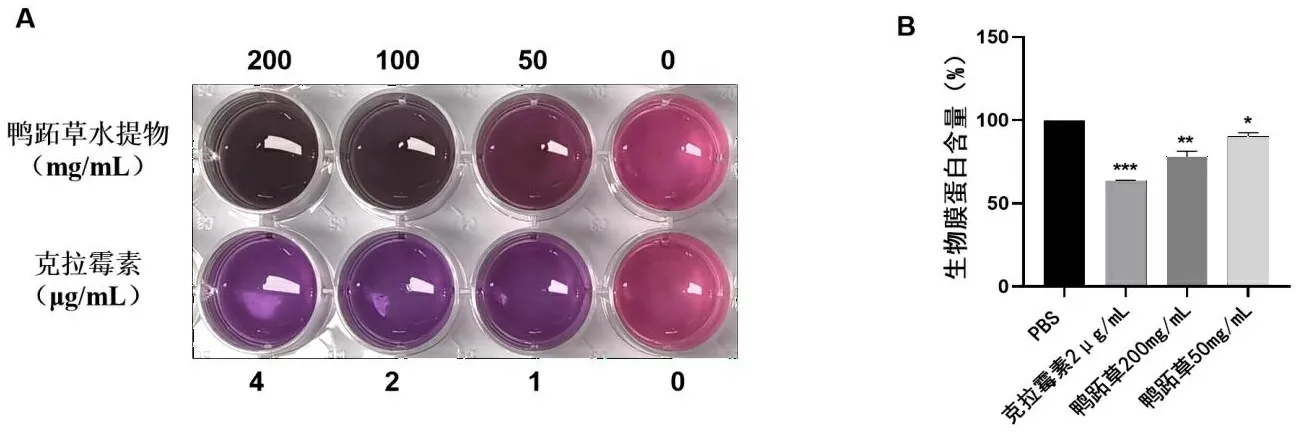
注:A为阿尔玛蓝实验测定生物膜;B为生物膜蛋白含量测定。
2.4鸭跖草水提物可以下调鞭毛基因FlaA及生物膜基因SpoT基于以上结果,本研究针对鞭毛基因FlaA及生物膜基因SpoT的mRNA相对表达量进行qPCR检测,发现H.pylori与100 mg/mL的鸭跖草水提物共孵育24 h后,与Control组相比,FlaA基因与SpoT基因均有一定程度的下调(P<0.05)。见图3。
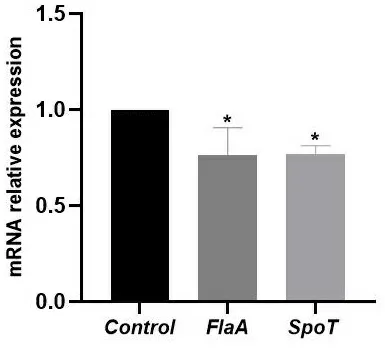
注:与Control组比较,*P<0.05。
3 讨论
鸭跖草具有多种药理作用,余昕等[11]发现鸭跖草的水提物相比于乙醇提取物抗炎效果更好,抗炎作用可能与其抑制炎症介质产生和抗氧化作用有关,所以本研究采用了水提法来制备鸭跖草药液使其具备更高的活性;在抗菌方面,有研究显示,鸭跖草对大肠杆菌、枯草芽孢杆菌、白色念珠菌等具有很好的抑制作用[9,12],但却未见鸭跖草抑制H.pylori的相关报道,本研究不仅针对以上菌株之外的12种非H.pylori菌株进行了MIC的检测,发现鸭跖草水提物在100 mg/mL就可以抑制大部分细菌的生长,具有很好的抑菌作用,这拓宽了鸭跖草的抗菌谱,除此之外,本研究还对16株H.pylori临床菌株(5株敏感株、11株耐药株)进行了MIC的检测,发现鸭跖草水提物在10 mg/mL就可以抑制大部分H.pylori生长,甚至是耐药H.pylori的生长,而对其他细菌无效,说明鸭跖草水提物在此浓度下对耐药H.pylori的抑菌效果好,作用专一,不容易产生菌群失调等副作用。
鞭毛是H.pylori重要的结构,H.pylori有4~8根单极鞭毛[13],鞭毛可能会影响它们在细菌、炎症和免疫逃避中的定植[14]。因此本研究使用扫描电子显微镜观察鸭跖草水提物对H.pylori形态结构的影响,发现随着药物浓度的增大,H.pylori的表面出现了不同程度的凹陷、泄漏和球变,鞭毛数量随着药物作用时间的增加出现了一定程度的减少,有研究显示H.pylori的这种类似于甜甜圈的球变可能与其细胞膜受损有关[15],因此鸭跖草水提物可能破坏了H.pylori的细胞膜,使其发生细胞质的泄漏而加速死亡。FlaA和FlaB是鞭毛丝的组成部分,对鞭毛的运动有很重要的作用;敲除了FlaA和FlaB基因的菌株表现出不规则鞭毛的减少和较低的运动能力,其黏附定植能力明显降低[16]。本研究发现鸭跖草水提物可以下调H.pyloriFlaA基因的表达,进而减少H.pylori在人体内的定植,无法定植的H.pylori在胃内游离更容易死亡,说明鸭跖草水提物抑制H.pylori的生长可能与FlaA基因有关。
有研究表明,H.pylori的鞭毛可能在生物膜结构形成过程中帮助其相互附着,并黏附在胃黏膜表面上[17],因此本次研究把研究的方向转向了生物膜,生物膜是一种与附着表面关联的被胞外多聚物(EPS)基质包裹的微生物细胞的聚合体[18]。与细菌浮游生物相比,生物膜细胞往往更耐受抗生素和宿主免疫反应[18-19]。有研究表明克拉霉素可以抑制H.pylori生物膜的形成[20],因此本研究使用克拉霉素作为阳性药物对照,发现鸭跖草可以在50 mg/mL抑制H.pylori生物膜的生长,同时其生物膜蛋白含量也随着药物浓度增加而逐渐减少,这说明鸭跖草水提物对H.pylori形成的致密生物膜具有一定的破坏作用,这可能也与鸭跖草水提物同时减少H.pylori的鞭毛,进而减少其生物膜的形成有关。本实验室往期研究[21]发现中药连翘中的成分连翘脂素可以抑制H.pylori生长并下调H.pylori生物膜基因SpoT,本研究发现,鸭跖草水提物也可以下调生物膜基因SpoT,抑制生物膜的形成,这可能也是H.pylori在药物作用下无法长期定植的关键原因之一。本实验的不足之处在于,尽管初步探索了鸭跖草水提物对H.pylori的抑菌作用及其作用机制,但未能阐明其具体抑菌机制;除此之外鸭跖草中还具有很多活性成分,因鸭跖草水提物未进行提纯,其具体的抑菌成分还需要后续更深入的研究。
综上所述,鸭跖草水提物对H.pylori有很好的抑制作用,其抑菌作用机制可能与抑制SpoT基因及FlaA基因表达有关。因鸭跖草水提物只是粗提物,其中可以分离出的很多成分或许有更优秀的抑菌作用,鸭跖草在未来的抗H.pylori道路上,具有很好的研究前景。

